实时荧光PCR法快速检测食用淀粉中的木薯成分
2015-10-31韩建勋吴亚君王斌葛毅强陈颖
韩建勋吴亚君王斌葛毅强陈颖*
(1.中国检验检疫科学研究院 北京 100176;2.中国农业大学食品科学与营养工程学院;3.中国农村技术开发中心)
实时荧光PCR法快速检测食用淀粉中的木薯成分
韩建勋1,2吴亚君1王斌1葛毅强2,3*陈颖1*
(1.中国检验检疫科学研究院 北京 100176;2.中国农业大学食品科学与营养工程学院;3.中国农村技术开发中心)
基于木薯、红薯及马铃薯g3pdh基因序列的差异,设计了木薯引物与探针,建立了木薯成分的实时荧光PCR检测方法,特异性强,灵敏度达0.1%(W/W)。通过检验29种不同淀粉来源的市售样品发现:标签中无木薯成分的5种红薯淀粉、2种马铃薯淀粉及1种藕粉均检出了木薯成分,标签错误标识率达27.6%。
淀粉;实时荧光PCR;木薯;g3pdh基因;检测
1 前言
薯类淀粉是我国的主要食用淀粉,包括红薯淀粉、马铃薯淀粉、木薯淀粉等,其中红薯淀粉价格相对较高。由于不同种类淀粉颗粒的感官性状和物化指标差别不大,消费者难以辨认,因此一些不法生产者便在红薯淀粉中掺入低价的木薯淀粉出售,赚取非法利润,损害消费者利益。近年来,国内外学者针对淀粉种类掺假开展了广泛研究。根据马铃薯淀粉与玉米淀粉在颗粒超微形貌上的明显差别,运用扫描电镜与稳定碳同位素比法能够准确鉴别马铃薯淀粉中掺假的玉米淀粉[1]。有研究报道采用红外光谱技术可有效检测藕粉中掺杂的马铃薯淀粉、红薯淀粉、木薯淀粉、玉米淀粉等[2-5]。另有学者利用淀粉肽指纹图谱区分了红薯淀粉、木薯淀粉及马铃薯淀粉[6]。虽然上述方法可通过淀粉颗粒的形态、结构等来区分鉴定淀粉种类,但在实际应用过程中易受到仪器昂贵、取样均匀性和代表性等问题的限制。实时荧光PCR技术通过分析物种DNA水平上的差异来鉴定物种真实属性,结果准确、可靠,且不受环境因素等影响,仪器普及率高,目前在食品真实属性鉴别方面有着越来越广泛的应用,例如鉴别肉制品中的鹿肉、猪肉成分[7,8],果汁中的水果成分[9],燕窝中掺杂的鸡蛋清、琼脂成分[10]等,部分已制定成检测标准并推广应用。本研究拟基于木薯g3pdh基因,建立快速灵敏的木薯成分实时荧光PCR检测方法,以期为规范食用淀粉市场和打击假冒伪劣产品提供技术支持。
2 材料与方法
2.1材料
2.1.1试验样品
木薯(M.esculenta)、红薯(I.batatas L.)、芋头(C.esculenta L.)、山药(D.opposita)、马铃薯(S. tuberosum L)、莲藕(N.nucifera)、玉米(Z.mays)、小麦(T.aestivum L.)、大麦(H.vulgare L.)、黑麦(S. cereale L.)、大米(O.sativa)、荞麦(F.esculentum)、高粱(Sorghum)、薏米(C.chinensis)、小米(S.italic L.)、绿豆(V.radiata L.)、赤小豆(V.umbellata)、豇豆(V.unguiculata)、扁豆(L.purpureus L.)、菜豆(P. vulgaris L.)、蚕豆(V.faba L.)、黄豆(G.max L.)等22种原料样品以及29份市售淀粉样品:均购自北京大型超市。
2.1.2试剂
NaCl、Tris-HCL、三氯甲烷、异丙醇:均为分析纯,国药集团化学试剂有限公司;CTAB:高纯级,美国Amresco公司;Na2-EDTA:生物技术级,美国Amresco公司;TaqMan®Gene Expression Master Mix:美国AB公司;food proof®GMO Sample Preparation kit:德国BIOTECON Diagnostics公司。
2.1.3引物及探针序列
植物通用型引物及探针来自文献[11],木薯特异性引物及探针基于木薯甘油醛-3-磷酸脱氢酶基因(glyceraldehyde-3-phosphate dehydrogenase,g3pdh)自行设计。所有引物探针均由上海英骏生物技术有限公司合成。
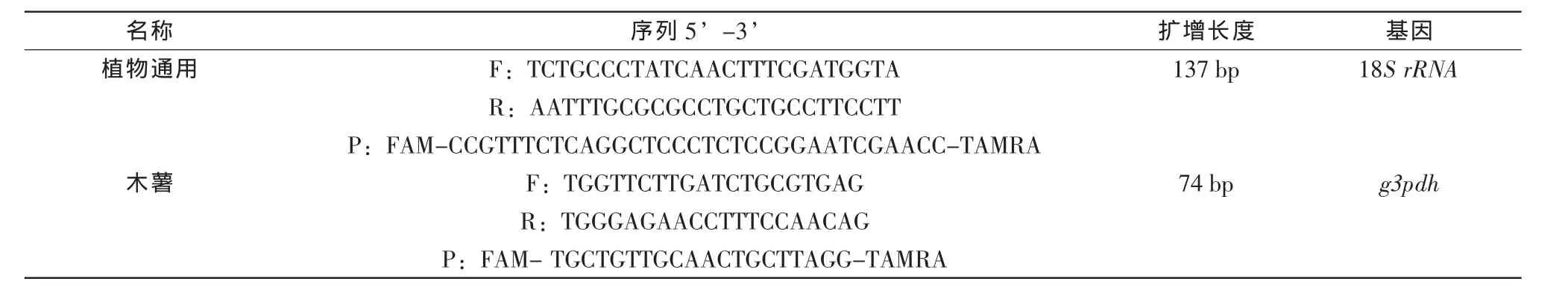
表1 引物及探针序列
2.1.4主要仪器设备
微量移液器(10 μL、100 μL、1000 μL):Eppendorf,Germany;烘箱VenticeⅡ:MMM,Germany;离心机5804R:Eppendorf,Germany;核酸蛋白分析仪DU640:Beckman,USA;ABI 7500实时荧光PCR仪:ABI,USA。
2.2方法
2.2.1自制淀粉
选取约1000 g新鲜红薯,洗净切块,用匀浆机打浆,浆液与红薯渣一并倒入白纱布袋中,清水冲洗,用2000 mL烧杯接纳滤液。边倒浆液边加清水,直至将渣中的浆液洗净为止。将滤得的红薯浆液于4℃冰箱中静置,每天搅动2-3次。待沉淀后,将表面的清液与残渣去除,取中间粉浆放入另一2 000 mL烧杯中,并加入适量清水使其悬浮,再次沉淀后去除上清液。待沉淀自然晾干即得粗制红薯淀粉。木薯淀粉制备同上。
2.2.2DNA提取
原料样品DNA提取参照文献中的CTAB法[12],市售淀粉样品DNA提取采用food proof®GMO Sample Preparation kit试剂盒提取。
2.2.3木薯引物及探针设计
选择g3pdh基因为目标基因,根据NCBI数据库中木薯(GenBank.FN551838.1)、红薯(GenBank. EF119215.1)、马铃薯(GenBank.NM_001288415.1)的g3pdh基因序列,采用Clustal W软件进行比对,根据差异性序列区域设计木薯特异性引物及探针。
2.2.4实时荧光PCR反应
采用25 μL的反应体系:TaqMan®Gene Expression Master Mix 12.5μL;上下游引物(10μmol/L)各0.5 μL;探针(10 μmol/L)0.5 μL;DNA模板5 μL,用无菌水补至总体系为25 μL。PCR扩增及结果分析在ABI 7500实时荧光PCR仪上进行。扩展程序为:95℃预变性10 min;95℃10 s,60℃60 s,共运行40个循环。
2.2.5方法特异性分析
采用木薯、红薯、芋头、山药、马铃薯、莲藕、玉米、小麦、大麦、黑麦、大米、荞麦、高粱、薏米、小米、绿豆、赤小豆、豇豆、扁豆、菜豆、蚕豆、黄豆共22种样品测试方法的特异性。
2.2.6方法灵敏度分析
将自制的木薯淀粉和红薯淀粉混合,使木薯淀粉和红薯淀粉的质量比分别为50%、10%、5%、1%、0.1%、0.01%,进行实时荧光PCR扩增,每个浓度设置5个平行,实验重复2次,即每个浓度得到10个对应的Ct值,以满足不小于95%置信区间的测试要求,计算阳性扩增的次数及检出概率;计算Ct值的标准偏差(SD)和相对标准偏差(RSD),验证方法的重复性。
2.2.7市售样品检测
对购买的2种木薯淀粉、6种红薯淀粉、7种马铃薯淀粉、2种小麦淀粉、1种绿豆淀粉、1种豌豆淀粉、1种藕粉及9种玉米淀粉共29份实际样品进行测试,每个样品取样2份,提取DNA后扩增18S rRNA基因以确保淀粉DNA提取的有效,避免假阴性;扩增木薯g3pdh基因判断样品中是否含有木薯成分。每个样品重复扩增3次。
3 结果与分析
3.1木薯引物及探针设计结果
采用Clustal W软件比对NCBI数据库中木薯(GenBank.FN551838.1)、红薯(GenBank.EF119215.1)、马铃薯(GenBank.NM_001288415.1)的g3pdh基因序列,根据序列差异性区域设计了木薯特异性引物及探针,序列比对及引物、探针设计结果见图1。

图1 木薯、红薯与马铃薯g3pdh基因序列比对结果
3.2方法特异性试验结果
利用植物通用型引物探针与木薯引物探针,分别对木薯、红薯、芋头、山药、马铃薯、莲藕、玉米、小麦、大麦、黑麦、大米、荞麦、高粱、薏米、小米、绿豆、赤小豆、豇豆、扁豆、菜豆、蚕豆、黄豆22种样品进行实时荧光PCR扩增,验证样品DNA的有效性以及木薯引物探针的特异性。利用18S rRNA植物通用型引物及探针扩增所有样品,均可见典型S型荧光扩增曲线(图2),说明所有样品都提取到有效的DNA,可用于后续的特异性检测。利用木薯引物探针扩增所有样品,仅有木薯样品产生显著的荧光扩增,Ct值为26.49±0.04;而其他21种样品以及空白对照(无菌水)均无荧光扩增信号(图3),说明所设计的引物探针具有较好的特异性,可特异性地扩增木薯成分。
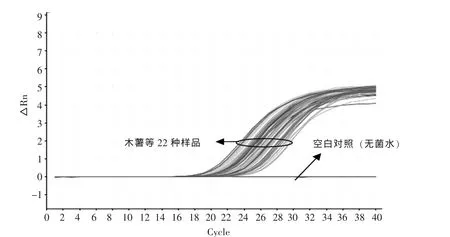
图2 植物通用型引物探针实时荧光PCR扩增结果

图3 木薯引物探针实时荧光PCR特异性扩增结果
3.3方法灵敏度试验结果
分别对含50%、10%、5%、1%、0.1%、0.01%(W/W)木薯淀粉的红薯淀粉样品进行实时荧光PCR扩增。结果表明:50%、10%、5%、1%、0.1%红薯淀粉样品其Ct值在28.37-35.79之间,且重复性较好,10次扩增均能检出;0.01%红薯淀粉样品10次重复扩增中有8次能够检出,检出率为80%(表2)。由此确定该方法的检测灵敏度为0.1%(W/W),即:能够检出掺假的木薯淀粉含量为0.1 g/100 g。

表2 木薯成分实时荧光PCR灵敏度检测结果
3.4市售样品检测
为进一步验证方法的实用性及准确性,对来自北京超市的2种木薯淀粉、6种红薯淀粉、7种马铃薯淀粉、2种小麦淀粉、1种绿豆淀粉、1种豌豆淀粉、1种藕粉及9种玉米淀粉等29种食用淀粉样品进行了木薯成分检测。检测发现,除2份木薯淀粉样品检测到木薯成分外,6份红薯淀粉样品中,有5份都检出了木薯成分,掺假率达83.3%;7份马铃薯淀粉样品中2份检出了木薯成分,检出率为28.6%;在购买的1份藕粉样品中也检测到了木薯成分。小麦淀粉、绿豆淀粉、豌豆和玉米淀粉中均未检出木薯成分(表3)。上述检测结果表明:由于外观较为相近,红薯淀粉、马铃薯淀粉是较容易被掺入木薯淀粉的产品,在产品质量控制中应对该类产品予以重点关注。

表3 市售淀粉样品中木薯成分检测结果
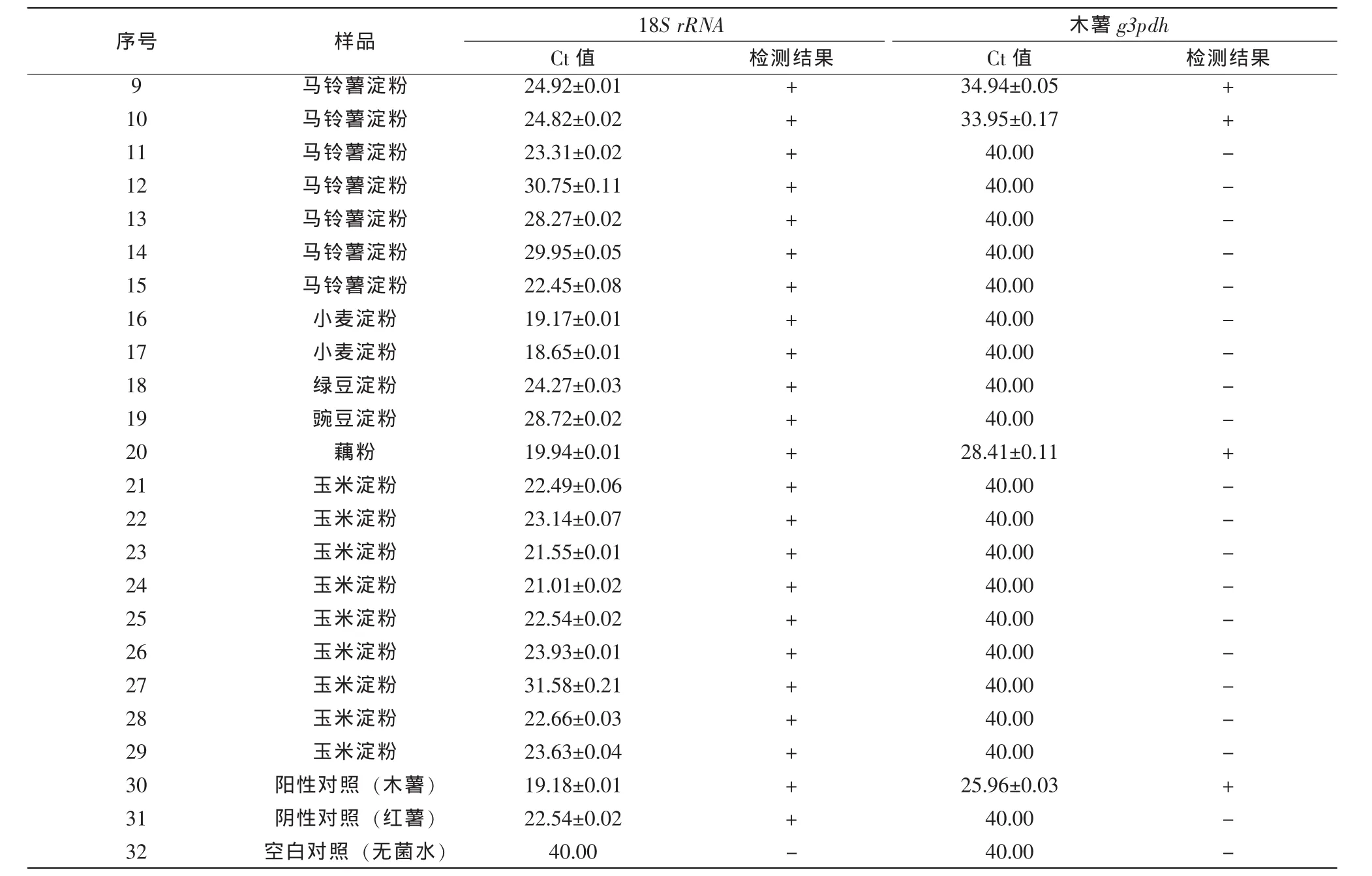
(续表3)
4 结论
本研究以木薯为研究对象,设计了基于木薯g3pdh基因的引物探针,建立了木薯成分实时荧光PCR检测方法。该方法可有效区分木薯与其他21种淀粉植物成分,对木薯成分的检测灵敏度达0.1%(W/W)。通过对市售的29种淀粉样品中木薯成分的检测,进一步验证了方法的有效性。该方法将为打击淀粉市场制假售假、规范市场秩序、保障消费者权益提供了有力的技术支撑。
[1]王绍清,武士奎,穆同娜,等.扫描电镜和稳定碳同位素比质谱法鉴别马铃薯淀粉中的掺假玉米淀粉[J].食品科学,2010,31(22):332-335.
[2]Niu X Y,Zhao Z L,Jia K J.Li X T.Feasibility study on quantitative analysis of glucose and fructose in lotus root powder by FT-NIR spectroscopy and chemometrics[J].Food Chemistry,2012,133:592-597.
[3]Liu J,Wen Y,Dong N,et al.Authentication of lotus root powder adulterated with potato starch andor sweet potato starch using Fourier transform mid-infrared spectroscopy[J].Food Chemistry,2013,141:3103-3109.
[4]Xu L,Shi P Tao,Ye Z H,et al.Rapid analysis of adulterations in Chinese lotus root powder(LRP)by near-infrared(NIR)spectroscopy coupled with chemometric class modeling techniques[J].Food Chemistry,2013,141:2434-2439.
[5]Xu L,Shi P Tao,Ye Z H,et al.Rapid geographical origin analysis of pure West Lake lotus root powder(WL-LRP)by near-infraredspectroscopycombinedwithmultivariateclass modeling techniques[J].Food Research International,2012,49:771-777.
[6]Cho D H,Han J A,Lim S T.Identification of botanical origin of starch by using peptide mass fingerprinting of granulebound starch synthase[J].Journal of Cereal Science,2013,57:264-266.
[7]Druml B,Grandits S,Mayer W,et al.Authenticity control of game meat products–A single method to detect and quantify adulteration of fallow deer(Dama dama),red deer(Cervus elaphus)and sika deer(Cervus nippon)by real-time PCR[J]. Food chemistry,2015,170:508-517.
[8]Soares S,Amaral J S,Oliveira M,et al.A SYBR Green real-time PCR assay to detect and quantify pork meat in processed poultry meat products[J].Meat science,2013,94(1):115-120.
[9]Han J X,Wu,Y J,Huang W S,et al.PCR and DHPLC methods used to detect juice ingredient from 7 fruits[J].Food Control,2012,25(2):696-703.
[10]Guo L,Wu Y,Liu M,et al.Authentication of Edible Bird's nests by TaqMan-based real-time PCR[J].Food Control,2014,44:220-226.
[11]SN/T3729.2-2013出口食品及饮料中常见水果品种的鉴定方法第2部分:杏成分检测实时荧光PCR法[S].
[12]Wang W,Han J,Wu Y,et al.Simultaneous detection of eight food allergens using optical thin-film biosensor chips[J]. Journalofagriculturalandfoodchemistry,2011,59(13):6889-6894.
A Real-Time PCR Assay for Detection of Cassava Component in Edible Starch
Han Jianxun1,2,Wu Yajun1,Wang Bin1,Ge YiQiang2,3*,Chen Ying1*
(1.Chinese Academy of Inspection and Quarantine,Beijing,100176;2.College of Food Science and Nutritional Engineering,China Agricultural University;3.China Rural Technology Development Center)
The cassava primers and probe were designed based on the sequence differences of g3phd gene among cassava,sweet potato and potato.And a real-time PCR method was established to detect cassava component.The sensitivity of the method could reach to 0.1%(W/W).Twenty-nine kinds of commercially samples were selected and detected.The detection result showed that cassava component was detected in 8 samples including 5 sweet potato starch,2 potato starch and 1 lotus root starch.The mislabeled rate was 27.6%.
Starch;Real-Time PCR;Cassava;g3pdh Gene;Detection
Q789
E-mail:hanjianxun19830418@163.com;*通讯作者E-mail:68511009@163.com;chenyingcaiq@163.com
中国检科院基本科研业务费专项资金项目(2014JK029);863计划项目(2011AA100807)
2015-09-11
