抗菌肽LL37联合肽聚糖对单核细胞分化的影响
2015-10-31青白彦萍钱雷李
钱 青白彦萍钱 雷李 明
3高春岩1申宇鸿1
抗菌肽LL37联合肽聚糖对单核细胞分化的影响
钱 青1白彦萍2钱 雷3李 明
3高春岩1申宇鸿1
目的: 明确LL37联合肽聚糖(PGN)对单核细胞分化的影响。方法: 健康成年人外周血单核细胞经LL37、PGN、LL37+PGN刺激培养,16 h后流式细胞术(FCM)检测细胞表面CD14、CD16、髓系细胞触发受体-1(TREM-1),5天后检测不成熟树突状细胞(iDC)表面标记HLA-DR、CD1a、CD86的表达。诱导形成的iDC与异体淋巴细胞共培养3天,FCM检测Th17细胞的表达,MTT法检测T细胞的增殖。结果: LL37+PGN组与PGN组、LL37组比较,CD14++CD16+单核细胞亚群比例、细胞表面TREM-1表达、iDC比例、T细胞增殖和Th17细胞比例均明显增加,差异均有统计学意义(均P<0.05)。结论: LL37联合PGN诱导单核细胞向CD14++CD16+单核细胞亚群极化,最终导致T细胞增殖和向Th17细胞分化。
银屑病; 抗菌肽LL37; 肽聚糖; 单核细胞
银屑病是一种常见的慢性炎症性皮肤病,是具有特定遗传背景(基因)的人群在环境(以感染为主)的作用下引起复杂的细胞免疫紊乱。除了自身反应性T细胞活化和表皮角质形成细胞异常增殖,固有免疫系统因细菌、真菌等微生物感染引起过度活化在疾病过程中也发挥重要作用。1其中,单核巨噬细胞活化,在病损部位产生炎症因子、趋化因子,导致炎症反应,并影响适应性免疫,诱导Th17形成,参与疾病的发生发展。2
抗菌肽LL37和细菌细胞壁主要成分肽聚糖(peptidoglycan,PGN)在银屑病发病机制中均发挥重要作用。3患者皮损中含有PGN的巨噬细胞比例升高,并导致T细胞增殖;4PGN还可诱导角质形成细胞(KC)分泌高浓度的LL37,导致皮损处和血液中LL37升高。5另一方面,LL37可作为免疫效应活化分子,减轻病原微生物对单核巨噬细胞的刺激。6因此,有必要探讨LL37联合PGN对单核细胞生物学功能的影响,阐明单核细胞在银屑病疾病过程中的作用。
1 材料与方法
1.1研究对象 选取健康志愿者10名,男、女各5名,年龄22.4±5.1岁,无自身免疫性疾病或近期感染史,经北京市和平里医院伦理委员会批准,征得志愿者知情同意并签订知情同意书,采集外周血。
1.2主要仪器与试剂 LL37购自Innovagen公司,PGN购自Invivogen公司,异硫氰酸荧光素(FITC)鼠抗人-CD14、叶绿素蛋白偶联物(PerCP-cy5.5)鼠抗人-CD16、PE-鼠抗人CD1a、PE-鼠抗人CD86、别藻蓝蛋白(APC)鼠抗人-HLA-DR单克隆抗体及同型对照购自BD公司,PE-鼠抗人髓系细胞触发受体-1(TREM-1)及同型对照购自R&D公司;RPMI 1640细胞培养液购自Gibco公司;重组人粒细胞-巨噬细胞集落刺激因子(rhGM-CSF)、重组人白介素-4(rhlL -4)购自Peprotech公司;人淋巴细胞分离液(Ficoll)购自上海恒信;白细胞介素-6(IL-6)、IL-8、肿瘤坏死因子-α(TNF-α)、IL-1β、IL-23、粒细胞巨噬细胞刺激因子(GM-CSF)检测试剂购自Bio-Rad公司,用Luminex200流式荧光检测仪分析。Th1/Th17流式检测试剂盒购自BD公司。四氮唑盐(MTT)购自Sigma公司。流式细胞仪FACSCanto为BD公司产品。
1.3方法
1.3.1贴壁法分离健康志愿者单核细胞 健康成人静脉血经肝素抗凝,用Ficoll密度梯度离心法分离单个核细胞(PBMC),用磷酸盐缓冲液(PBS)洗涤2次,1500 rpm离心6 min,弃上清,RPMI 1640细胞培养液(10%胎牛血清、100 U/L青霉素、100 U/L链霉素)重悬,置于37℃5%CO2孵箱培养2 h后倾去未贴壁细胞,再加入RPMI 1640细胞培养液,继续培养6 h,收集单核细胞,经FITC-鼠抗人CD14鉴定细胞纯度85%~90%,台盼蓝拒染法鉴定细胞存活率>95%。
1.3.2LL37和PGN刺激单核细胞 将浓度为1× 105/mL的单核细胞接种在96孔或24孔培养板内,分别加入10μg/mL PGN、20μg/m L LL37、LL37(20 μg/mL)+PGN(10μg/mL),置于37℃ 5%CO2孵箱培养16 h后,收集部分培养孔,1500 rpm离心6 min,吸取上清液作细胞因子检测,收集细胞,PBS洗涤,分别用于流式细胞术(FCM)检测CD16、CD14、TREM-1平均荧光强度(MFI)或阳性细胞频率。其余细胞置于37℃ 5%CO2孵箱诱导形成不成熟树突状细胞(iDC),用rhGM-CSF(50 ng/m L)+rhlL-4(25 ng/m L)培养部分细胞作为对照组,培养至5天,收集细胞,PBS洗涤后,部分细胞用于 FCM检测CD14、HLADR、CD1a、CD86阳性细胞频率,部分细胞用于同种异体混合淋巴细胞反应(MLR)。
1.3.3流式细胞术检测细胞表面受体 每100μL细胞培养液加入10μL各种流式抗体及同型对照,室温避光孵育30min,用1m L PBS洗涤2次,1500 rpm离心6 min,弃上清,加入400μL PBS重悬细胞。用FACSCanto检测,并采用BD FACSDiva软件分析数据。以所有细胞设门,读取细胞CD14、CD16、CD1a、HLA-DR、CD86、TREM-1平均荧光强度(MFI)或阳性细胞频率。
1.3.4混合淋巴细胞反应 取异体健康成人肝素抗凝外周血,用Ficoll密度梯度离心法分离PBMC,PBS洗涤,于37℃贴壁培养4 h后收集非贴壁细胞作为同种异体T细胞备用。将上述培养的iDC用RPMI 1640完全培养液调整细胞浓度为1×105/mL,将iDC与T细胞按1∶10的比例接种于96孔板,终体积200 μL/孔,置于37℃ 5%CO2孵箱培养3 d,部分细胞采用MTT比色法检测T细胞增殖,其余细胞用FCM检测Th17细胞频率。
1.3.5MTT比色法检测 T细胞增殖 终体积200 μL/孔,加入100μLMTT(5 g/L)继续孵育4 h,离心弃上清后,每孔加入二甲基亚砜(DMSO)150μL,孵育10 min,酶标仪检测A570值,结果以3复孔均值表示。
1.3.6Luminex200检测上清液细胞因子浓度 所有上清液收集后,立即储存在-80℃。按试剂说明书检测上清液IL-6、TNF-α、IL-1β、IL-8、IL-23、GMCSF,用Luminex200流式荧光检测仪分析。
1.4统计学方法 用Stata7.0统计软件对数据进行正态性检验,本次研究全部为计量资料,均为正态性分布,用均数±标准差表示,多组比较用单因素方差分析(ANOVA),作双侧检验,P<0.05为有统计学意义。
2 结果
2.1LL37联合PGN对单核细胞分泌细胞因子的影响 LL37、PGN、LL37+PGN与单核细胞孵育16 h,检测上清液细胞因子浓度。与空白对照组相比,LL37组IL-6、TNF-α、IL-8降低,但IL-1β升高,差异有统计学意义(P<0.05);PGN组IL-6、TNF-α、IL-1β、IL-8、IL-23升高,差异有统计学意义(P<0.05)。LL37+PGN组与PGN组比较,IL-6、TNF-α、IL-8降低,GM-CSF、IL-1β升高,差异有统计学意义(P<0.05)。结果见表1。
2.2LL37联合PGN对单核细胞极化和TREM-1表达的影响 LL37、PGN、LL37+PGN与单核细胞孵育16 h,LL37组、PGN组与空白对照组比较,CD14++CD16+单核细胞亚群比例差异无统计学意义(P>0.05);LL37+PGN组与其它3组比较,CD14++CD16+单核细胞比例升高,差异有统计学意义(P<0.05);与空白对照组、LL37组比较,PGN组、LL37+PGN组TREM-1MFI均升高,但LL37+PGN组升高更显著,差异有统计学意义(P<0.05)。结果见表2。TREM-1MFI和CD14++CD16+阳性细胞频率(R4区)分别见图1和图2。
2.3LL37联合 PGN诱导单核细胞向iDC分化
LL37、PGN、LL37+PGN与单核细胞孵育5 d,FCM检测细胞表面CD1a、HLA-DR、CD14阳性细胞频率。LL37组、PGN组与空白对照组比较差异无统计学意义(P>0.05),LL37+PGN组CD1a、HLA-DR、CD86阳性细胞频率增高,CD14阳性细胞频率降低,与其它3组比较差异有统计学意义(P<0.05)。但诱导iDC形成的比例低于rhGM-CSF+rhlL-4诱导形成的iDC,差异有统计学意义(P<0.05),结果见表3。
2.4iDC诱导T细胞增殖和Th17细胞分化 iDC与异体淋巴细胞共培养3 d,LL37+PGN组T细胞增殖显著升高,与其它3组比较差异有统计学意义(P<0.05)。LL37+PGN组和PGN组均可诱导T细胞向Th17分化,但LL37+PGN组诱导的Th17细胞比例高于PGN组,差异有统计学意义(P<0.05),结果见表4,Th17细胞流式检测图,见图3。

表1 单核细胞培养上清液细胞因子浓度

表2 中间型单核细胞比例和TREM-1表达

表3 单核细胞分化为iDC频率

表4 Th17细胞比例和T细胞增殖
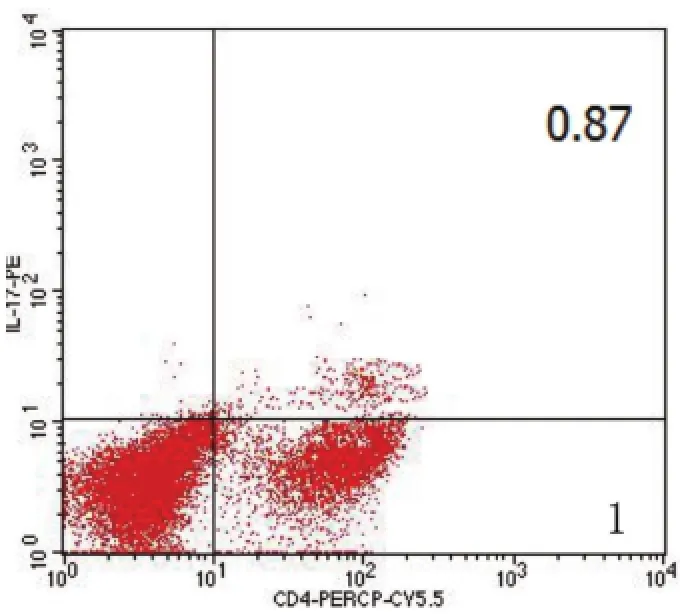
图1 单核细胞TREM-1MFI
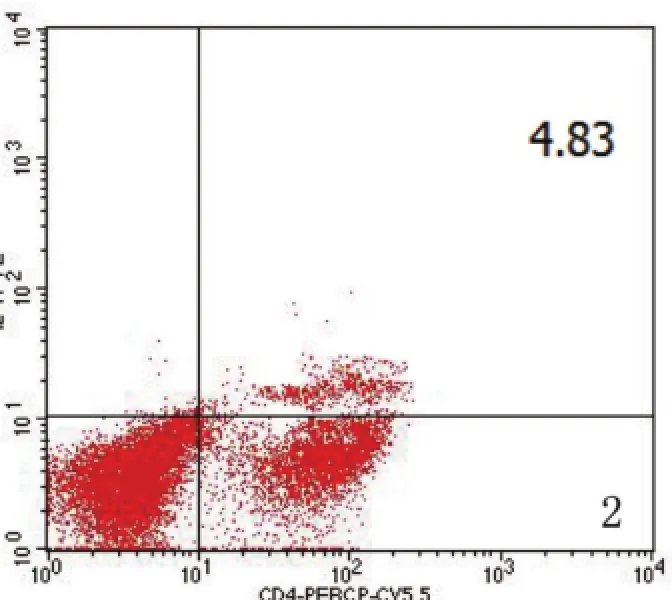
图2 单核细胞亚群检测

图3 Th17细胞阳性频率流式图
3 讨论
较多研究者认为PGN是诱发银屑病的重要因素,4此理论有下列依据:(1)银屑病患者存在肽聚糖识别蛋白家族3(PGRP3)和PGRP4基因突变;(2)在银屑病患者病变皮肤处可分离出识别细菌PGN的抗原特异性T细胞;(3)通过16S rRNA基因序列分析、革兰氏染色、免疫荧光等多种技术证实,在正常人皮肤的表皮、真皮和浅表脂肪组织都存在细菌及其产物,从而导致各种免疫细胞可与细菌相互接触。最常见的细菌包括葡萄球菌和链球菌等,另外,机体其他部位的感染,如:扁桃体、肠道、牙周炎也会诱发银屑病。
抗菌肽LL37在正常皮肤不表达,而在银屑病皮损中高表达,主要来源于皮肤角质形成细胞(KC),部分来源于趋化到局部的中性粒细胞、单核细胞、淋巴细胞等免疫细胞。KC高表达LL37的诱因是创伤、感染和药物。LL37可防御机体免受微生物侵袭,但LL37通过多个机制参与银屑病的发病,如:LL37/ DNA、LL37/RNA复合物,分别以Toll样受体(TLR)9、TLR7依赖的方式激活浆细胞样树突细胞(pDC),还可以刺激KC分泌IFN-α、IL-1β、IL-6,激活髓样树突状细胞(mDCs),LL37/RNA复合物也可直接通过TLR-8依赖的方式激活mDCs。3
本次研究发现,LL37能减少PGN引起的单核细胞分泌TNF-α、IL-6、IL-8等炎症分子,但促进分泌IL-1β、GM-CSF。LL37及其片段衍生的阳离子肽具有调节细胞因子分泌的功能,Ruan等6研究发现,LL37可通过抑制TLR2配体脂磷壁酸(LTA)活化p38MAPK和 Akt磷酸化,从而抑制巨噬细胞分泌TNF-α、IL-6等炎症分子,减少促炎细胞因子的释放。LL37的片段LL33可促进单核细胞分泌IL-1β。7
LL37可明显上调PGN对单核细胞TREM-1的活化,Amatngalim的研究也有类似的结果,8机制可能是LL37能影响了细胞膜的动力学,有助于PGN进入细胞内。9TREM-1活化可导致单核细胞产生IL-1β、GM-CSF、IL-8、髓过氧化物酶(MPO)、IL-6、TNF-α等促炎细胞因子,从而放大炎症反应。10TREM-1活化还可诱导巨噬细胞向促炎型(M1)极化,抑制GMCSF活性可阻断此极化作用。11本次实验单核细胞经LL37联合PGN刺激培养16 h,观察到单核细胞向中间型(CD14++CD16+)极化,中间型单核细胞具有较强的抗原提呈和加工能力;经典型(CD14++CD16-)单核细胞具有很强的吞噬功能;非经典型(CD14+CD16++)单核细胞主要在血管内壁执行巡逻任务,在浸润组织后分化为巨噬细胞。12
单核细胞经LL37联合PGN刺激培养5 d,观察到iDC特征性标记CD1a及其MHCII分子HLA-DR表达增加,单核细胞特征性标记CD14表达显著下降,提示细胞在LL37联合PGN的刺激下逐渐向iDC分化。LL37和TREM-1在单核细胞分化为DC的过程中均可发挥调控作用。Bleharski等10用TREM-1活化性抗体活化单核细胞TREM-1,诱导单核细胞分化为iDC,高表达CD1a、CD86、和MHC II类分子,导致T细胞增殖。在缺氧微环境下,TREM-1在诱导单核细胞分化为DC的过程中发挥重要作用。13单核细胞在LL37存在的条件下,GM-CSF/IL-4诱导的iDC表面CD86、CD11b、CD11c和CD18表达增加。14
在机体免疫应答反应中,Th属于适应性免疫系统,DC等抗原提呈细胞接受刺激的抗原性质和微环境决定初始CD4 T细胞向Thl、Th2、Thl7等不同亚群分化。目前银屑病被界定为Thl/Thl7共同介导的免疫紊乱。Th1分泌干扰素1(IFN-γ)、IL-2和TNF-α等,Thl7则分泌IL-17和IL-22等细胞因子,这些细胞因子单独或者协同作用,引起银屑病的病理改变,拮抗Th1/Th17细胞因子的生物制剂对银屑病具有肯定的临床疗效。本次实验LL37和PGN诱导单核细胞形成的iDC与异体淋巴细胞共培养,诱导T细胞增殖和向Thl7分化。已证实,与正常皮肤相比,银屑病患者病损组织单核细胞来源的DC明显增多,15高表达MHC II类分子,并分泌IL-12和IL-23诱导Th细胞分化为Thl和Thl7。Hyder等16研究也表明,与健康人皮肤组织相比,银屑病患者皮损组织TREM-1阳性细胞约升高了3倍,经双色荧光染色检测,TREM-1阳性细胞主要包括:髓系树突状细胞(mDC)、内皮细胞、巨噬细胞。
综上所述,在LL37和PGN同时存在的情况下,单核细胞减少了TNF-α、IL-6、IL-8等炎症因子的产生,但GM-CSF分泌增加,活化TREM-1,诱导单核细胞向中间型单核细胞极化,并进一步分化为iDC细胞,然后影响适应性免疫,导致Th17细胞分化增加。此机制可能在银屑病发生发展中具有重要作用。但是,本次研究是体外实验,与体内的免疫反应可能有较大差异。因此,通过阻断单核细胞向中间型单核细胞极化和iDC分化来治疗银屑病尚需进一步深入研究。
1王刚.银屑病研究热点.中华皮肤科杂志,2013,46(3):153-156.
2Evans HG,Gullick NJ,Kelly S,et al.In vivo activated monocytes from the site of inflammation in humans specifically promote Th17 responses.Proc Natl Acad Sci USA,2009,106:6232 -6237.
3 Batycka-Baran A,Maj J,Wolf R,et al.The new insight into the role of antimicrobial proteins-alarmins in the immunopathogenesis of psoriasis.J Immunol Res,2014,2014:628289.
4 Fry L,Baker BS,Powles AV,et al.Is chronic plaque psoriasis triggered by m icrobiota in the skin?Br J Dermatol,2013,169(1):47-52.
5 Hwang YJ,Jung HJ,Kim MJ,et al.Serum levels of LL-37 and inflammatory cytokines in plaque and guttate psoriasis.Mediators Inflamm,2014,2014:268257-268267.
6Ruan Y,Shen T,Sun T,etal.Antimicrobial peptide LL-37 attenuates LTA induced inflammatory effect in macrophages.Int Immunopharmacol,2013,15(3):575-580.
7Gustafsson A,Sigel S,Ljunggren L.The antimicrobial peptide LL37 and its truncated derivatives potentiates proinflammatory cytokine induction by lipoteichoic acid in whole blood.Scand J Clin Lab Invest,2010,70(7):512-518.
8 Amatngalim GD,Nijnik A,Hiemstra PS,et al.Cathelicidin peptide LL-37 modulates TREM-1 expression and inflammatory responses tomicrobial compounds.Inflammation,2011,34(5):412-425.
9Sandgren SA,Wittrup F,ChengM,etal.The human antimicrobial peptide LL-37 transfers extracellular DNA plasmid to the nuclear compartment ofmammalian cells via lipid rafts and proteoglycan-dependent endocytosis.JBiological Chem istry,2004,279:17951-17956.
10 Bleharski JR,Kiessler V,Buonsanti C,et al.A role for triggering receptor expressed onmyeloid cells-1in host defense during the early induced and adaptive phases of the immune response.J lmmunol,2003,170(7):3812-3818.
11 Lo TH,Tseng KY,TsaoWS,etal.TREM-1 regulatesmacrophage polarization in ureteral obstruction.Kidney Int,2014,86(6):1174-1186.
12Wong KL,Yeap WH,Tai JJ,etal.The three humanmonocyte subsets:implications for health and disease.Immunol Res,2012,53(1-3):41-57.
13 Bosco MC,Pierobon D,Blengio F,et al.Hypoxiamodulates the gene expression profile of immunoregulatory receptors in humanmature dendritic cells:identification of TREM-1 as a novel hypoxic marker in vitro and in vivo.Blood,2011,117(9):2625-2639.
14Davidson DJ,Currie AJ,Reid GS,et al.The cationic antimicrobial peptide LL-37 modulates dendritic cell differentiation and dendritic cell-induced T cell polarization.J Immunol,2004,172(2):1146-1156.
15 Lima Ede A,Lima Mde A.Reviewing concepts in the immunopathogenesisof psoriasis.An Bras Dermatol,2011,86(6):1151 -1158.
16 Hyder LA,Gonzalez J,Harden JL,etal.TREM-1 as a potential therapeutic target in psoriasis.J Invest Dermatol,2013,133(7):1742-1751.
(收稿:2015-01-29 修回:2015-05-14)
·临床研究·
Effect of antim icrobial peptides LL37 com bined w ith peptidoglycan on the d ifferentiation ofmonocytes
QIAN Qing,BAIYan-ping,QIAN Lei,et al.Department ofDermatology,Peking Hepingli Hospital,Beijing,P.R.China,100013
Objective:To determine the effectof antimicrobial peptides LL37 combined with peptidoglycan(PGN)on the differentiation ofmonocytes.Methods:Monocytes from peripheral blood of healthy adultswere cultured in themedium of LL37,PGN and LL37 combined PGN.The levels of triggering receptor expressed on myeloid cells-1(TREM-1),CD14 and CD16 were detected by flow cytometry(FCM)after 16 h culture.The levels of HLA-DR,CD1a and CD86 on immature dendritic cell(iDC)were detected by FCM after culture for 5 days.T cells proliferation and Th17 polarization were detected by MTT and FCM respectively after iDC cocultured with lymphocyte for 3 days.Results:The percentage of CD14++CD16+monocytes and Th17,the levels of TREM-1 and iDC and the proliferation of T cells in the LL37 combined PGN group were obviously higher than those in the PGN group and LL37 group(P<0.05).Conclusion:Antimicrobial peptides LL37 in combination with PGN can induce themonocytes differentiation into CD14++CD16+,which finally induce the proliferation of T cells and differentiation to Th17.
psoriasis;antimicrobial peptides LL37;peptidoglycan;monocytes
北京市东城区科技计划项目(编号:2014-4-005)
1北京市和平里医院,北京,100013
2北京市中日友好医院,北京,100013
3盐城市滨海县人民医院,江苏滨海,224500
