解冻后兔肉待加工过程中肌原纤维蛋白功能性质的变化
2015-10-29张斌斌王晓君尚永彪
林 静,张斌斌,王晓君,尚永彪,2,3,*
(1.西南大学食品科学学院,重庆 400716;2.农业部农产品贮藏保鲜质量安全评估实验室(重庆),重庆 400716;3.重庆市特色食品工程技术研究中心,重庆 400716)
解冻后兔肉待加工过程中肌原纤维蛋白功能性质的变化
林静1,张斌斌1,王晓君1,尚永彪1,2,3,*
(1.西南大学食品科学学院,重庆400716;2.农业部农产品贮藏保鲜质量安全评估实验室(重庆),重庆400716;3.重庆市特色食品工程技术研究中心,重庆400716)
研究解冻后兔肉待加工过程中肌原纤维蛋白(myofibrillar protein,MP)功能性质的变化。兔后腿肉及背最长肌肉置于-18 ℃ 条件下冻藏7 d,取出在20 ℃水中解冻至中心温度为0 ℃后,放置7 h,测定在放置过程中兔肉的MP溶解性、活性巯基及总巯基含量、乳化性、表面疏水性、流变学性质、凝胶特性。结果显示:随着在水中放置时间的延长,兔肉MP溶解度、巯基含量、乳化活性和乳化稳定性、凝胶特性逐渐下降,在4 h时下降较为显著(P<0.05);MP表面疏水性逐渐上升,在4 h时上升较为显著(P<0.05);MP弹性模量G'值在加热过程中也逐渐降低,兔肉蛋白形成凝胶的能力减弱。
兔肉;待加工;肌原纤维蛋白;功能性质
兔肉味道鲜美、肉质细嫩、容易消化、营养丰富,是中华民族的传统膳食,具有“三高三低”(高消化率、高赖氨酸、高蛋白、低热量、低胆固醇、低脂肪)的特点[1-2]。我国是世界兔肉生产和出口大国,养兔业的大规模商品生产开始于20世纪50年代中后期,目前形成了兔肉销售以国内市场为主、国外市场为辅的格局[3]。近些年我国兔肉加工业得到了发展,但是面向市场、适合大众消费的产品仍不多,且科技含量较低,影响兔肉的消费量和消费市场。此外,兔肉加工企业技术水平普遍不高,还存在着不少共性问题。
据调查,目前兔肉加工企业通常使用冻兔原料进行生产,因加工条件有限和成本控制的原因,大部分企业在兔肉解冻后待加工的过程中没有采用人工控制环境温度的措施,在气温较高的季节待加工原料的品质会发生较大的变化、会严重影响产品的品质。肌原纤维蛋白(myofibrillar protein,MP)在肉制品加工中起到非常重要的作用,MP功能性质主要包括溶解性、疏水性、凝胶特性、乳化性、流变学性质等,这些性质会影响产品的加工出品率、产品的质地和口感等方面的品质。宰后的鲜肉与解冻后的原料肉的品质有明显的不同,目前国内外对猪肉、鱼肉等肉类解冻后待加工过程中MP功能性质的研究较多,但对兔肉的研究尚未见报道。研究兔肉在解冻后待加工过程中MP性质的变化规律,可为兔肉加工企业的生产组织、品质控制、技术改造及工艺配方的改进提供一定的理论依据。
1 材料与方法
1.1材料与试剂
实验原料为活的雄性伊拉兔,饲养周期2.5 个月,平均体质量约2.3 kg,购自西南大学养兔场。
KCl、5,5'-二硫双(2-硝基苯甲酸)、K2HPO4、KH2PO4、Na2HPO4、NaH2PO4、CuSO4、酒石酸钾钠成都市科龙化工试剂厂;MgCl2天津市福晨化学试剂厂;乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、乙二醇双(2-氨基乙基醚)四乙酸(ethylene flycol tetraacetic acid,EGTA)西安沃尔森生物技术有限公司;二硫苏糖醇(DL-dithiothreitol,DTT)上海研卉生物科技有限公司;尿素、NaN3重庆北碚化学试剂厂;溴酚蓝北京鼎国昌盛生物技术有限责任公司;牛血清白蛋白上海伯奥生物科技有限公司。以上试剂均为分析纯。
1.2仪器与设备
PHS-4C+酸度计成都世纪方舟科技有限公司;722-P可见分光光度计上海现代分光仪器有限公司;Avanti J-30I冷冻离心机美国贝克曼库尔特公司;5810型台式高速离心机德国Eppendorf公司;HR-1流变仪美国TA公司;TA.XT2i质构仪英国Stable Microsystem公司。
1.3方法
1.3.1样品预处理
将活兔击晕、屠宰后,将其后腿肉、背最长肌切成3 cm×1 cm×1 cm左右的长条,用自封袋密封后置于4 ℃冰箱中预冷48 h,之后置于-18 ℃的冰箱中冻藏7 d。
取出冻藏肉样,置于20 ℃静水解冻,至解冻终点(中心温度为0 ℃时)开始计时,测定0、1、2、3、4、5、6、7 h的MP溶解性、活性巯基及总巯基含量、乳化活性及乳化稳定性、表面疏水性、流变学性质、凝胶特性指标。
1.3.2MP提取方法
参照Xiong等[4]的方法并做一定的修改。将不同时间段兔肉剔除结缔组织、脂肪,绞碎,取一定肉样,肉样质量10倍体积的冰缓冲液A(0.1 mol/L KCl、0.5 mmol/L DTT、1 mmol/L EGTA、10 mmol/L K2HPO4、2 mmol/L MgCl2,pH 7.0),高速匀浆1 min,过滤,将滤液离心10 min(5 500 r/min,4 ℃),去除上清液,重复离心两次;加入4 倍体积冰缓冲液B(1 mmol/L NaN3、0.1 mol/L NaCl,pH 6.25),高速匀浆30 s,离心10 min(5 500 r/min,4 ℃),去除上清液,重复离心一次,再加入8 倍体积冰缓冲液B,高速匀浆1 min,离心10 min(5 500 r/min,4 ℃),除去上清液后,沉淀即为MP。
1.3.3MP质量浓度的测定
采用双缩脲法[5]进行测定。
1.3.4MP溶解度的测定
参照Kingsley等[6]的方法并做调整。将MP溶于磷酸盐缓冲液(phosphate buffered saline,PBS,50 mmol/L Na2HPO4、0.6mol/L NaCl,pH 6.25),匀浆(2 000 r/min,4 ℃)配制成2.5 mg/mL的溶液;在4 ℃冰箱中放置1 h后,离心15 min(5 500 r/min,4 ℃),取上清液,用双缩脲法测定MP的质量浓度,对照组为不添加MP的PBS。
1.3.5MP活性巯基和总巯基含量的测定
1.3.5.1总巯基含量的测定
参照Yongsawatdigul等[7]的方法并作调整。将MP配制成4.0 mg/mL 的溶液(方法同1.3.2节),取上述溶液1 mL与9 mL的缓冲液C(10 mmol/L EDTA、0.6 mol/L KCl、8 mol/L尿素、50 mmol/L PBS,pH 7.0)混匀后取4 mL,加入0.4 mL 0.1%的5,5'-二硫双(2-硝基苯甲酸),在40 ℃条件下保温25 min,最后在412 nm波长处测定溶液的吸光度。
1.3.5.2活性巯基含量的测定
参照总巯基含量的测定方法,用缓冲液D(10 mmol/L EDTA、0.6 mol/L KCl、50mmol/L PBS,pH 7.0)替代缓冲液C,混合溶液在4 ℃条件下反应1 h后在412 nm波长处测定吸光度。
1.3.6MP乳化活性及乳化稳定性的测定
参照Agyare等[8]的方法,采用浊度法测定乳化性。将MP溶于0.1 mol/L PBS(KH2PO4/K2HPO4,pH 6.5)中,匀浆(2 000 r/min,4 ℃)配制成1 mg/mL的溶液。取上述溶液20 mL于离心管中,加入5 mL大豆油,10 000 r/min匀浆1 min后,立即从距管底0.5 cm处取50 μL乳浊液,加入到5 mL 0.1%十二烷基硫酸钠(sodium dodecyl sulfate,SDS)溶液中。振荡混匀后,用可见分光光度计在500 nm波长处测定吸光度,记作A0,以0.1% SDS溶液做空白组。10 min后,再次在相同位置取乳浊液50 μL,加入到5 mL 0.1% SDS溶液中,混匀后测定吸光度,记作A10,用0.1% SDS溶液做空白。MP乳浊液的乳化活性指数(emulsifying activity index,EAI)和乳化稳定性指数(emulsion stability index,ESI)的计算公式分别如下:

式中:φ为油相体积分数/%;ρ为蛋白质质量浓度/(g/mL);A0、A10为乳浊液0、10 min后在500 nm波长处的吸光度;稀释倍数为100。
1.3.7MP表面疏水性的测定
参照Chelh等[9]的方法进行测定。取一定量的MP,加入PBS(0.02 mol/L,pH 7.0),配制成5 mg/mL的溶液(方法同1.3.6节)。于离心管中取200 μL 1 mg/mL溴酚蓝和1 mL上述样液,室温下振荡10 min后离心(8 000 r/min,10 min),离心后将上清液稀释10 倍并在595 nm波长处测吸光度。以溴酚蓝含量表示MP表面疏水性。
1.3.8MP流变学性质的测定
参照Westphalen等[10]的方法进行测定。取一定量的MP,配制成15 mg/mL的溶液(方法同1.3.7节)。用流变仪测定其流变学特性,参数设置:夹具40 mm,频率1 Hz,应变0.002 5,狭缝0.5 mm,升温速率1 ℃/min,线性升温范围20~85 ℃,85 ℃维持3 min,随后以5 ℃/min的速率降温,冷却至5 ℃,降温范围85~5 ℃。
1.3.9MP热诱导凝胶的制备
参照Doerscher等[11]的方法进行制备。取一定量的MP,配制成40 mg/mL的溶液(方法同1.3.7节)。取上述样液6 mL于10 mL离心管中,置于20 ℃水浴锅中,控制温度使其以1 ℃/min的速率上升至70 ℃后保持20 min,之后迅速降温至4 ℃后放置24 h。
1.3.9.1MP热诱导凝胶硬度的测定
将在4 ℃条件下放置24 h的试样取出并置于室温下2 h,用质构仪测定其硬度。质构仪参数设置[12]:探头类型:P5;测前速率:1 mm/s;测后速率:1 mm/s;压缩比:50%;触发类型:Auto;数据攫取速率:200 Hz;停留时间:5 s。
1.3.9.2MP热诱导凝胶保水性的测定
参照Kocher等[13]的离心法进行测定。将在4 ℃条件下放置24 h的试样取出并置于室温下2 h,称质量,离心15 min(5 000 r/min,4 ℃),去除水,最后取出凝胶并称质量。保水性计算公式如下:

式中:m1为离心后凝胶的质量/g;m为离心前凝胶的质量/g。
1.4数据处理
所有实验均重复测定3 次,用Excel进行方差分析,OriginPro 8.5进行作图,最后利用SPSS Statistics 17.0进行显著性分析。
2 结果与分析
2.1解冻后兔肉待加工过程中MP溶解度的变化

图1 MP溶解度的变化Fig.1 Changes in solubility of myofibrillar protein
由图1可知,解冻后待加工过程中兔后腿肉和背最长肌肉MP溶解度随时间的延长均呈下降趋势(P<0.05),在最初解冻完成时,兔后腿肉和背最长肌肉的MP溶解度为90.01%和87.52%,在7 h时分别降至68.20%和64.32%。研究表明,肉类蛋白质的溶解度反映了蛋白质的变性程度,溶解度的降低是蛋白质变性的迹象[14]。兔肉解冻后MP溶解度逐渐降低,可能是由于在放置过程中蛋白质发生了氧化变性,导致原来在分子内部的疏水基团由于结构松散而暴露出来,分子的不对称性增加,因此黏度增加,扩散系数降低,从而导致溶解度下降。同时,MP的溶解性和其他功能性质如表面疏水性、乳化性、凝胶特性等有着密切的关系,溶解度的下降直接导致了兔肉待加工过程中品质的下降。另外,溶解度在3~4 h时下降最显著,表明解冻后待加工时间超过3 h,肉的品质已显著下降。
2.2解冻后兔肉待加工过程中MP活性巯基及总巯基含量的变化
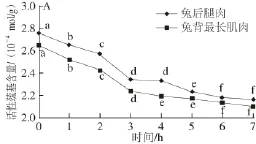

图2 MP活性巯基及总巯基含量的变化Fig.2 Changes in A-SH and T-SH contents of myofibrillar protein
由图2A可知,解冻后待加工过程中兔后腿肉和背最长肌肉MP活性巯基含量随时间的延长均呈下降趋势,0~3 h显著下降(P<0.05),分别从最初的2.750×10-4、2.650×10-4mol/g降到了2.345×10-4、2.241×10-4mol/g,3~7 h下降较缓慢。巯基是蛋白中最活泼、最具反应活性的功能性基团,对于MP空间结构的稳定有着非常重要的意义[7]。兔肉在待加工过程中MP活性巯基含量下降是由于在待加工过程中,肌动球蛋白头部结构发生变化,导致巯基的暴露,巯基被氧化形成二硫化合物,进而导致活性巯基含量降低[15]。另外,溶解度的降低也说明蛋白质结构发生了变化,有更多的巯基暴露,进而被氧化。
由图2B可知,解冻后待加工过程中兔后腿肉和兔背最长肌肉MP总巯基含量随时间的延长均呈下降趋势(P<0.05),7 h时分别下降了24.83%和23.42%。总巯基含量的降低在一定程度上反映了蛋白氧化变性的程度,并且对蛋白质的凝胶功能性质、乳化性有一定的影响。由巯基含量在2~3 h下降最为显著可知,兔肉解冻后待加工时间最好不要超过2 h。
2.3解冻后兔肉待加工过程中MP乳化活性及乳化稳定性的变化
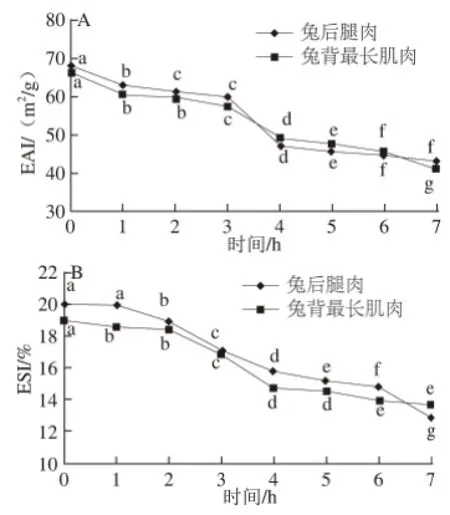
图3 MP乳化活性及乳化稳定性的变化Fig.3 Changes in emulsifying activity and emulsion stability of myofibrillar protein
由图3可知,解冻后待加工过程中兔后腿肉和兔背最长肌肉MP的EAI和ESI均呈下降趋势(P<0.05),3~4 h下降最为显著,EAI分别从59.87、57.45 m2/g降到了47.00、49.11 m2/g,ESI分别从17.11%和16.92%降到了15.80%和14.70%。乳化能力是衡量在一定条件下蛋白质溶液所能乳化脂肪的能力[16],EAI是表示蛋白质作为乳化剂乳化效力的一种方法[8],ESI是评价蛋白质保持乳化体系油水界面的能力的重要指标[17]。研究发现蛋白质的乳化能力与其溶解度有关,溶解度越高,溶液中能参与乳化的蛋白分子越多,那么乳化性能越好[18]。因此,本研究中兔肉MP乳化能力的下降与溶解度的降低有着较大的关系。此外,由于肌球蛋白的交联程度逐步增加,丧失了表面吸附脂肪颗粒的灵活性[19],这也会使MP乳化能力下降。MP乳化能力的变化也表明,兔肉解冻后放置3 h后肉的品质已显著下降,因此解冻后放置时间最好不要超过3 h。
2.4解冻后兔肉待加工过程中MP表面疏水性的变化

图4 MP表面疏水性的变化Fig.4 Changes in hydrophobicity of rabbit meat myofibrillar protein
由图4可知,解冻后待加工过程中兔后腿肉和兔背最长肌肉表面疏水性整体均呈上升趋势(P<0.05),放置7 h后,两部位肉的MP表面疏水性分别增加了120.1%和151.4%。蛋白质的表面疏水性反映的是蛋白质分子表面疏水性氨基酸的相对含量[20]。表面疏水性的下降是由于兔肉解冻后在待加工过程中蛋白质被氧化,结构发生了变化,形成了不同于天然结构的状态,导致更多的蛋白质分子内部疏水基团暴露,从而使表面疏水性增大[21-22]。此外,研究也表明,蛋白质表面疏水性与溶解度成负相关,兔肉MP溶解度下降直接导致了表面疏水性的增加。表面疏水性在3~4 h下降最显著(P<0.05)表明,兔肉解冻后放置4 h肉的品质已经显著变坏。
2.5解冻后兔肉待加工过程中MP流变学性质的变化
流变学主要研究施加物体上的应力及其产生的应变规律,表现为力、变形与时间之间的函数,MP凝胶的流变学性能够反映加热过程中MP分子形态和性质的变化[23]。由图5可知,解冻后待加工过程中,不同放置时间处理兔后腿肉和背最长肌肉MP弹性模量(G')值的变化趋势基本一致,均呈先缓慢上升后下降再显著上升的趋势,这种典型的流变学转变在MP热诱导凝胶过程中可以被广泛地观察到。

图5 MP弹性模量(G')的变化Fig.5 Changes in elastic modulus (G') of myofibrillar protein
G'值是衡量蛋白凝胶能力的一个重要指标,G'值高意味着凝胶能力强,解冻后静水放置时间对兔肉的流变学性质有着很大的影响,放置时间越长,兔肉的G'值越小,表明形成凝胶能力越弱。这与Westphalen等[10]在研究pH值对不同部位猪肉MP流变学性质影响时得到的变化趋势基本一致。另外,在3~4 h时G'值显著下降(P<0.05)表明,解冻后静水放置4 h后的兔肉MP形成凝胶的能力已显著下降,肉的品质已发生较大变化。
2.6解冻后兔肉待加工过程中MP凝胶特性的变化
蛋白质的凝胶性是在食品加工过程中广泛存在的一个热、动力学过程[24]。肉类MP热诱导凝胶能力最强,所以在肉制品加工过程中肉类MP热诱导凝胶特性显得尤为重要。由图6可知,解冻后待加工过程中兔后腿肉和兔背最长肌肉MP热诱导凝胶硬度和凝胶保水性均呈下降趋势(P<0.05),硬度从0 h的57.33、61.54 g分别下降到7 h的23.38、16.97 g,保水性从0 h的72.50%、74.61%分别降至7 h的63.51%、62.81%。解冻后待加工过程中兔肉MP凝胶硬度和保水性逐渐降低,可能是由于随着放置时间的延长蛋白质发生氧化而变性,原来构成凝胶三维网状结构的蛋白质多聚体不能形成,同时蛋白质与水分子的结合能力下降,从而使凝胶的硬度和保水性下降。该研究结果与何雪莹[25]在研究冰温贮藏过程中鲤鱼鱼肉MP凝胶特性变化规律时得到的变化趋势一致。另外,在3~4 h时MP凝胶的硬度和保水性下降显著(P<0.05)表明,解冻4 h后兔肉MP形成的凝胶功能特性已显著下降,肉的品质已发生明显变化。
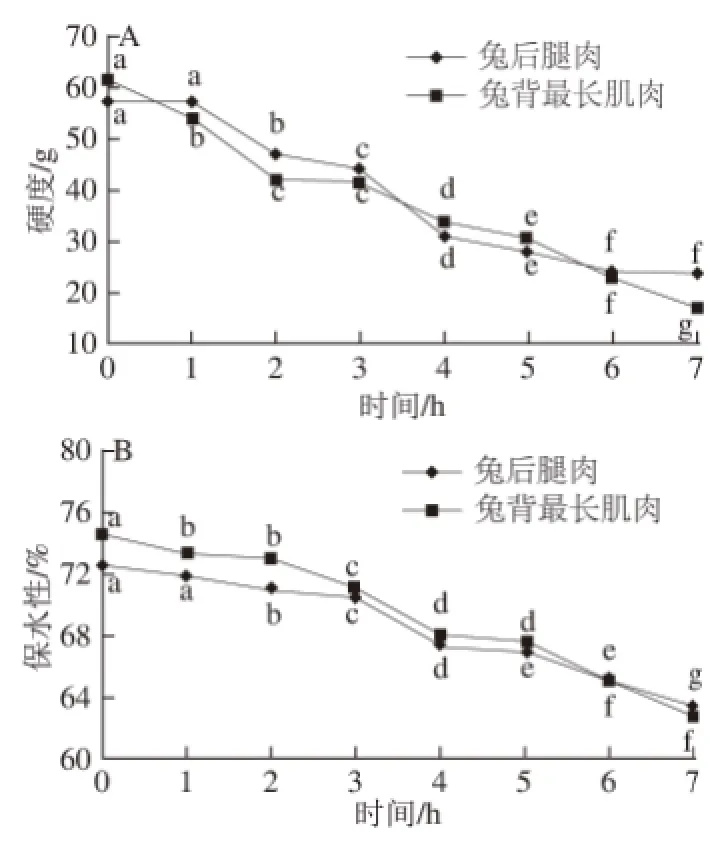
图6 MP热诱导凝胶硬度及保水性的变化Fig.6 Changes in heat-induced gel hardness and water-holding capacity of myofibrillar protein
3 结 论
解冻后随着待加工时间的延长兔肉MP溶解度、活性巯基及总巯基含量、EAI和ESI、凝胶特性显著下降,并且在4 h时下降最为显著;MP表面疏水性逐渐上升,同时在4 h时上升最为显著;MP弹性模量G'值先缓慢上升后下降再显著上升,表明放置时间越长,兔肉蛋白形成凝胶能力越弱。
综上所述,兔肉在解冻后待加工过程中MP功能性质会发生显著变化,这会直接影响兔肉的加工特性,且待加工时间越长,影响越大。所以,企业在兔肉工业化生产过程中,应立即将解冻后的大批量肉样投入加工,如若不能立即加工的应尽可能减少肉样待加工过程的时间,最好在3 h以内,或者继续冷藏,以保证原料肉具有较好的加工特性。
[1]陈娥英. 兔肉营养价值的评定[J]. 福建畜牧兽医, 2006, 27(5): 10-11.
[2]陈忠法. 兔肉的营养特点和国内外生产消费概况[J]. 上海畜牧兽医通讯, 2003, 1(2): 34-35.
[3]王炜, 李鹏霞, 伍玉洁. 我国兔肉产业发展趋势[J]. 肉类工业, 2007,1(1): 1-3.
[4]XIONG Youling L., LOU Xingqiu, WANG Changzheng, et al. Protein extraction from chicken myofibrils irrigated with various polyphosphate and nacl solutions[J]. Journal of Food Science, 2000,65(1): 96-100.
[5]陈忠法. 兔肉的营养特点和生产消费趋势[J]. 特种经济动植物,2002, 1(4): 6.
[6]KINGSLEY K A, XIONG Youling L., KWAKU A. Influence of salt and pH on the solubility and structural characteristics of transglutam inase-treated wheat glutenhydrolysate[J]. Food Chemistry, 2008,107(3): 1131-1137.
[7]YONGSAWATDIGUL J, PARK J W. Thermal denaturation and aggregation of threadfin bream actomyosin[J]. Food Chemistry, 2003,83(3): 409-416.
[8]AGYARE K K, ADDO K, XIONG Youling L.. Emulsifying and foaming properties of transglutaminase-treated wheat glutenhydrolysate as influenced by pH, temperature and salt[J]. Food Hydrocolloids, 2009, 23(1): 72-81.
[9]CHELH L, GATELLIER P, SANTE-LHOUTELLIER V. Technical note: a simplified procedure for myofibril hydrophobicity determination[J]. Meat Science, 2006, 74(4): 681-683.
[10] WESTPHALEN A D, BRIGGS J L, LONERGAN S M. Influence of muscle type on rheological properties of porcine myo.brillar protein during heat-induced gelation[J]. Meat Science, 2006, 72(4): 697-703.
[11] DOERSCHE R D, BRIGGS J L, LONERGAN S M. Effects of pork collagen on thermal and viscoelastic properties of puri.ed porcine myo.brillar protein gels[J]. Meat Science, 2003, 66(1): 181-188.
[12] 陈文博. 肌原纤维蛋白热诱导凝胶形成机制研究[D]. 南京: 南京农业大学, 2010: 49-50.
[13] KOCHER P N, FOEGEDING E A. Microcentrifuge-based method for measuring water-holding of protein gels[J]. Journal of Food Science,1993, 58(5): 1040-1046.
[14] MILLER A J, ACKERMAN S A, PALUMBO S A. Effects of frozen storage on functionality of meat for processing[J]. Journal of Food Science, 1980, 45(6): 1466-1471.
[15] LEBLANC E L, LEBLANC R J. Determination of hydrophobicity and reactive groups in proteins of cod (Gadus morhua) muscle during frozen storage[J]. Food Chemistry, 1992, 43(1): 3-11.
[16] 蔡立志, 宋玉兰, 黄丽卿. 大豆蛋白的乳化功能及表征研究[J]. 食品科学, 1999, 20(10): 20-24.
[17] SILVA V D M, SILVESTRE M P C. Functional properties of bovine blood plasma intended for use as a functional ingredient inhuman food[J]. LWT-Food Science and Technology, 2003, 36(7): 709-718.
[18] ZORBA O, KYRT S, GENCCELEP H. The effects of different levels of skim milk powder and whey powder on apparent yield stress and density of different meat emulsions[J]. Food Hydrocolloids, 2005,19(1): 149-155.
[19] XIONG Youling L., AGYARE K K, ADDO K. Hydrolyzed wheat gluten suppresses transglutaminase-mediated gelation but improves emulsification of pork myofibrillar protein[J]. Meat Science, 2008,80(2): 535-544.
[20] NOH E J, KANG C, HONG S T, et al. Freezing of soybeans influences the hydrophobicity of soy protein[J]. Food Chemistry, 2006, 97(2):212-216.
[21] 李明清. 鲤鱼肌原纤维蛋白功能特性的研究[D]. 哈尔滨: 东北农业大学, 2010: 40-41.
[22] RIEBROY S, BENJAKULl S, VISESSANGUAN W, et al. Acid-induced gelation of natural actomyosin from Atlantic cod (Gadus morhua) and burbot (Lota lota) [J]. Food Hydrocolloids, 2009, 23(1): 26-39.
[23] HATTORI A, TAKAHASHI K. Calcium-induced weakening of skeletal muscle Z-disks[J]. Journal of Biochemistry, 1982, 92(2): 381-390.
[24] VANDER B W, FENNEMA M. Protest or mainstream how the European anti-immigrant parties developed into two separate groups by 1999[J]. European Journal of Political Research, 2003, 42(1): 55-76.
[25] 何雪莹. 冰温保鲜对鲤鱼鱼肉品质特性及其理化特性影响的研究[D].哈尔滨: 东北农业大学, 2012: 31-33.
Changes in Functional Properties of Myofibrillar Protein in Frozen Rabbit Meat during Pending Process after Thawing
LIN Jing1, ZHANG Binbin1, WANG Xiaojun1, SHANG Yongbiao1,2,3,*
(1. College of Food Science, Southwest University, Chongqing400716, China; 2. Laboratory of Quality and Safety Risk Assessment for Agro-Products on Storage and Preservation (Chongqing), Ministry of Agriculture, Chongqing400716, China;3. Chongqing Engineering Research Center of Regional Food, Chongqing400716, China)
The purpose of this study was to explore the changes in functional properties of myofibrillar protein in frozen rabbit meat during pending process after thawing. Rabbit rear legs and longissimus dorsi muscles were frozen for 7 days at -18 ℃. Thereafter, the meat samples were taken out, thawed in 20 ℃ water until the internal temperature reached 0 ℃, and then kept in the water for another 7 h. The solubility, A-SH and T-SH contents, emulsification properties, surface hydrophobicity, rheological properties and gel properties of rabbit meat myofibrillar protein were found to gradually decrease with the extension of storage time in water, especially significantly at 4 h (P < 0.05). On the contrary, surface hydrophobicity steadily rose especially significantly at 4 h (P < 0.05). Elastic modulus (G') value of myofibrillar protein also gradually declined during the heating process, and gel-forming capability of rabbit meat myofibrillar protein decreased.
rabbit meat; pending process; myofibrillar protein; functional properties
TS251
A
1002-6630(2015)23-0105-06 doi:10.7506/spkx1002-6630-201523020
2015-06-02
公益性行业(农业)科研专项(201303144);重庆市特色食品工程技术研究中心能力提升项目(cstc2014pt-gc8001)
林静(1991—),女,硕士研究生,研究方向为农产品加工及贮藏。E-mail:1499085114@qq.com
尚永彪(1964—),男,教授,博士,研究方向为农产品加工。E-mail:shangyb64@sina.com
