蛋白酶基因的克隆与表达研究进展
2015-10-29王继莲李明源
王继莲,李明源,陈 芸
(1.喀什大学 叶尔羌绿洲生态与生物资源研究重点实验室,新疆 喀什 844006;2.新疆生产建设兵团,塔里木盆地生物资源保护利用重点实验室,新疆 阿拉尔 843300)
蛋白酶基因的克隆与表达研究进展
王继莲1,2,李明源1,2,陈芸1
(1.喀什大学 叶尔羌绿洲生态与生物资源研究重点实验室,新疆 喀什844006;2.新疆生产建设兵团,塔里木盆地生物资源保护利用重点实验室,新疆 阿拉尔843300)
蛋白酶在各领域的应用愈加广泛,但其大规模工业生产受到诸多因素制约。利用基因工程技术对蛋白酶基因进行改良和克隆表达,开发高产量、高纯度、高活力的蛋白酶资源成为研究的热点。本文对蛋白酶的分类、结构与功能、菌种选育等进行了概述,同时分析了蛋白酶基因在原核和真核生物中的克隆与表达研究进展,并对未来蛋白酶基因工程的发展趋势进行了展望。
蛋白酶;基因工程技术;克隆表达
蛋白酶是催化水解蛋白质中肽键的一类酶,是酶学研究开展的较早,也是最为成熟的一种[1-2]。目前,蛋白酶的应用已遍及食品、医药化工、洗涤、饲料等领域,生产总值达到酶制剂市场的65%[3]。与动、植物源蛋白酶相比,微生物蛋白酶来源广、菌体营养要求低、易于培养,更易实现规模化生产。早期对微生物源蛋白酶的研究较多集中于天然高产菌种的选育、发酵条件优化和下游处理技术等,总体研究水平不高,没有真正考虑到大规模生产技术的各方面因素。直至20世纪70年代重组DNA技术建立后,对蛋白酶分子生物学领域的研究才随之展开,实现了蛋白酶基因的序列分析、克隆与表达,使规模化生产成为可能。本文主要对蛋白酶的分类、结构与产酶菌株的选育进行概述,同时对蛋白酶基因工程的研究进展进行了综述,对其发展前景进行了展望。
1 蛋白酶简介
1.1蛋白酶分类体系与应用
蛋白酶是由多种水解酶组成的复杂酶系,根据其活性部位起催化作用的基团属性,可分为4 类:1)丝氨酸蛋白酶,以丝氨酸为活性中心,其活性部位都含Ser、His、Asp,如胰蛋白酶,广泛应用于心血管疾病医治、真菌基础性研究等领域[4-5];2)巯基蛋白酶,其活性中心含巯基(—SH),如菠萝蛋白酶、木瓜蛋白酶,多用于生物化工(干酪、明胶及生物蛋白的生产)、食品及医药工业[6];3)天冬氨酸蛋白酶(又称酸性蛋白酶),酶学史上最早被记载的蛋白酶,其活性中心由两个天冬氨酸残基所组成,如胃蛋白酶,主要用于食品添加剂、心血管疾病等方面;4)金属蛋白酶类,其活性区域多含Zn2+、Ca2+、Mg2+等二价金属离子,如枯草杆菌中性蛋白酶,其酶活性易受苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)及金属螯合剂乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)抑制,广泛用于食品、日用化工及抗肿瘤等药物和疾病的机理研究方面[7]。
1.2蛋白酶的结构
虽然蛋白酶在长期的进化过程中,其分子结构、大小、功能等差别很大,但各家族蛋白酶仍然保持了一个高度保守的结构域,拥有较高的序列相似性。丝氨酸蛋白酶在结构上为全β蛋白,其核心结构由C端和N端结构域组成,其中C结构域执行催化功能,而N结构域主要负责与C结构域相配合,共同维持催化中心三联体的构象稳定性和催化活性[8](图1)。巯基蛋白酶家族以木瓜蛋白酶研究的最为详尽,其酶前体中已形成大小相当的2 个结构域,这2 个结构域构成的裂隙底部是催化位点[9](图2)。天冬氨酸蛋白酶多拥有以C2为对称轴的两个双叶型三级结构[10](图3)。金属蛋白酶成员均含有一个稳定的基本结构域:N端疏水信号肽、前肽区、催化活性区。尤其在催化活性区含1 个或2 个金属离子,以Zn2+最多,这是金属蛋白酶与上述三类蛋白酶最大的不同(图4),多数动物的基质金属蛋白酶中还含有C端的血红素结合蛋白样结构域[11]。前肽区与催化活性区中的锌原子相互协调,共同维持酶分子的功能稳定性,而血红素结合蛋白样结构域主要起调节酶活性和底物专一性的作用[12]。

图1 蛋白酶K三维结构Fig.1 Three-dimensional structure of protease K
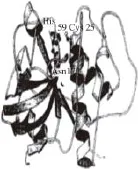
图2 木瓜凝乳蛋白酶三维结构Fig.2 Three-dimensional structure of chymopapain

图3 胃蛋白酶原三维结构Fig.3 Three-dimensional structure of pepsinogen
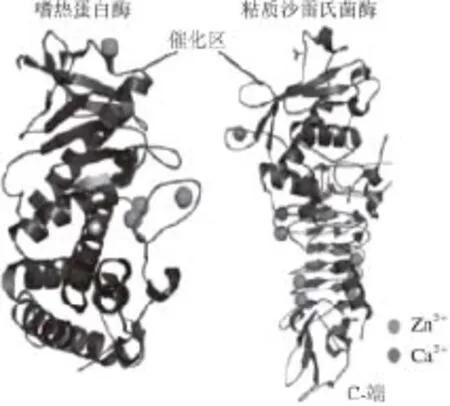
图4 金属蛋白酶三维结构Fig.4 Three-dimensional structure of metalloprotease
1.3高产蛋白酶优良菌株的选育
目前,蛋白酶的生产由于酶活性低、生产成本较高等因素限制,尚不能实现规模化生产。因此,直接从天然环境中选育有高产酶能力的野生菌种,或借助诱变育种、原生质体融合等方法对出发菌株进行改造、筛选,进一步提高酶活,成为研究的一大热点。
研究者们对天然高产酶菌株的筛选已从单纯的常温菌扩展到筛选某些特殊性质的菌株,如高、低温蛋白酶、碱性蛋白酶等。Bach等[13]从巴西土壤中筛选到一株高产蛋白酶的耐热、耐碱细菌菌株,经鉴定为嗜水气单胞菌(Aeromonas hydrophila)。Kim等[14]自北极陆地分离到一株产低温蛋白酶的嗜冷菌,经鉴定为节杆菌属(Arthrobacter sp.)中的一个种。
诱变育种主要通过辐射诱变或一些化学试剂诱发菌体的遗传物质突变,获得性状优良的突变株。例如,蔡婉玲等[15]在富含蛋白质的场所采样,对筛选到的产酶菌株进行紫外诱变后,其酶活力由1 594 U/mL增加到1 845 U/mL,比原始菌株升高16%。
原生质体融合技术是指通过人为的方法,将双亲株的细胞去壁进行原生质体融合,使其基因组间交换重组获得稳定重组子的过程。例如,武金霞等[16]将产蛋白酶的米曲霉菌株HL和L5进行细胞融合,得到的融合株蛋白酶活力分别比两亲株提高25.6%和19.9%。
2 蛋白酶基因的筛选
随着分子生物学手段的进步,利用基因操作技术构建蛋白质高效分解基因工程菌,从根本上提高酶的产量和质量成为功能酶选育的重点工程。早期的基因工程方法多是利用“鸟枪法”,即以供体菌株的总DNA为研究对象,进行随机酶切,构建一个基因文库,连接到表达载体上,导入适合的受体细胞筛选阳性克隆,得到蛋白酶基因。随着基因合成技术的成熟,目前常用的基因筛选策略主要包括以下几种:人工合成法,即根据已克隆到的蛋白酶序列人工合成目的基因;特异性引物扩增法,即根据已克隆到的蛋白酶序列设计简并引物,在相似物种上扩增目的基因。李丹等[17]通过简并引物和染色体步移技术克隆芽孢杆菌(Bacillus sp.)L010的中温碱性蛋白酶基因,并导入大肠杆菌(Escherichia coli)BL21(DE3)中进行了重组表达,发酵液表现出较高的酶活力。
此外,随着宏基因组(metagenome)概念的提出,蛋白酶基因也可以通过特异性引物从某一区域的总基因组DNA中克隆获得,有效弥补了传统微生物纯培养技术的弊端,为开发未培养微生物的蛋白酶基因资源提供新思路[18]。例如对杀线虫蛋白酶基因的筛选,便可通过直接从环境中取样构建宏基因组Fosmid文库,设计特异性引物克隆蛋白酶基因[19]。
3 蛋白酶基因的克隆表达
自1985年Jacobs等[20]首次成功克隆出芽孢杆菌Bacillus licheniformis的碱性蛋白酶基因以来,利用基因工程技术对蛋白酶基因进行克隆与表达,构建高产蛋白酶工程菌成为研究热点,为菌种选育提供了新途径。目前已有数千种蛋白酶基因被克隆表达,相应的DNA及氨基酸序列被共享在美国DNA数据库GenBank、日本DNA序列数据库(DNA Data Bank of Japan,DDBJ)等数据平台上。
3.1蛋白酶基因在原核生物中的克隆与表达
3.1.1蛋白酶基因在大肠杆菌中的克隆与表达
作为第一个用于重组蛋白生产的宿主菌,大肠杆菌以其分子遗传学背景清楚、繁殖速率快、操作简单等优点被发展成为基因工程研究中应用最广泛和最深入的模式菌株,几乎所有已克隆的蛋白酶基因都在大肠杆菌中得到表达[21-22]。尤其进入后基因组时代后,有关蛋白组学、基因功能、蛋白质网络等新课题的开展,大肠杆菌更成为基因表达的最首要工具。目前通用的质粒表达载体主要有pET系列、pUC系列、pGEM系列等,常用受体菌有BL21、JM109、DH5α、JM103等[23]。如李丽华等[24]从海洋球石藻(Emiliania huxley)病毒中通过聚合酶链式反应(polymerase chain reaction,PCR)扩增丝氨酸蛋白酶SP基因,将其克隆到表达载体pET32a上,导入大肠杆菌BL21中进行低温诱导表达,Western blotting检测到重组表达蛋白分子质量约60 kD,能在脱脂牛奶平板上形成水解圈,证实其具有生物活性。李洁琼等[25]从单胞菌Collimonas sp. ZL261克隆得到蛋白酶基因capro,并构建于表达载体pUC118上,转化至大肠杆菌DH5α菌株,检测到目的蛋白具有蛋白酶活性,最适反应温度30 ℃,最佳作用pH值为7。
尽管大肠杆菌是基因表达的首选,但也存在一些缺憾。在大肠杆菌中表达的异源蛋白易形成包涵体,不利于纯化,且不能进行翻译后蛋白质的加工修饰[26-27],最重要的是经过变性复性过程重组蛋白往往失去活性,对此研究者采取了诸多措施。对于胞质内蛋白,可将分子伴侣和目的基因共表达,介导重组蛋白的折叠装配;或用中等强度的启动子替代强启动子,减缓易聚集的折叠中间产物的合成速率,进而减少包涵体的形成。还可构建分泌系统使异源蛋白分泌性表达,如大肠杆菌素释放蛋白系统可增加大肠杆菌的通透性,促进周质蛋白的分泌;构建缺乏细胞壁的L型细菌蛋白表达系统,直接将外源蛋白分泌到胞外。
3.1.2蛋白酶基因在其他受体菌中的克隆表达
为优化重组蛋白的表达质量,人们不断尝试构建新的表达系统,目前已有一些蛋白酶基因在枯草芽孢杆菌、短小芽孢杆菌和变铅青链霉菌中得到有效表达。杨春晖等[28]通过交错式热不对称PCR(thermal asymmetric interlaced PCR,TAIL-PCR)技术克隆了一株短小芽孢杆菌的蛋白酶基因启动子序列,分析其与该基因表达有关的序列全长390 bp,构建的重组大肠杆菌-芽孢杆菌表达质粒pSUBpWApQ3在枯草芽孢杆菌和短小芽孢杆菌中均得到表达,最高酶活力分别达到466.5 U/mL和3 060 U/mL。马腾博等[29]从灰色链霉菌中克隆胰蛋白酶编码基因sprT,以pIJ86为载体,成功实现了其在重组变铅青链霉菌工程菌TK24/pIJ86-sprT的高活性表达,该重组酶同牛胰蛋白酶(bovine trypsin,BT)相比,耐酸性更强,对酰胺键的特异性更高。
枯草芽孢杆菌是一种食品级安全菌株,安全系数更高,可将重组蛋白以可溶形式分泌到胞外,发酵工艺技术也较为成熟。不足之处在于自身会分泌一些具有较强水解活性的蛋白酶,质粒本身的不稳定造成克隆效率低[30]。应对策略有构建诱导型表达分泌载体,目前研究比较清楚的有葡萄糖和蔗糖诱导表达系统,不仅可以诱导外源基因表达,而且可以促进外源蛋白的分泌。还可使用枯草芽孢杆菌整合载体,相对提高质粒的稳定性等。链霉菌作为受体菌,致病性较小,但操作复杂,转化频率不高,与之对应的用于基因表达的启动子和载体也较少。因此,链霉菌作为一种有效的表达工具仍需不断丰富和完善。
3.2蛋白酶基因在真核生物中的克隆与表达
真核表达系统是近年来用于表达重组蛋白的一种新兴表达体系。与原核表达系统相比,真核表达系统可以实现对外源蛋白的正确折叠、组装等,是生产具有生物活性蛋白的又一理想选择。目前常用的真核生物表达系统主要有酵母、昆虫及哺乳类动物细胞等。
3.2.1蛋白酶基因在酵母中的克隆与表达
作为一种单细胞真菌,酵母营养要求低,在酿酒和食品行业的应用历史悠久,是被应用最早的微生物,安全性相比原核生物表达系统更可靠。此外,酵母表达系统的表达重组蛋白的水平也较高,又能对其进行正确地折叠、组装,已发展成为应用最普遍的真核表达系统[31]。如柯野等[32]采用PCR技术扩增米曲霉中的碱性蛋白酶基因,将其克隆到表达载体pPIC9K,电击转化到毕赤酵母KM71,在10 L发酵罐中经甲醇诱导后酶活力为4 100 U/mL,其最适温度和pH值分别为50 ℃和8.5~9.5。Porres等[33]将枯草杆菌Bacillus licheniformis PWD-1的kerA基因克隆到表达载体pPICZαA和pGAPZαA上,转化至毕赤酵母X-33实现外源表达,最高酶活力为285 U/mL。
通过对外源基因、分泌信号及培养条件的控制等,已有很多异源蛋白成功在酵母表达系统中表达。缺陷在于缺乏高效的启动子,对外源蛋白的表达过度糖基化,增殖过程中代谢产物的富集会限制菌群自身的高密度培养。此外,细胞所分泌的蛋白酶对自身蛋白的降解,也在很大程度上限制了外源基因的表达[34]。应对策略包括选择有高分泌效率的信号肽,如酸性磷酸脂酶、α因子信号肽的宿主菌,促进外源蛋白的分泌;使用重复序列作为整合质粒的重组位点,增加目的基因的拷贝数,进而提高外源基因的表达水平;改变培养基的发酵条件(pH值、温度等)或使用蛋白酶抑制剂降低蛋白酶活性,增加重组产物的积累。
3.2.2蛋白酶基因在霉菌及动物细胞中的克隆与表达
霉菌以其较强的外泌蛋白能力及其翻译后加工,较酵母更类似于真核细胞生物等特点成为表达外源蛋白的又一理想选择[35]。如潘力等[36]以米曲霉淀粉酶的强启动子(amyB)和糖苷酶的强终止子(agdA)为基本元件,将泡盛曲霉Aspergillus awamori的酸性蛋白酶基因pepA克隆至农杆菌双元载体phGW中,导入泡盛曲霉宿主菌中实现转化与表达,传代培养验证了转化子的抗药稳定性,培养液酶活力较野生型提高15%。于寒颖等[37]通过构建表达载体pGT21M-HIS,使捕食线虫真菌Dactylellina cionopapa中与侵染机制相关的蛋白酶基因PrD I成功在黑曲霉201中转录,表达的外源蛋白分子质量约45 kD,在酸性条件下有活性。
此外,动物细胞具有易被转染、分泌物易被纯化,且遗传性能稳定等特点,成为表达外源蛋白的另一重要途径,其表达的蛋白产物已有部分应用于生物制品行业。例如,曾铮等[38]采用PCR扩增获得铜绿假单胞菌SP-6的弹性蛋白酶基因,构建转移载体pBacPAK8-His-Ela,和亲本病毒BacPAK6共转染昆虫细胞株Sf21,细胞在感毒120 h后产酶量达到最高峰,为20.9 U/mL。杨晓娇等[39]利用PCR技术扩增微小隐孢子虫类的钙调蛋白蛋白基因CML,插入到载体pMD18-T中构建重组质粒,连接到真核表达载体pVAX1上转染Hela细胞,Western blotting和间接免疫荧光法检测表明表达质粒在Hela细胞中成功表达,表达产物分子质量约为25 ku,具有反应原性。
4 结 语
虽然近年来蛋白酶基因的克隆与表达研究已取得重要进展,但由于多数异源表达的重组蛋白分泌较弱、酶活性较低及安全性有待进一步验证等问题使其工业化进程缓慢。国内已经投入工业生产的菌株(地衣芽孢杆菌2709和C1213及短小芽孢杆菌289、209等)酶活力在18 000 U/mL左右,与国外的25 000~30 000 U/mL相比仍存在不少差距。因此,继续对原始产酶菌株进行定向或非定向性改造,提高菌种的产酶活力,改变产酶性质,使其符合工业生产的要求仍是未来酶工程的发展趋势。在今后的研究工作中,产蛋白酶优良菌株的选育仍显得十分必要;另一方面,除了在常见的宿主中表达蛋白酶外,需努力尝试构建新的表达系统或多个蛋白酶基因共表达系统,为蛋白酶构建更多的表达载体,进而实现其不同组分的有效表达并进一步提高表达量、酶活性和酶稳定性。相信随着现代生物基因工程的不断发展,将会有更多的蛋白酶基因被克隆表达,蛋白酶在工农业生产上的应用前景也会越来越广阔。
[1]李飞雄, 李江红, 梁勤, 等. 蜜蜂球囊菌几种胞外蛋白酶的特性[J].中国农业科学, 2011, 44(6): 1247-1254.
[2]朱薇玲, 石豪, 李金华, 等. 芽孢杆菌B15胞外蛋白酶和淀粉酶的酶学性质研究[J]. 中国酿造, 2012, 31(9): 118-121.
[3]ALAGARSAMY S, LARROCHE C, PANDEY A. Microbiology and industrial biotechnology of food-grade proteases: a perspective[J]. Food Technology and Biotechnology, 2006, 44(2): 211-220.
[4]吴志俊, 金玮, 张凤如, 等. 利钠肽家族基因与心血管疾病研究新进展[J]. 遗传, 2012, 34(2): 127-133.
[5]金凯, 牛东红, 王劦, 等. 缢蛏丝氨酸蛋白酶基因的序列特征及其表达分析[J]. 上海海洋大学学报, 2013, 22(4): 481-487.
[6]BRAKEBUSCH M, WINTERGERST U, PETROPOULOU T, et al. Bromelain is an accelerator of phagocytosis, respiratory burst and killing of Candida albicans by human granulocytes and monocytes[J]. European Journal of Medical Research, 2001, 6(5): 193-200.
[7]FRANTZ C, STEWART K M, WEAVER V M. The extracellular matrix at a glance[J]. Journal of Cell Science, 2010, 123(24):4195-4200.
[8]吴彤, 王瑞明, 黄磊, 等. 蛋白酶K的研究进展[J]. 食品工业科技,2013, 34(14): 380-384.
[9]WIEDERANDERS B. Structure-function relationship in class CA1 cysteine peptidase propeptides[J]. Acta Biochemical Polonica, 2003,50(3): 691-713.
[10]DAVIES D R. The structure and function of the aspartic proteinases[J]. Annual Review of Biophysics and Biophysical Chemistry, 1990, 19(1):189-215.
[11] NAGASE H, VISSE R, MURPHY G. Structure and function of matrix metalloproteinases and TIMPs[J]. Cardiovascular Research, 2006,69(3): 562-573.
[12] PICCARD H, van den STEEN P E, OPDENAKKER G. Hemopexin domains as multifunctional liganding modules in matrix metalloproteinases and other proteins[J]. Journal of Leukocyte Biology, 2007, 81(4): 870-892.
[13] BACH E, DAROIT D J, CORRÊA A P F, et al. Production and properties of keratinolytic proteases from three novel Gramnegative feather-degrading bacteria isolated from Brazilian soils[J]. Biodegradation, 2011, 22(6): 1191-1201.
[14] KIM E H, CHO K H, LEE Y M, et al. Diversity of cold-active protease-producing bacteria from arctic terrestrial and marine environments revealed by enrichment culture[J]. The Journal of Microbiology, 2010, 48(4): 426-432.
[15] 蔡婉玲, 田宝玉, 郭菁, 等. 蛋白酶产生菌的筛选和紫外诱变育种[J].生物技术, 2011, 21(1): 73-76.
[16] 武金霞, 赵睿, 张贺迎. 米曲霉种内原生质体融合选育优良菌株[J].中国酿造, 2012, 31(2): 132-136.
[17] 李丹, 黄非, 夏梦芸, 等. 一新中温碱性蛋白酶基因的克隆及原核表达[J]. 微生物学报, 2013, 53(11): 1240-1250.
[18] MATH R K, ASRAFUL ISLAM S M, CHO K M, et al. Isolation of a novel gene encoding a 3,5,6-trich-loro-2-pyridinol degrading enzyme from a cow rumen metagenomic library[J]. Biodegradation, 2010,21(4): 565-573.
[19] 赵志祥, 芦小飞, 陈国华, 等. 温室黄瓜根结线虫发生地土壤微生物宏基因组文库的构建及其一个杀线虫蛋白酶基因的筛选[J]. 微生物学报, 2010, 50(8): 1072-1079.
[20] JACOBS M, ELIASSON M, UHLEN M. Cloning-sequence and expression of subtilisin from Bacillus licheniformis[J]. Nucleic Acids Research, 1985, 13(24): 8913-8923.
[21] SUZUKI S M, STEVENS R C. Engineering human PON1 in an E. coli expression system[J]. Advances in Experimental Medicine and Biology, 2010, 660: 37-45.
[22] DONG Xiangbai, TANG Bo, LI Jie, et al. Expression and purifi cation of intact and functional soybean (Glycine max) seed ferritin complex in Escherichia coli[J]. Journal of Microbiology and Biotechnology,2008, 18(2): 299-307.
[23] 蒋钰瑶, 何嘉荣, 王未未, 等. 新型大肠杆菌高效表达载体pHsh的构建与应用[J]. 微生物学通报, 2012, 39(4): 394-400.
[24] 李丽华, 邱健健, 蔡艺钦, 等. 一种新的海洋微藻病毒丝氨酸蛋白酶基因的克隆表达及其活性分析[J]. 海洋学报, 2014, 36(8): 101-110.
[25]李洁琼, 张殿朋, 卢彩鸽, 等. Collimonas sp.ZL261蛋白酶基因的克隆、表达及其酶学特性[J]. 核农学报, 2014, 28(8): 1370-1378.
[26] 王中山, 向泉桔, 王海燕, 等. 大肠杆菌细胞周质底物结合蛋白gsiB基因的克隆及其表达条件的优化[J]. 遗传, 2010, 32(5): 505-511.
[27] LE Yilin, PENG Jingjing, WU Huawei, et al. An approach to the production of soluble protein from a fungal gene encoding an aggregation-prone xylanase in Escherichia coli[J]. PLoS ONE, 2011,6(4): e18489. doi: 10.1371/journal.pone.0018489.
[28] 杨春晖, 王海燕. 短小芽孢杆菌碱性蛋白酶基因启动子的克隆, 鉴定及其应用[J]. 遗传, 2007, 29(7): 874-880.
[29] 马腾博, 令桢民, 康振, 等. 灰色链霉菌胰蛋白酶在变铅青链霉菌中的异源表达及酶学性质分析[J]. 生物工程学报, 2013, 29(4): 466-479.
[30] CHEN Dongli, TONG Xing, CHEN Shangwei, et al. Heterologous expression, biochemical characterization, and overproduction of alkaline α-amylase from Bacillus alcalophilus in Bacillus subtilis[J]. Microbial Cell Factories, 2011, 10: 77-86.
[31] LI Anna, LI Duochuan. Cloning, expression and characterization of the serine protease gene from Chaetomium thermophilum[J]. Journal of Applied Microbiology, 2009, 106(2): 369-380.
[32] 柯野, 陈丹, 李家洲, 等. 米曲霉碱性蛋白酶基因的克隆表达及水解特性[J]. 华南理工大学学报: 自然科学版, 2012, 40(8): 88-94.
[33] PORRES J M, BENITO M J, LEI X G. Functional expression of keratinase (kerA) gene from Bacillus licheniformis in Pichia pastoris[J]. Biotechnology Letters, 2002, 24(8): 631-636.
[34] 马银鹏, 王玉文, 党阿丽, 等. 毕赤酵母表达系统研究进展[J]. 黑龙江科学, 2013, 4(9): 27-31.
[35] HELENA NEVALAINEN K M, TE'O V S J, BERGQUIST P L. Heterologous protein expression in filamentous fungi[J]. Trends in Biotechnology, 2005, 23(9): 468-474.
[36] 潘力, 李俊星, 苗小. 根癌农杆菌介导酸性蛋白酶在泡盛曲霉中表达的研究[J]. 食品工业科技, 2011, 32(5): 178-182.
[37] 于寒颖, 薛伟, 段俊欣. 黑曲霉外源表达系统对Dactylellina cionopapa基因PrDI的表达[J]. 生物技术, 2012, 22(3): 38-43.
[38] 曾铮, 吴大洋, 李春峰. 铜绿假单胞菌弹性蛋白酶基因的克隆及在昆虫细胞中的表达[J]. 蚕业科学, 2006, 32(3): 345-349.
[39] 杨晓娇, 周鹏, 米荣升, 等. 微小隐孢子虫类钙调蛋白基因真核表达质粒的构建及在Hela细胞中的表达[J]. 中国兽医科学, 2014, 44(15):485-491.
Progress in Cloning and Expression of Protease Genes
WANG Jilian1,2, LI Mingyuan1,2, CHEN Yun1
(1. Key Laboratory of Ecology and Biological Resources in Yarkand Oasis of Education of Xinjiang Uygur Autonomous Region,Kashgar University, Kashgar844006, China; 2. Xinjiang Production & Construction Crops, Key Laboratory of Protection and Utilization of Biological Resources in Tarim Basin, Alaer843300,China)
Although proteases are widely applied in various fi elds, large-scale industrial application of proteases has been restricted by many factors. Genetic engineering technology has been used for the cloning and expression of protease genes to obtain the protease resources with high quality, high purity and high activity. The classifi cation, structures and functions of proteases, and strain screening for protease production are reviewed in this article. Meanwhile, the cloning, and prokaryotic and eukaryotic expression of protease genes are discussed. Moreover, the future development in protease gene engineering technology is also prospected.
protease; genetic engineering technology; cloning and expression
Q786
A
1002-6630(2015)23-0377-05
10.7506/spkx1002-6630-201523067
2015-01-08
新疆生产建设兵团塔里木盆地资源保护利用重点实验室开放课题(BRYB1302);喀什大学校内青年专项课题((14)2526)
王继莲(1986—),女,讲师,硕士,主要从事基础酶工程研究。E-mail:wjilian0710@sina.com
