Habib VesOpen消融导管治疗小型猪模拟门静脉癌栓的安全性研究
2015-10-28张林付金鑫宋鹏袁凯阎洁羽段峰王茂强刘凤永
张林,付金鑫,宋鹏,袁凯,阎洁羽,段峰,王茂强,刘凤永
Habib VesOpen消融导管治疗小型猪模拟门静脉癌栓的安全性研究
张林,付金鑫,宋鹏,袁凯,阎洁羽,段峰,王茂强,刘凤永
目的探索射频消融(RFA)导管治疗门静脉癌栓(PVTT)的安全性。方法将10头实验小型猪分为3组:A组(n=6)直接行正常门静脉RFA治疗;B组(n=2)先行门静脉球囊封堵,然后行门静脉新鲜血栓RFA治疗;C组(n=2)先建立PVTT模型,待门静脉血栓机化后行门静脉RFA治疗。术后1、3、4周作MRI检查,4周后处死动物作病理学检查。结果A组动物在功率5 W条件下接受RFA治疗0.6~3.6 min,MRI检查及1个月后病理学检查均未发现明确异常。B组动物RFA后MRI检查提示门静脉区损伤较A组明显,术后1、3、4周内膜MRI检查提示门静脉水肿逐渐减轻;术后1个月病理学检查证实邻近肝组织损伤严重。C组在功率7 W条件下接受RFA治疗1.5 min,术后MRI检查未见消融区明显水肿,病理学检查可见机化的血栓坏死、血管内皮细胞受损。结论采用Habib VesOpen双极RFA导管治疗PVTT,应根据PVTT严重程度选择合适的RFA功率与时间。PVTT较轻时采用大功率、短时间RFA可能较安全,PVTT较重时改用小功率、长时间RFA更为安全可靠。
门静脉癌栓;血栓;射频消融;小型猪;数字减影血管造影
原发性肝细胞癌(HCC)发病隐匿,患者就诊时多已属晚期,且常伴发血管侵犯。门静脉癌栓(PVTT)是HCC常见并发症之一。PVTT使门静脉压力升高,腹胀、腹水加重,易发生消化道出血,是HCC患者短期死亡的主要原因之一。如果对伴发PVTT的HCC患者不进行治疗,预后很差。虽然近年国内外对HCC伴发PVTT的治疗取得了一些进展,但单一疗法仍无法取得满意疗效,成为临床治疗的难点之一。射频消融(RFA)是HCC局部治疗的一大进展,旨在通过热传导使肿瘤细胞发生凝固坏死,从而达到治疗目的。Habib VesOpen导管是一种较为新型的腔内双极RFA导管,与其结构相似的EndoHPB双极RFA导管消融胆管癌栓的有效性及安全性已见报道证实[1]。近期多篇文献报道采用Habib导管行RFA治疗胆道狭窄或胆道支架再狭窄患者均未发生严重并发症,且中位胆道通畅时间长达50~102.5 d[2-4]。本实验通过经皮经肝穿刺行局部Habib VesOpen导管热消融小型猪门静脉,在厂商推荐的功率范围内最大程度地延长功率输出时间,并建立门静脉模拟癌栓行RFA治疗,观察分析该方法的安全性。
1 材料与方法
1.1实验动物
本研究采用的实验动物系试验用健康小型猪(解放军总医院动物实验中心提供),共10头,雌雄不限,体重(40.0±2.5)kg。将实验动物编号后按随机数字法分成3组,A组6头,B组2头,C组2头。动物实验经过解放军总医院动物管理委员会批准。
1.2实验耗材
Habib VesOpen双极RFA导管(英国EMcision公司产品),套管直径5 F,长1.1 m,可通过0.014英寸导丝,含2个电极,长度5 mm、节距0.2 mm,电极之间间隔6 mm,发热区最小长度20 mm。
1.3实验方法
RFA治疗实验在探索与模拟真实PVTT环境下进行。对A组小型猪(n=6),直接行正常门静脉RFA治疗,使消融时间尽可能长,以获得正常门脉RFA治疗的安全范围;为减少血流所致热量损失,对B组猪(n=2)先行门静脉球囊封堵,然后行门静脉新鲜血栓RFA治疗;为缩小新鲜血栓与真实PVTT间在热传导上的差异,对C组猪(n=2)先建立门静脉模拟癌栓(根据文献报道,血栓形成后2周时大量成纤维细胞长入血栓内,形成机化组织[5-6]),性质接近真实实体肿瘤后再行门静脉RFA治疗。
RFA治疗前后作腹部MRI检查,4周后处死动物取门静脉,并作病理学检查。根据消融区水肿情况与损伤、坏死情况,评价RFA治疗的安全性。
1.4实验步骤
实验动物术前禁食过夜,自由饮水。
采用速眠新注射液(0.1 ml/kg)、盐酸氯胺酮注射液(10 mg/kg)肌肉注射麻醉。麻醉后给予气管插管,观察动物角膜反射、疼痛刺激反应,心率、血压、呼吸等生命体征,并确认平稳。
采用美国通用公司1.5 T超导MRI仪,选择体部相控阵线圈。动物麻醉成功后取仰卧位固定于检查床,肝脏位于线圈中央位置,腹部加压包扎以减轻呼吸运动影响,加呼吸门控。矩阵256×256,层厚5 mm,层间距3 mm,视野40 cm×40 cm,T1WI-FFE序列、T2WI-FFE序列、T2WI-SPAIR脂肪抑制序列。造影增强为人工手推注射器经耳缘静脉快速注入钆贝葡胺注射液(0.4 ml/kg),注射速率约为1.5 ml/s,由本院磁共振成像室医师协助完成。
将动物以仰卧位固定于血管造影床上,给予气管插管,同时耳缘静脉开通静脉通路,以乳酸钠林格注射液维持静脉通路。透视下确定穿刺点(右侧第11肋间,腋前线),采用22 G胆道微穿刺套装穿刺肝内门静脉分支成功后,交换超滑导丝,导入5 F动脉鞘。在超滑导丝导引下将4 F肝动脉导管选择性插入门静脉,行门静脉DSA造影。
实验A组:撤出导引导管,交换导入Habib VesOpen导管,并连接RITA 1500X型射频发生器。根据DSA造影所见动物门静脉走行特点选择门静脉主干或一级分支行RFA术,起始功率分别为5 W或10 W,不设定功率最大输出时间,持续消融直至射频发生器因阻抗饱和自动转为待机模式。
实验B组:撤出导引导管,交换导入球囊导管(直径10 mm,长度4 cm,美国Cook公司),用非离子型对比剂碘克沙醇显与生理盐水1︰1混合液充盈球囊,阻断门静脉主干,导入Habib VesOpen导管,设定消融功率与时间后行RFA治疗。
实验C组:撤出导引导管,交换导入球囊导管,将球囊定位于门静脉主干,经球囊导管取血50 ml与凝血酶冻干粉500 U混合,待其形成血凝块后制成直径3~5 mm碎粒,从球囊导管注入门静脉主干。注入血栓30 min后抽空并撤出球囊,沿留置导丝交换置入4 F导管行肠系膜上静脉-门静脉造影,证实肠系膜上静脉-门静脉血栓形成。撤出导管及血管鞘,用直径5~7 mm海绵颗粒封堵穿刺道[7]。
将建好模型的小型猪送至动物中心,肌内注射庆大霉素8万单位/d,连用3 d预防感染;饲养2周,门静脉超声检查可见仍有血栓存在。
再次麻醉动物行气管插管,经皮经肝门静脉穿刺置入导丝,交换5 F动脉鞘,经导管置入4 F造影导管行门静脉造影检查,可见门静脉充盈缺损,证明门静脉血栓仍在,交换Habib VesOpen导管,置于血栓区行门静脉RFA治疗。
RFA治疗结束后撤出Habib VesOpen导管及血管鞘,用直径5~7 mm明胶海绵颗粒封堵穿刺道。1.5术后处理及观察指标
术后处理:术后2周内观察动物生命体征变化,肌肉注射庆大霉素8万U/d,连用3 d预防感染。
影像学观察:A组、C组动物在术后1个月,B组动物在术后1、3、4周分别复查腹部MRI,重点比较观察门静脉及周围组织变化。
动物大体标本及病理学检查:术后1个月在麻醉状态下于耳缘静脉快速静推10%氯化钾注射液处死实验动物,结扎门静脉并分离肝脏,观察大体标本并置于4%甲醛固定液中固定24 h,经梯度乙醇脱水后石蜡包埋并制成5 μm切片,进行苏木精伊红(HE)染色,显微镜下观察门静脉病理学改变。
2 结果
2.1一般情况
2头小型猪因门静脉纤细,门静脉未穿刺成功。其余实验过程顺利,实验A组术后存活3头,术后第1天死亡1头(尸检提示死亡原因为门静脉破裂出血);B组存活2头;C组存活1头,建模后第1天死亡1头(尸检提示死亡原因为穿刺道出血)(图1)。
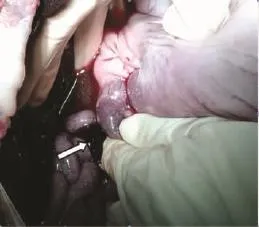
图1 腹腔内大量血性液体及条带状血栓(箭头)
实验中RFA参数见表1。A组治疗中尽可能使RFA时间延长,其中射频输出时间并非按预期一次性达到,射频发生器因阻抗饱和多次转为待机模式,遂间隔数秒后,在保持消融功率不变的情况下重复消融,直至射频发生器因阻抗饱和自动停止。消融时间依据累积达到的时间,功率为5 W、消融时间为0.6~3.6 min时,RFA治疗安全。
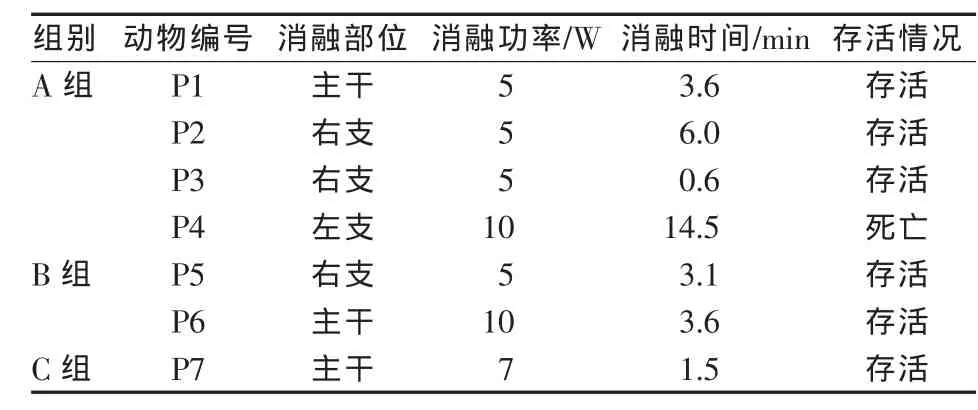
表1 RFA参数
2.2DSA造影表现
A组:经皮经肝穿刺门静脉成功后将4 F导管插至门静脉,门静脉造影显示正常门脉血流通畅,管壁光滑,肝内分支显示清楚。B组:导入球囊导管(直径10 mm,长度4 cm),用对比剂充盈球囊后阻断门静脉主干,经球囊导管造影显示门静脉血流减慢,肝内分支显影明显减少。C组:建立门静脉血栓后抽空球囊,门静脉造影可见门静脉被新鲜血栓堵塞,未见明确分支显影,2周后门静脉造影可见仍有对比剂充盈缺损,提示门静脉主干仍有血栓残存(图2)。
1.3MRI表现
RFA治疗后,MRI检查提示门静脉消融区水肿。A组门静脉周围水肿较轻;B组RFA后1、3、4周腹部MRI检查显示水肿较重,且随时间逐渐消退(图3);C组因RFA时间较短,门静脉周围未见明显水肿。
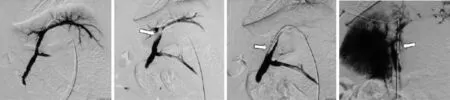
图2 A、B、C组RFA后门静脉DSA表现
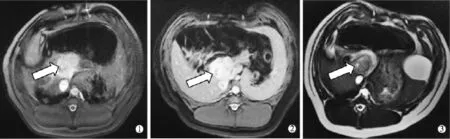
图3 B组RFA后1周、3周、4周腹部MRI表现
1.4病理学观察结果
A组:大体标本见门静脉局部僵硬,可见血栓形成。显微镜下见P1、P2门静脉内膜广泛损伤,中膜部分缺失,外膜完整,但有大量以淋巴细胞为主的炎性细胞渗出,门静脉管腔内可见附壁血栓,其内富含中性粒细胞。P3未见明显异常。
B组:大体标本见门静脉局部僵硬,可见血栓形成;门静脉周围可见大小不等的淋巴结形成。显微镜下见门静脉内膜缺损,有大量以淋巴细胞为主的炎性细胞渗出,管腔内可见附壁血栓,其内富含中性粒细胞,部分门静脉内有红细胞浸润;邻近胆管壁破坏,胆管、肝静脉内可见血栓形成。肝脏呈炎性反应。淋巴结血供丰富,白细胞等炎性细胞渗出。
C组:大体标本见门静脉机化血栓与新鲜血栓并存。显微镜下见门静脉机化血栓组织、消融后坏死组织、新鲜血栓并存,可见血管内皮损伤,血管周围未见明确水肿(图4)。
3 讨论
经导管肝动脉化疗栓塞术(TACE)为晚期HCC首选治疗方法,能明显延长患者生存期[8]。HCC伴发PVTT时,目前的治疗方法有癌栓取出术、TACE术、放射治疗等,但治疗效果有限。
本研究采用的Habib VesOpen导管是英国EMcision公司研制的一种新型双极RFA导管,旨在通过加热杀死肿瘤细胞,在门静脉区形成圆柱形坏死区,从而起到开通门静脉的作用。
猪和人肝门静脉在组织学上无显著差异,管壁可分为内膜、中膜和外膜等3层[9]。门静脉结构相似性是选用猪作为实验对象的原因。
本实验A组治疗功率设定在厂商推荐的5~10 W、2 min范围内,但尽量延长射频时间,观察其对门静脉的损伤程度,评价其对正常门静脉治疗的安全性。我们设立B组,用小球囊阻断门静脉主干,减少血流散热效应,再进行RFA实验;此外,为减少与真实PVTT在热传导方面的差异,又设计了C组,对机化的门静脉血栓行RFA治疗。
A组实验结果证明,在5 W功率、RFA时间0.6~3.6 min条件下,影像学检查及1个月后病理学检查均未发现明确异常;将功率调至10 W、时间延长至14.5 min,则直接导致了动物门静脉穿孔死亡。文献提示门静脉壁很薄,只有约0.61 mm[6],增大RFA功率、延长作用时间后发生门静脉穿孔和周围组织损伤的风险也随之增加。基于以上情况,当PVTT占门静脉横截面积较小,即PVTT较轻时,大功率、短时间RFA治疗方法可能较之小功率、长时间RFA治疗更安全可靠。
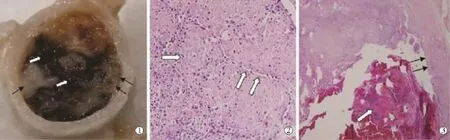
图4 C组大体标本和显微镜下病理学观察
B组RFA术后MRI检查提示门静脉病变范围较A组明显广泛,术后1、3、4周内膜MRI检查提示门静脉水肿逐渐减轻,术后1个月病理学检查证实P5(5 W、3.1 min)邻近组织损伤较轻,而P6(10 W、3.6 min)邻近肝组织损伤严重。由此推断,PVTT占门静脉横截面积较大,即PVTT较重时,选用小功率RFA更为安全。
为减少血液或新鲜血栓与真实PVTT在热传导方面的差异,C组用门静脉机化血栓替代PVTT模型行RFA治疗(功率7 W、90 s),术后MRI检查消融区未见明显水肿,大体标本可见机化血栓与新生成血栓,病理学检查可见机化血栓坏死、血管内皮细胞受损,但未见明确的周围组织水肿。分析原因可能有:①实验所采用的RFA功率与时间均较低,未能造成明显毁损;②建好的门静脉血栓再通严重,血流带走部分热量使得消融效果明显降低。因而推测,治疗中应增大RFA功率或延长消融时间。
本实验的局限性在于,实验动物数量少,只能得出实验变化趋势,无法建立大规模样本进行统计学分析。此外,本实验建立的机化血栓用于替代PVTT模型,而血栓在机体自身调节作用下很容易再通、消失,导致建模失败,且机化血栓无癌栓的侵袭性,因此门静脉机化血栓的消融参数对于真实PVTT消融术仅可作为借鉴。
本实验结果提示采用Habib VesOpen双极RFA导管治疗PVTT时,应根据PVTT严重程度设定个体化射频功率及时间。实验提示PVTT较轻时采用大功率、短时间RFA治疗可能较安全,PVTT较重时改用小功率、长时间RFA更为安全可靠。
[1]Steel AW,Postgate AJ,Khorsandi S,et al.Endoscopically applied radiofrequency ablation appears to be safe in the treatment of malignant biliary obstruction[J].Gastrointest Endosc,2011,73: 149-153.
[2]Pai M,Valek V,Tomas A,et al.Percutaneous intraductal radiofrequency ablation for clearance of occluded metal stent in malignant biliary obstruction:feasibility and early results[J]. Cardiovasc Intervent Radiol,2014,37:235-240.
[3]崔宁,李晓群.经皮经肝双极射频消融导管恶性梗阻性黄疸20例[J].介入放射学杂志,2014,8:693-697.
[4]鲁东,吕维富,肖景坤,等.经皮肝穿刺胆道腔内射频消融联合支架植入治疗恶性梗阻性黄疸(附2例报告)[J].介入放射学杂志,2014,23:593-596.
[5]葛智儒,王乐民,徐文俊,等.实验性肺栓塞血栓演变及其意义[J].中国医药导刊,2005,7:374-375.
[6]杨军,奚九一.静脉血栓早期机化阶段动物模型的建立[J].中国中医基础医学杂志,2005,11:199-201.
[7]宋鹏,王茂强,段留新,等.肠系膜上静脉-门静脉血栓动物模型的建立[J].中华消化外科杂志,2009,8:463-465.
[8]Biolato M,Marrone G,Racco S,et al.Transarterial chemoembolization(TACE)for unresectable HCC:a new life begins?[J]. Eur Rev Med Pharmacol Sci,2010,14:356-362.
[9]张一飞,王配军,李文春,等.人与猪肝门静脉壁的细胞核密度的形态定量比较研究[J].解剖学研究,2005,27:126-128.
The safety of Habib VesOpen bipolar radiofrequency ablation catheter used in the treatment of portal vein tumor thrombus:an experimental study in miniature pig models
ZHANG Lin,FU Jin-xin,SONG Peng,YUAN Kai,YAN Jie-yu,DUAN Feng,WANG Mao-qiang,LIU Feng-yong.Department of Interventional Radiology,Chinese PLA General Hospital,Beijing 100853,China
LIU Feng-yong,E-mail:fengyongliu@aliyun.com
ObjectiveTo explore the safety of Habib VesOpen bipolar radiofrequency ablation(RFA)catheter used in the treatment of portal vein tumor thrombus(PVTT).MethodsA total of 10 miniature pigs were randomly divided into 3 groups.Group A(n=6):RFA of normal portal vein was directly performed;group B(n=2):balloon obstruction of the portal vein was performed first,which was followed by RFA for the fresh thrombus in the portal vein;group C(n=2):PVTT model was established first,and RFA of the portal vein was carried out when the portal thrombus became organized.MRI examination was employed at one,3 and 4 weeks after RFA;the animals were sacrificed 4 weeks after RFA and pathological examination of portal vein was performed.ResultsPigs of group A received portal vein RFA under the condition of 5 W power for 0.6-3.6 min.No obvious abnormality was detected by MRI and pathological examination,which were performed one month after the treatment.In the pigs of group B,MRI performed after RFA showed that the damage of portal vein area was more serious than that in the pigs of group A;abdominal MRI examination performed at one,3 and 4 weeks after RFA showed that the portal venous edema was gradually decreased;pathological examination at one month after RFA demonstrated serious injury of adjacent liver tissue.Pigs of group C received portal vein RFA under the condition of 7 W power for 1.5 min;no obvious edema of the ablated area was observed on MRI performed after RFA,and pathological examination revealed organizedthrombus necrosis and vascular endothelial cell damage.ConclusionWhen Habib VesOpen bipolar RFA catheter is used for the treatment of PVTT,the RFA power and time should be properly selected according to the severity of PVTT.In order to ensure a safer procedure,high power and short ablation time should be used when the severity of PVTT is mild,while low power and longer ablation time are recommended when the PVTT is more severe.(J Intervent Radiol,2015,24:515-519)
portal vein tumor thrombus;thrombus;radiofrequency ablation;miniature pig;digital subtraction angiography
R735.7
A
1008-794X(2015)-06-0515-05
2014-12-15)
(本文编辑:边佶)
10.3969/j.issn.1008-794X.2015.06.012
国家自然科学基金面上项目(81271673)、解放军总医院临床科研扶持基金(2012FC-TSYS-1027)
100853北京解放军总医院介入放射科
刘凤永E-mail:fengyongliu@aliyun.com
