TACE联合125I放射性粒子植入治疗肝细胞癌门静脉癌栓
2015-10-28黄文薮蔡明岳曾昭吝黄敬君黄明声单鸿朱康顺
黄文薮,蔡明岳,曾昭吝,黄敬君,黄明声,单鸿,朱康顺
TACE联合125I放射性粒子植入治疗肝细胞癌门静脉癌栓
黄文薮,蔡明岳,曾昭吝,黄敬君,黄明声,单鸿,朱康顺
目的探讨TACE联合125I放射性粒子植入治疗肝细胞癌(HCC)门静脉癌栓(PVTT)的方法及疗效。方法纳入TACE联合CT引导下植入125I放射性粒子治疗的HCC合并PVTT患者48例。根据PVTT部位,分为门静脉主干癌栓(A型)、门静脉一级分支癌栓(B型)和门静脉二级及以下分支癌栓(C型)。根据粒子是否植入到PVTT内,分为癌栓内直接植入法(癌栓内部植入组)和癌栓周围植入法(其粒子植入到癌栓周围1.7 cm内的肝实质或肿瘤内,癌栓周围植入组)。比较不同类型PVTT及不同植入方法的癌栓控制率(DCR)、癌栓进展时间(TTP)及患者总生存率(OS)。结果48例患者均成功进行TACE及粒子植入治疗。A、B、C型PVTT患者,中位OS(mOS)分别为8、11.5和15个月,组间差异有统计学意义(P=0.003);癌栓DCR分别为61.5%、70.8%和72.7%(P=0.548),肝内肿瘤DCR分别为69.2%、75.0%和81.8%(P=0.483);癌栓中位TTP分别为4.5、8和11个月(P=0.030),肝内肿瘤中位TTP分别为5、9和9.5个月。癌栓内部植入组和癌栓周围植入组的mOS分别为10和11.5个月(P=0.239);癌栓DCR分别为69.2%、68.2%(P=0.591),肝内肿瘤DCR分别为73.1%和77.3%(P=0.502);癌栓中位TTP分别为7和10个月(P=0.276),肝内肿瘤中位TTP分别为8和9.5个月(P=0.089)。结论TACE联合125I放射性粒子植入治疗HCC伴PVTT,可有效控制PVTT和肝内肿瘤进展,延长患者生存期;癌栓内直接植入法和癌栓周围植入法,对PVTT的疗效无影响。
肝细胞癌;门静脉癌栓;近距离内照射治疗;肝动脉化疗栓塞
肝细胞癌(HCC)由于发病隐匿,诊断时往往已属晚期。文献报道,12.5%~39.7%HCC患者在诊断时就已存在门静脉癌栓(portal vein tumor thrombus,PVTT)[1]。伴有PVTT的HCC患者属巴萨罗那(Barcelona Clinic Liver Cancer,BCLC)分期C期,预后极差,平均生存率小于4个月[2]。如何对PVTT进行有效的治疗,是提高晚期HCC患者生存期的关键。文献报道,外照射治疗如三维适形外放射治疗(three-dimensional conformal radiotherapy,3D CRT)对治疗PVTT有一定效果[3]。但3D CRT存在许多局限:如放射视野大,较难避免正常肝组织(如胆管)的放射性损伤;照射剂量低、周期间隔长,难以对局部癌栓起到持续性彻底杀伤作用等。近年来兴起的应用125I放射性粒子植入近距离内照射治疗恶性肿瘤,可克服3D CRT外照射的局限。本文在TACE基础上,联合125I粒子植入治疗48例HCC合并PVTT患者,取得了满意疗效,现报道如下。
1 材料与方法
1.1材料
1.1.1一般资料2011年10月—2014年3月在中山大学附属第三医院行TACE联合CT引导下125I放射性粒子植入治疗的HCC伴PVTT患者56例。所有患者HCC的诊断根据美国肝病学会(American Association for the Study of Liver Diseases,AASLD)标准[4]确诊。PVTT由2名具有10年以上腹部影像学诊断经验的医师进行诊断,2名医师分别评阅CT或MR三期动态增强扫描影像,一致诊断为PVTT时认为诊断确立。所有患者均有慢性乙型肝炎及肝硬化背景。本研究纳入标准为:①初次在我院接受TACE联合CT引导下植入125I粒子治疗的HCC合并PVTT患者;②年龄18~75岁;③美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)体力状况(performance status,PS)评分标准为0~2分;④肝功能分级为Child-Pugh A级或B级;⑤PVTT依据TACE前7 d内三期动态增强CT或MR诊断。排除标准为:①PVTT累及肠系膜上静脉、脾静脉者;②门静脉主干PVTT引起门静脉主干完全阻塞,且无门静脉侧支循环者;③肝功能Child-Pugh C级患者;④凝血酶原时间大于18 s者;⑤曾经经历外科手术、索拉菲尼、TACE、射频消融治疗者;⑥研究期间,接受索拉菲尼治疗者。
56例患者中,符合上述条件者48例。根据PVTT的范围分为3型[5],A型:门静脉主干PVTT,13例;B型:门静脉一级分支PVTT,24例;C型:门静脉二级及以下分支PVTT者,11例。
1.1.2材料①密封籽源125I粒子,长4.5 mm,直径0.8 mm,活度0.8 mCi,平均能量27~35 KeV,穿透半径1.7 cm,半衰期为60.1 d。②治疗计划系统(therapy plan system,TPS):北京智博高科有限公司生产的近距离放射治疗三维TPS系统。③引导系统:TOSHIBA 16排螺旋CT,扫描条件为120 kV,180 mAs,层厚及层间隔均为5 mm。
1.2方法
1.2.1总体治疗计划根据HCC患者影像学资料初次诊断为PVTT时,均先行TACE治疗,在TACE后7~10 d内行CT引导下125I粒子植入术,以TPS制定治疗计划,将粒子置于PVTT内部或PVTT周围1.7 cm以内的肝实质或肿瘤内。125I粒子植入术后3和7 d复查肝功能、凝血功能、血常规。术后每4~6周行CT或MR动态增强扫描,评价是否需要再次接受TACE或125I粒子植入。
1.2.2TACE治疗过程经股动脉穿刺入路,使用5 F-RH或Cobra导管插管至肝总动脉,明确肝内肿瘤位置及供血血管。使用微导管超选择插管至肿瘤供血动脉,以洛铂50 mg溶于5 ml 5%葡萄糖注射液中,与超液化碘油10 ml充分混合形成混悬液,缓慢注入肿瘤供血动脉内。再依据供血动脉直径选择不同大小的聚乙烯醇颗粒(polyvinyl alcohol,PVA)或明胶海绵颗粒对肿瘤供血动脉栓塞。对合并肝动脉-门静脉瘘患者,先用300~1000 μm PVA或明胶海绵颗粒栓塞。
1.2.3CT引导下125I粒子植入术治疗过程制定治疗计划:术前常规行肝脏CT平扫及动态增强扫描,定义门静脉癌栓近端为靶区,将相关影像学资料导入TPS系统,制定计划时要求布源点分布在癌栓内部(距癌栓近端<1.7 cm)或其周围肝实质或肿瘤实质(距癌栓近端<1.7 cm),靶体积比(target volume ratio,TVR)>95%,靶区90%致死率剂量(D90)为120~160 Gy。同时确保周边重要器官组织如脊髓、胆囊、胰腺等不受照射,即TVR为0。确定穿刺路径、布源位置、粒子源数目。穿刺路径要求避开肝内大血管、腹腔内血管及重要组织器官如胆囊、胰腺等。
125I粒子植入前,先行CT平扫定位,根据TPS制定的计划,确定穿刺平面、穿刺点及布源位置。局麻后使用18 G穿刺针进行穿刺,穿刺到位后按治疗计划布源。125I粒子置于PVTT内或其周围1.7 cm内的肝实质或肿瘤。在穿刺过程中,如果穿刺针直接穿刺到PVTT,为了避免针道转移,则直接植入125I粒子,之后更换穿刺针继续进行布源。术毕再次行肝脏平扫,验证125I粒子放置数目及位置,并与预定计划进行比较,进行质量验证,必要时再次置放粒子。术后3、7 d复查肝功能、凝血时间及血常规。每4~6周行CT或MR动态增强扫描评价治疗效果。
1.2.4疗效评价由2名具有10年以上影像学诊断经验的医师,共同分析联合治疗术前及术后随访的CT或MR影像学资料,评价联合治疗后肝内肿瘤及PVTT的变化,观察有无肝内新发病灶或远处转移等。
1.2.4.1PVTT的疗效评价标准:由于PVTT的疗效评价目前尚缺乏客观标准[6],因此,由上述2名医师分别结合术前和术后影像学表现,依据下述标准进行PVTT疗效评价,如评价结果不一致则共同讨论决定,同时观察治疗前后门静脉主干的通畅情况:①完全缓解(CR),指PVTT全部消失;②部分缓解(PR),指PVTT范围缩小;③病灶稳定(SD),指PVTT范围无明显增大或缩小;④病灶进展(PD),指PVTT范围增大。
1.2.4.2肝内肿瘤病灶疗效评价标准:以改良实体瘤疗效评价标准[6](modified response evaluation criteria in solid tumors,mRECIST)评价治疗效果。①CR,定义为肝内病灶全部消失;②PR,肝内病灶范围较前缩小30%以上;③SD,肝内病灶范围缩小不超过30%,增大小于20%;④PD,肝内病灶范围增大超过20%,或出现新发的肝内转移灶或远处转移灶。
1.2.4.3疾病控制率(disease control rate,DCR):定义为联合治疗后肝内病灶或PVTT根据上述标准评价为CR、PR或SD,并且至少持续4周以上的患者百分比,即(CR+PR+SD)×100%。
1.3统计学分析
根据粒子植入方法、125I粒子是否植入到PVTT内,分为内部植入组(粒子直接植入癌栓内)和周围植入组(125I粒子植入到癌栓周围1.7 cm内的肝实质或肿瘤内)。使用SPSS 19.0统计学软件,分别统计患者总体、不同类型(A、B、C型)的PVTT以及不同方法(内部植入组及周围植入组)患者的DCR、至疾病进展时间(time to tumor progression,TTP)、总生存期(overall survival,OS)。组间DCR比较采用Pearson Chi-Square法,组间TTP和OS比较采用Kaplan-Meier法。P<0.05被认为差异有统计学意义。
2 结果
2.1技术成功率
48例患者均完成TACE和粒子植入,技术成功率100%,其中癌栓内部植入组26例,癌栓周围植入组22例。共行TACE术103例次,行粒子植入术61例次。每次植入粒子数为14~50粒,肿瘤匹配周边剂量为120~160 Gy。植入粒子总数为1 284粒,例均植入粒子26.7粒。
48例患者中,4例发生粒子移位于门静脉三级分支以下。所有患者术中及术后均未发生严重并发症。患者肝功能指标(ALT、AST、总胆红素、白蛋白,凝血酶原时间等)及血常规指标,联合治疗后无明显变化。
2.2不同类型PVTT的疗效比较
48例患者联合治疗后PVTT总DCR为68.8%。A、B、C型PVTT患者的中位OS(mOS)分别为8、11.5和15个月,组间比较差异有统计学意义(P=0.03)。不同类型PVTT的DCR、中位TTP和肝内肿瘤中位TTP比较见表1、2。48例患者治疗后,32例(66.7%)患者门静脉主干完全通畅,其中A型2例,B型19例(图1),C型11例。不同类型PVTT生存曲线分析见图2。
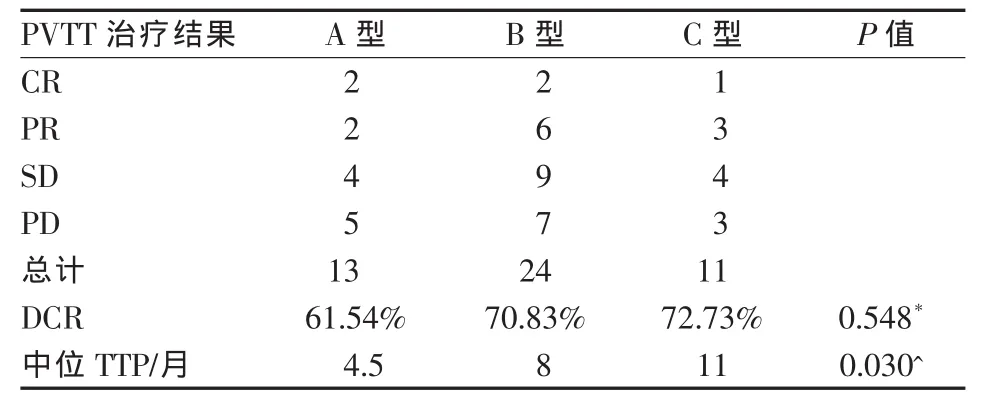
表1 不同类型PVTT的疗效比较(例)
2.3不同粒子植入方法的疗效比较
48例患者随访期间,死亡18例,失访9例,21例存活。中位OS为12.5个月。26例癌栓内部植入组中,死亡10例,失访6例,存活10例,mOS为10个月;22例癌栓周围植入组中,死亡8例,失访3例,存活11例,mOS为11.5个月。两组间mOS比较无统计学意义(P=0.239)。
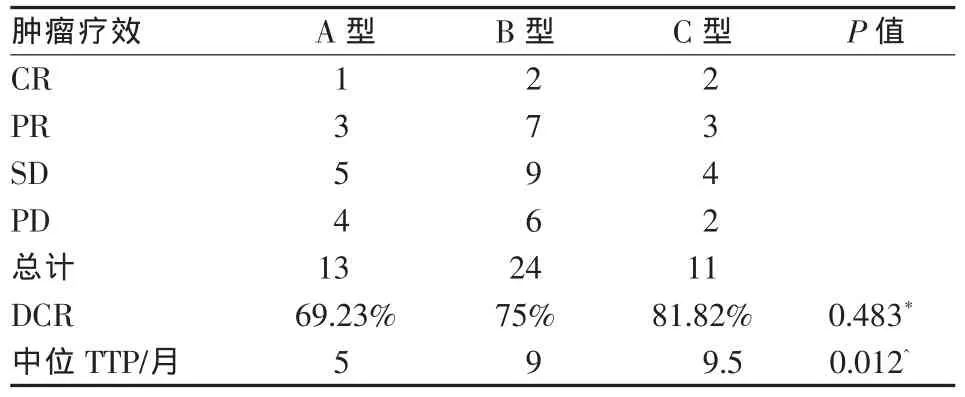
表2 不同类型PVTT的肝内肿瘤疗效比较(例)
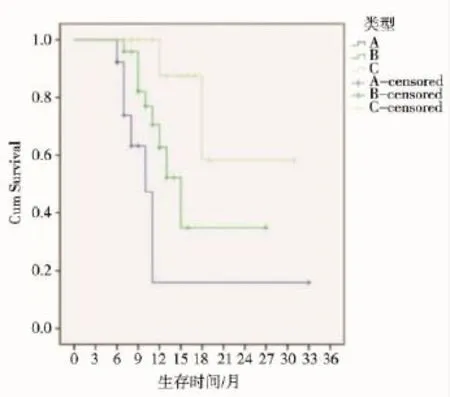
图2 不同类型PVTT患者的生存曲线
癌栓内部植入组与癌栓周围植入组PVTT和肝内病灶的DCR、中位TTP比较见表3、4。

图1 不同部位癌栓治疗结果
在12例肝内病灶PD患者中,有6例仅为肝内原发病灶增大,肝内及全身未见新发病灶;有6例可发现肝内新发病灶,其中内部植入组4例,周边植入组2例。

表3 不同粒子植入方法的PVTT疗效
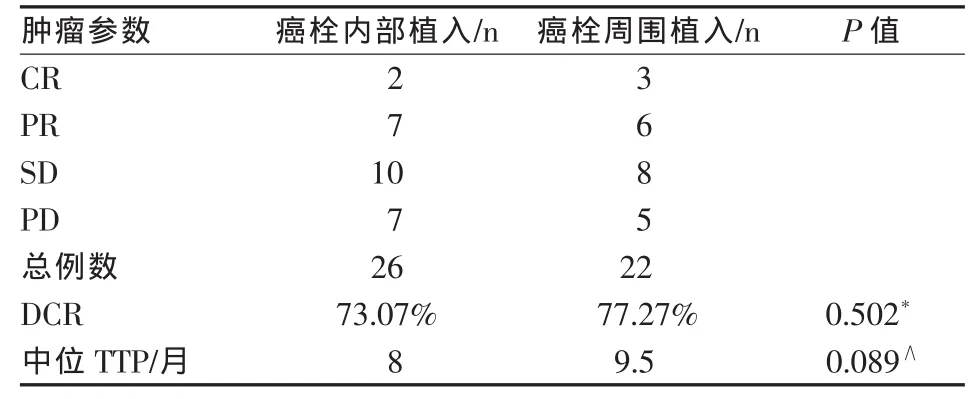
表4 不同粒子植入方法的肝内肿瘤疗效
3 讨论
如何对PVTT进行有效的治疗,是提高晚期HCC患者生存期的关键。TACE已成为中晚期HCC的主要治疗手段之一,但其治疗作用,主要体现在治疗肝内原发肿瘤病灶,对癌栓的治疗作用甚微,较少或很少有碘化油化疗栓塞乳剂进入到癌栓,这也是目前TACE对合并PVTT的HCC治疗效果不理想的重要原因。
HCC对放射治疗较为敏感,文献报道3D-CRT等外放射治疗PVTT,mOS可达到6.7~8个月[7]。植入125I放射性粒子行近距离内照射治疗肿瘤,近年来引起关注[8-9]。与3D CRT等传统外照射治疗相比,125I放射性粒子治疗PVTT具有以下优势:①靶区局部照射剂量高,可达120~160 Gy,可以更有效杀死肿瘤细胞。与此同时,靶区周边正常组织器官的放射性损伤可控制在最小范围;②植入于体内照射靶区,照射范围不受呼吸及体位等影响;③对靶区的照射为持续性,可不间断地以治疗剂量对肿瘤进行照射,作用于各个增殖周期的肿瘤细胞;④术前以TPS制定计划,可精确控制肿瘤整体的照射剂量,并确保肿瘤内部照射剂量均匀一致。
HCC合并PVTT的治疗难度在于如何对PVTT进行有效治疗,控制其进展和肝内转移。然而,TACE的作用主要针对肝内肿瘤,对PVTT作用甚微,其对合并门静脉主干和一级分支癌栓者1年生存率只有5.8%[10-11]。本研究利用125I放射性粒子近距离内照射治疗的优势,在TACE栓塞肝内肿瘤和癌栓血供的基础上,将粒子精准植入到癌栓内或癌栓周围距PVTT近端1.7 cm处,达到有效治疗癌栓和控制肝内肿瘤的目的。对合并门静脉主干、一级分支、二级分支癌栓患者的mOS分别达到8、11.5和15个月,较文献报道单纯TACE或单纯放疗明显提高[7-12]。我们认为这主要归功于125I粒子对癌栓的有效控制和TACE对肝内肿瘤的栓塞作用:①125I粒子对癌栓的有效控制,对门静脉主干、一级分支、二级分支癌栓控制率分别达到61.54%、70.83%、72.73%,中位TTP时间分别达到4.5个月、8个月和11个月。②癌栓的有效控制和TACE的作用,缓解了肝内肿瘤的进展。本研究中,不同类型PVTT肝内肿瘤的中位TTP时间均达到5个月以上。③癌栓的有效控制还可维持门静脉主干通畅,减轻肝功能损伤,为后续TACE治疗提供条件。本研究中,有32例(66.7%)患者保持门静脉主干完全通畅。
PVTT的部位与患者预后密切相关。Shi等[13]发现,外科手术治疗合并PVTT的HCC患者,PVTT受侵范围越广,预后越差。Niu等[14]以TACE治疗HCC伴PVTT也发现,癌栓越接近门静脉主干,治疗效果越差。本研究也得出相似结果:PVTT侵犯范围越接近门静脉主干,mOS越短。分析其原因,可能与125I放射性粒子不能按计划植入到门静脉主干癌栓有关。因受肝裂和肝门部较大肝动脉、胆道的影响,部分患者门静脉主干癌栓的近端及周围1.7 cm范围内不能按计划植入125I粒子,因而部分癌栓不在粒子照射范围内而影响疗效。对门静脉主干癌栓患者,仍是125I粒子植入治疗的难点,术前应仔细评估穿刺针的入路,利用125I粒子治疗的有效照射范围,使主干癌栓在粒子照射范围内,达到有效治疗癌栓的目的。
本研究发现,125I粒子直接植入到癌栓内和植入到癌栓周围1.7 cm范围内的肝实质或肿瘤中,可同样发挥对癌栓的治疗作用,2种植入方法对癌栓的控制率和中位TTP相似,差异无统计学意义。这为我们在CT引导下按治疗计划植入125I粒子,确保PVTT充分受到照射提供了条件。我们可以按照治疗计划,在确保PVTT充分受照射的前提下,将125I粒子植入到距PVTT近端1.7 cm内的周围肝实质或肿瘤中。这种植入方法对门静脉主干PVTT者可能更为合适,特别是在严重肝硬化患者中,由于肝脏缩小、肝裂增宽,门静脉主干缺乏肝实质包绕保护,直接穿刺PVTT更易导致腹腔出血,而125I粒子植入到PVTT周围肝实质内,可减少穿刺出血的风险。另外,粒子放置在癌栓周围,而非直接穿刺癌栓置放者,还可能减少癌栓脱落、发生癌栓肝内播散和粒子顺门静脉血流移位。本研究中观察到12例肝内病灶PD患者中,有6例发现肝内新发病灶,其中内部植入组4例,周围植入组2例。内部植入组的8例PD患者中还观察到4例粒子移位至门静脉次级分支。以上现象提示粒子直接植入于癌栓内部时,可能导致肝内肿瘤扩散。
综上所述,在TACE基础上,联合125I粒子植入HCC合并PVTT的患者进行近距离内照射治疗,可有效控制PVTT和肝内肿瘤进展,延长患者生存时间,对门静脉一级及以下分支癌栓者,联合治疗更有效。将粒子植入到PVTT近端周围肝实质或肿瘤实质(距癌栓近端<1.7 cm)内,与直接穿刺植入到PVTT内,对PVTT的治疗效果相似,适合应用于门静脉主干癌栓的粒子治疗,直接穿刺植入法可能增加因穿刺导致的肝内肿瘤播散。
[1]Minagawa M,Makuuchi M.Treatment of hepatocellularcarcinoma accompanied by portalvein tumor thrombus[J].World J Gastroenterol,2006,12:7561-7567.
[2]Llovet JM,Bustamante J,Castells A,et al.Natural history of untreated nonsurgical hepatocellular carcinoma:rationale for the design and evaluation of therapeutic trials[J].Hepatology,1999,29:62-67.
[3]Bruix J,Sherman M,Practice Guidelines Committee,American Association for the Study of Liver Diseases.Management of hepatocellulacarcinoma[J].Hepatology,2005,42:1208-1236.
[4]Tazawa J,Maeda M,Sakai Y,et al.Radiation therapy in combination with transcatheter arterial chemoembolization for hepatocellular carcinoma with extensive portal vein involvement[J].J Gastroenterol Hepatol,2001,16:660-665.
[5]Zhu K,Chen J,Lai L,et al.Hepatocellular carcinoma with portal vein tumor thrombus:treatment with transarterial chemoembolization combined with sorafenib:a retrospective controlled study[J].Radiology,2014,272:284-293.
[6]Lencioni R,Llovet JR.Modified RECIST(mRECIST)assessment for hepatocellular carcinoma[J].Semin Liver Dis,2010,30:52-60.
[7]Zeng ZC,Fan J,Tang ZY,et al.A comparison of treatment combinations with and without radiotherapy for hepatocellular carcinoma with portal vein and/or inferior vena cava tumor thrombus[J].Int J Radiat Oncol Biol Phys,2005,61:432-443.
[8]刘健,张福君,吴沛宏,等.CT导向下125Ⅰ粒子植入治疗肝门区肝癌[J].介入放射学杂志,2005,14:606-609.
[9]翁志成,杨维竹,江娜,等.CT引导下125Ⅰ放射性粒子植入治疗肝癌门静脉癌栓的疗效评价[J].介入放射学杂志,2010,19:535-539.
[10]Chung GE,Lee JH,Kim HY,et al.Transarterial chemoembo lization can be safely performed in patients with hepatocellular carcinoma invading the main portal vein and may improve the overall survival[J].Radiology,2011,258:627-634.
[11]Luo J,Guo RP,Lai EC,et al.Transarterial chemoembolization for unresectable hepatocellular carcinoma with portal vein tumor thrombosis:a prospective comparative study[J].Ann Surg Oncol,2011,18:413-420.
[12]Georgiades CS,Hong K.D'angelo M,et al.Safety and efficacy of transarterial chemoembolization in patients with unresectable hepatocellular carcinoma and portal vein thrombosis[J].J Vasc Interv Radiol,2005,16:1653-1659.
[13]Shi J,Lai EH,Li N,et al.Surgical treatment of hepatocellular carcinoma with portal vein tumor thrombus[J].Ann Surg Oncol,2010,17:2073-2080.
[14]Niu ZJ,Ma YL,Kang P,et al.Transarterial chemoembolization compared with conservative treatment for advanced hepatoce llular carcinoma with portal vein tumor thrombus:using a new classification[J].Med Oncol,2012,29:2992-2997.
Transarterial chemoembolization combined with CT-guided125I seed implantation for the treatment of hepatocellular carcinoma associated with portal vein tumor thrombus
HUANG Wen-sou,CAI Ming-yue,ZENG Zhao-lin,HUANG Jing-jun,HUANG Ming-sheng,SHAN Hong,ZHU Kang-shun.Department of Radiology,Third Affiliated Hospital of Sun Yet-sen University,Interventional Radiology Institute,Sun Yat-sen University,Guangzhou,Guangdong Province 510630,China
ZHU Kang-shun,E-mail:zhksh010@163.com
ObjectiveTo evaluate the therapeutic effect of transarterial chemoembolization(TACE)combined with CT-guided125I seed implantation in treating hepatocellular carcinoma(HCC)complicated by portal vein tumor thrombus(PVTT),and to discuss the technical points.MethodsA total of 48 HCC patients with PVTT were enrolled in this study.TACE combined with CT-guided125I seed implantation was carried out in all 48 patients.Based on the sites of PVTT,the lesions were classified into type A(PVTT within main portal vein),type B(PVTT within level-1 portal branch)and type C(PVTT within level-2 or more distal portal branch).According to whether the125I seeds were directly implanted into the PVTT or not,the patients were divided into direct in-tumor thrombus implantation group(group A)and around tumor thrombus implantation group(group B;the125I seeds were implanted in the liver parenchyma or in tumor tissue around the tumor thrombus within 1.7 cm region).The tumor thrombus control rate(TTCR),the disease control rate(DCR),the time to progress(TTP)and the overall survival rate of patients(OS)were determined,and the results were compared among different types and groups.ResultsTACE combined with CT-guided125I seed implantationwas successfully accomplished in all 48 patients.The median OS of type A,B and C was 8,11.5 and 15 months respectively(P=0.003);the TTCR of type A,B and C was 61.5%,70.8%and 72.7%respectively(P= 0.548);the DCR of type A,B and C was 69.2%,75%and 81.8%respectively(P=0.483);the median TTP of type A,B and C was 4.5,8 and 11 months respectively(P=0.030);the median TTP of intra-hepatic tumor of type A,B and C was 5,9 and 9.5 months respectively(P=0.012).The median OS in group A and group B was 10 and 11.5 months respectively(P=0.239);the TTCR in group A and group B was 69.2%and 68.2% respectively(P=0.591);the DCR of intra-hepatic tumor in group A and group B was 73.1%and 77.3% respectively(P=0.502);the median TTP of tumor thrombus in group A and group B was 7 and 10 months respectively(P=0.276);and the median TTP of intra-hepatic tumor in group A and group B was 8 and 9.5 months respectively(P=0.089).ConclusionFor the treatment of hepatocellular carcinoma complicated by portal vein tumor thrombus,TACE combined with CT-guided125I seed implantation can effectively control the progress of both the tumor thrombus and the intra-hepatic tumor and prolong patient's survival time. Implantation of125I seeds into the portal vein tumor thrombus and implantation of125I seeds into the liver parenchyma around the tumor thrombus have the same therapeutic results.(J Intervent Radiol,2015,24:488-493)
hepatocellular carcinoma;portal vein tumor thrombus;brachytherapy;transarterial chemoembolization
R735.7
A
1008-794X(2015)-06-0488-06
2014-11-17)
(本文编辑:俞瑞纲)
10.3969/j.issn.1008-794X.2015.06.006
国家自然科学基金面上项目(81371655)
510630广州中山大学介入研究所中山大学附属第三医院放射科
朱康顺E-mail:zhksh010@163.com
