木犀草素对大鼠心室肌细胞L型钙电流的影响
2015-10-28闫庆峰李跃萍闫佳
闫庆峰,李跃萍,闫佳
(1.海南医学院附属医院,海南海口570102;2.海南医学院,海南海口571101)
木犀草素对大鼠心室肌细胞L型钙电流的影响
闫庆峰1,李跃萍2,闫佳2
(1.海南医学院附属医院,海南海口570102;2.海南医学院,海南海口571101)
研究木犀草素对大鼠心室肌细胞L型钙电流的影响。分离单个大鼠心室肌细胞,应用全细胞膜片钳技术测定钙电流。木犀草素能够剂量依赖性地降低缺氧心肌细胞L型钙电流:木犀草素小剂量组、中剂量组和大剂量组分别使Ica.L的峰值电流由给药前的(921±51)pA减小到给药后的(583.3±54)pA(P<0.05)、(491.2±47)pA(P<0.05)和(276.3±43)pA(P<0.05),降低Ca2+电流幅值的百分率分别为36.7%、46.7%和70%,而在药物被冲洗5 min后,L型钙电流几乎可恢复到正常水平。木犀草素能够剂量依赖性降低缺氧心室肌细胞的L型钙电流。
木犀草素;膜片钳技术;钙电流;心肌细胞
木犀草素(luteolin)是黄酮类化合物中的代表性成分,也是花生壳的主要药用成分[1]。研究证实木犀草素具有清除氧自由基、降低脂质过氧化反应、抗菌、抗病毒、抗癌、抗过敏和舒张冠脉血管等药理活性[2-4],其天然品在止咳、祛痰和消炎方面均有较好的疗效。我们在既往的实验研究中发现:木犀草素在离体心脏保存和心脏移植中具有较好的应用前景,能显著改善UW(University of Wisconsin solution)液对离体大鼠心脏的低温保存效果(改善心脏的功能,抑制心肌细胞凋亡,减少心肌细胞氧化损伤[5-7],但其作用机理不清,推测其心肌保护作用可能与钙离子有关。因此本研究采用膜片钳技术研究木犀草素对大鼠单个心室肌细胞膜上L型钙电流(L-type Ca2+current,Ica.L)的影响,从而进一步解释木犀草素的作用途径。
1材料与方法
1.1对象和分组
健康成年SD大鼠,雌雄不限,体重(250±5)g,购自西安交通大学医学院动物中心。分离SD大鼠心室肌细胞并随机分为对照组(单纯细胞记录外液)及木犀草素小、中、大三个剂量组(细胞外液中木犀草素终浓度分别为7.5、15、30 μmol/L,这3种剂量的选择依据药理用量的原则,通过预实验筛选得出),共记录32个缺氧大鼠心室肌细胞,每组8个。
1.2药品及试剂
木犀草素(纯度>99%),由杭州福斯特化学品有限公司提供;EGTA、胶原酶(typeⅡ)、HEPES由上海华美公司提供。Na2ATP、CsCl、CsOH、戊巴比妥钠购自美国Sigma公司。其余试剂均为国产分析纯。台氏液(Tyrode solution,mmol/L):NaCl 143,CaCl21.8,KCl 5.4,MgCl20.5,NaH2PO40.3,HEPES 5,glucose 5,用NaOH调节pH至7.4。无钙台氏液除了不含CaCl2外,其余成分与台氏液相同。含酶无钙台氏液:无钙台式液40 mL加入30 mgⅡ型胶原酶。Krebs液(mmol/L):L-glutamic acid 70,KCl 25,MgCl23,taurine 20,NaH2PO410,EGTA 0.5,HEPES 10,葡萄糖10,用KOH调节pH至7.4。含BSA的Krebs液:新鲜Krebs液40 mL加入40 mg BSA。不含葡萄糖的Krebs液除了不含葡萄糖外,其余成分与Krebs液相同。记录L型钙电流的细胞外液(mmol/L):NaCl 135,CaCl21.8,CsCl 4.6,MgCl20.5,HEPES 5,葡萄糖10,用NaOH调节pH至7.4。记录L型钙电流的电极内液(mmol/L):CsCl 140,MgCl20.5,Na2ATP 4,EGTA 1,HEPES 5,葡萄糖5.5,用CsOH调节pH至7.2。木犀草素溶液的配置:用细胞外液直接溶解木犀草素,制成终浓度为7.5、15、30 μmol/L的木犀草素溶液,以上液体均在使用前预充氧20 min~30 min。
1.3心室肌细胞分离
按文献[8]采用酶解法制备心室肌单细胞并进行了改进,步骤如下:大鼠经戊巴比妥钠腹腔麻醉后,游离心脏并浸入4℃的台氏液中,行主动脉插管。然后在37℃下行主动脉逆行灌流心脏:先用无钙台氏液灌流3 min~5 min,然后用含Ⅱ型胶原酶的无钙台氏液40 mL循环灌流15 min~18 min。观察心脏由膨大、张力增高至张力突然消失、松软时用Krebs冲洗心脏2 min终止。用眼科剪沿房室沟处剪下心室部分,取左室游离壁,在Krebs液中剪碎心脏,用200目滤网过滤悬液,室温静置10 min沉降法分离心室肌细胞,弃上清,换入含BSA的Krebs液,静置40 min后逐步复钙至终浓度1.8 mmol/L,形成分离的钙耐受心室肌细胞。室温(18℃~25℃)静置台氏液1 h后,放于不含葡萄糖的Krebs液中,持续通入90%氮气和10%氧气的混合气3 h后得到缺氧心室肌细胞。稳定1 h后进行膜片钳记录钙电流实验。
1.4心室肌细胞L型钙电流的测定
将一滴缺氧心室肌细胞悬液置于倒置显微镜载物平台上的灌流槽中静置5 min,待细胞贴壁后,以1.8 mL/min速度灌流细胞外液,在倒置显微镜下选择长杆状,边缘折光性好,横纹清楚,无收缩活动的心肌细胞进行实验。记录电极选用外径1.4 mm硅硼有芯玻璃微电极毛坯,经微电极拉制仪拉制而成(尖端为1μm~2 μm)。将微电极尖端抛光后冲灌电极内液,调节三维微操纵器将电极缓慢浸入记录外液,入液面前施以10 cm水柱左右的正压,以防止液体中的杂物堵塞电极尖端。入液体后,测量电极阻抗,调零。在细胞记录外液中的电极尖端电阻应为2.5 MΩ~3.5 MΩ。选择在细胞外液中已贴附于平皿底部的中等大小、大小相近的心室肌细胞,调节电极位置,使电极尖端逐渐接近细胞,接触到细胞后,用注射器抽吸形成负压并保持,通过负压吸引作用形成1 GΩ~5 GΩ的巨欧封接,进行快电容补偿,此时施以100 cm水柱左右的脉冲式负压,负压吸引力使电极尖端部分的膜片破裂,电极液与细胞内液相通,而与细胞外液绝缘,此时可见膜电容电流出现,补偿慢电容,形成全细胞记录模式,全细胞记录方式稳定5 min后开始记录心室肌细胞L型钙电流和观察药物作用。心室肌细胞L型钙电流设置:保持电位为-40 mV,指令电压从-40 mV到+50 mV,阶跃10 mV,间隔10s,时程为300 ms,频率为0.5 Hz。观察药物作用时,电流记录设置为:保持电位为-40 mV,钳制电位为0 mV,时程为300 ms。
1.5统计学方法
2结果
2.1缺氧大鼠心室肌细胞L型钙通道电流的记录
本实验共记录了8个大鼠缺氧心室肌细胞的内向Ca2+电流。在电压钳模式下,得到缺氧心室肌细胞细胞Ca2+通道电流曲线,如图1。

图1 缺氧大鼠心室肌细胞L型钙通道电流曲线Fig.1L-type calcium currents in hypoxia treated ventricular myocytes in rats
将实验中记录L型钙通道电流的每一阶跃命令的电压值与其所对应的Ca2+通道电流的最大幅值作图,得到电流-电压关系曲线,如图2所示。
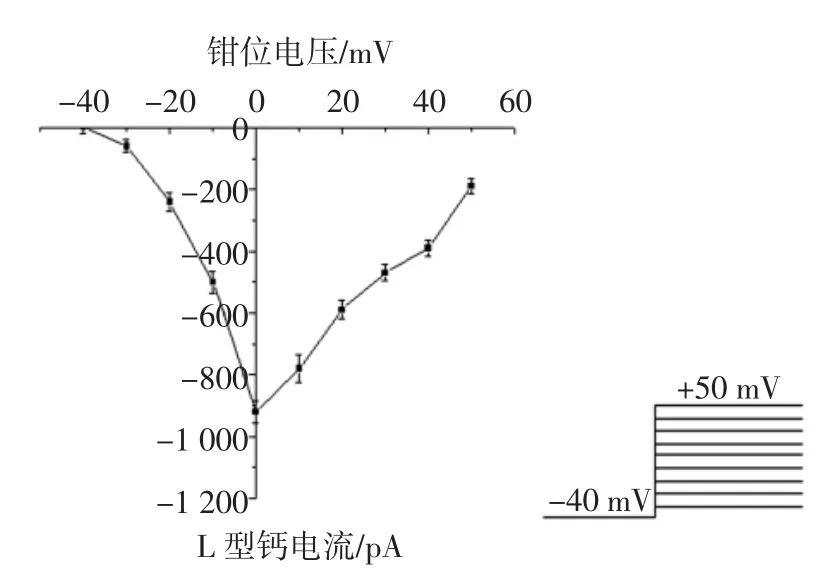
图2 缺氧大鼠心室肌细胞L型钙通道电流-电压关系曲线Fig.2I-V relationship curve of L-type calcium currents in hypoxia treated ventricular myocytes in rats
从中可见从-40 mV开始激活的一系列内向离子流,激活和失活过程均呈电压和时间依赖性,其I-V曲线呈典型的倒置钟型,钳位电压在-30 mV时钙电流出现,峰值电位为0 mV左右。
2.2木犀草素对缺氧大鼠心室肌细胞L型钙通道电流的影响
为了进一步探讨木犀草素对缺氧大鼠心室肌细胞L型钙通道电流的影响,本实验以钳制电位为0 mV时钙电流为对照,在记录外液中加入不同剂量的木犀草素(7.5、15、30 μmol/L),观察各组L型钙通道的电流曲线(n=8)。结果表明,灌流2 min内,木犀草素可剂量依赖性地抑制L型钙通道电流:小、中和大剂量木犀草素分别使Ica.L的峰值电流由给药前的(921±51)pA减小到给药后的(583.3±54)pA(P<0.05)、(491.2± 47)pA(P<0.05)和(276.3±43)pA(P<0.05),降低的Ca2+电流幅值百分率分别为36.7%、46.7%和70%,并且在药物被冲洗5 min后,L型钙电流几乎可恢复到正常水平,见图3。
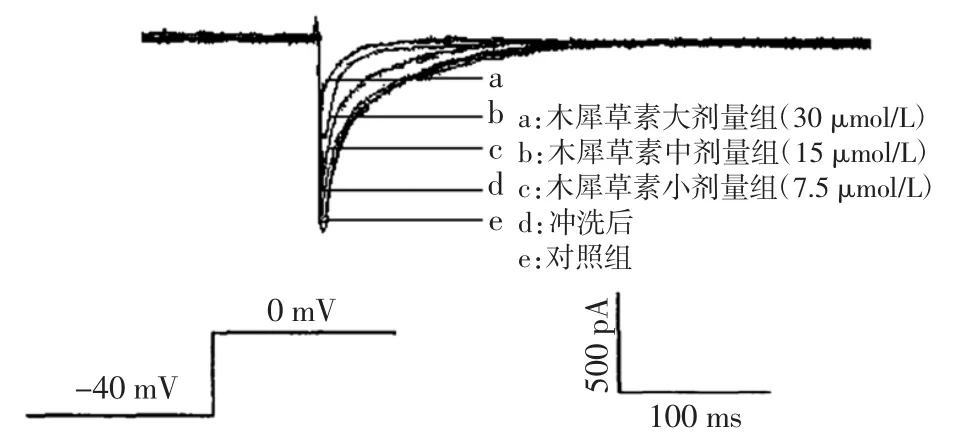
图3 木犀草素对缺氧大鼠心室肌细胞L型钙电流的作用Fig.3Effects of luteolin on L-type calcium currents in hypoxia treated ventricular myocytes in rats
另外我们观察了木犀草素对Ica.LI-V曲线的影响,发现木犀草素可以降低各钳制电位的电流幅度,但不改变ICa.L的激活电压、峰值电压等,因此不影响IV曲线形状,见图4和图5。

图4 木犀草素各剂量组对L型钙电流的影响Fig.4The dose-related effects of luteolin on calcium currents

图5 木犀草素各剂量组对电流-电压(I-V)关系曲线的影响Fig.5The dose-related effects of luteolin on current-voltage(IV)relationship curve of L-type calcium currents
3讨论
众所周知,在心脏冷保存过程中,心肌的缺血和再灌注损伤是导致心肌组织损伤的重要原因。但因其机理十分复杂,现在尚未完全清楚,普遍认可的是氧自由基毒性学说和钙离子超负荷学说,二者相互关联,其共同结果是导致细胞膜性结构破坏以及线粒体功能障碍,ATP生成和储备减少,从而不能修复受损的组织细胞[9]。在生理情况下,经L型钙通道产生的内向钙电流是内钙释放触发的主要机制,同时在心脏缺血再灌注时,L型钙通道产生的内向钙电流进一步加大,引起细胞内钙超载并导致细胞的死亡和凋亡[10],所以L型钙通道的激活对细胞内的钙浓度升高有着极其重要的意义。研究表明,钙超载引起心肌细胞损伤的机理主要有以下几个方面[11]:①大量Ca2+涌入细胞,触发线粒体摄取Ca2+,使Ca2+主要聚集在线粒体内抑制ATP合成,使能量生成障碍。同时Ca2+激活线粒体上磷脂酶,引起线粒体膜损伤,并在线粒体内形成磷酸钙沉淀,改变了线粒体膜的通透性,Ca2+外流,又使细胞由可逆损伤变为不可逆损伤;②激活Ca2+依赖性磷脂酶(主要是磷脂酶C和磷脂酶A2),促进膜磷脂分解。在膜磷脂分解过程中产生的游离脂肪酸、前列腺素、白三烯、溶血磷脂等,均对细胞产生毒害作用;③激活钙依赖蛋白酶,促使胞内许多重要酶降解,同时也促进细胞骨架成分的降解,使胞内无害的黄嘌呤脱氢酶加速转变为黄嘌呤氧化酶,使氧自由基的合成进一步增加;④激活钙依赖性核酸内切酶,引起DNA水解,阻断了胞内依靠转录而进行的潜在修复过程;⑤引起心肌持续痉挛,磷酸肌酸耗竭。
我们的前期研究已在langendorff心脏灌流模型上,观察到木犀草素能显著提高冷保存心脏的功能,减轻心肌的缺血和再灌注损伤。有文献报道,木犀草素可能抑制平滑肌ROC和VDC,提示其可能具有预防心肌细胞钙超载的作用[12]。本研究应用全细胞膜片钳技术,研究木犀草素对缺氧心室肌细胞膜上L型钙通道的影响。结果表明,木犀草素可剂量依赖性抑制缺氧心室肌细胞L型钙通道电流。因此,木犀草素可能通过抑制了L型钙通道电流,减少流入胞内的钙离子,进而减少钙库内钙释放,抑制心肌细胞内钙浓度升高,从而预防钙超载。因此,木犀草素阻制Ca2+内流的心肌保护作用可能是通过在缺血和再灌注早期有力阻制钙离子快速大量进入细胞内,减轻细胞内钙超载,从而改善冷保存心脏的功能。
[1]周建新,林姣,包月红,等.不同溶剂及辅助方法对花生壳提取物中木犀草素含量及抗菌作用的影响[J].中国粮油学报,2014,29(9):87-90,97
[2]Zhu DQ,Liu K,Yi JL,et al.Luteolin inhibits inflammatory response and improves insulin sensitivity in the endothelium[J].Biochimie,2011,93(3):506-512
[3]Choi AY,Choi JH,Yoon H,et al.Luteolin induces apoptosis through endoplasmic teticulum stress and mitochondrial dysfunction in Neuro-2a mouse nerroblastoma cells[J].Eur J Pharmacol,2011,668(1/2):115-126
[4]Rooban BN,Sasikala V,Gayathri Devi V,et al.Prevention of selenite induced oxidative stress and cataractogenesis by luteolin isolated from Vitex negundo[J].Chem Biol Interact,2012,196(1/2):30-38
[5]闫庆峰,闫高峰,杨达宽.木犀草素对冷保存不同时限大鼠心脏功能的影响[J].海南医学院学报,2012(1):1-4
[6]闫庆峰,闫高峰,杨达宽.木犀草素改善低温下离体大鼠心脏保存效果的研究[J].中国应用生理学杂志,2012(2):154-158
[7]闫庆峰,闫高峰,李跃萍,等.木犀草素对冷保存心脏功能及心肌细胞凋亡的影响[J].中国热带医学,2012(4):393-395
[8]Danielsson C,Brask J,Skold AC,et al.Exploration of human,rat,and rabbit embryonic cardiomyocytes suggests K-ehannel block as a common teratogenic mechanism[J].Cardiovasc Res,2013,97(1):23
[9]陈旻,明腾.心肌缺血再灌注损伤机制的研究进展[J].山东医药,2014(41):98-100
[10]孙宇,胡慧媛,郝丽英.心肌L型钙通道钙依赖性调节研究新进展[J].生理科学进展,2013(5):372-376
[11]李伟君,李应东.心肌缺血再灌注损伤钙超载及中医药防治策略[J].中西医结合心脑血管病杂志,2013(2):217-218
[12]Jiang H,Xia Q,Wang X,et al.Luteolin induces vasorelaxion in rat thoracic aorta via calcium and potassium channels[J].Pharmazie,2005,60(6):444-447
The Effect of Luteolin on L-type Calcium Current in Rat Ventricular Muscle Cells
YAN Qing-feng1,LI Yue-ping2,YAN Jia2
(1.Affiliated Hospital of Hainan Medical College,Haikou 570102,Hainan,China;2.Hainan Medical College,Haikou 571101,Hainan,China)
To explore the effect of luteolin on L-type calcium current in rat ventricular muscle cells.The single rat ventricular cell was seperated,and the technique of whole-cell patch clamp was apply to detect the calcium current.The results showed that luteolin dose dependently inhibited the L-type calcium current in hypoxia treated ventricular myocytes of the rats:in low dosage group,middle dosage group and high dosage group,the peak of Ica.Lrespectively reduced from(921±51)pA before treatment to(583.3±54)pA(P<0.05),(491.2±47)pA(P<0.05)and(276.3±43)pA(P<0.05)after treatment,the value of electric current Ca2+that decrease in percentage was 36.7%,46.7%and 70%,respectively,and the electric current Ca2+could almost return to the normal level after luteolin was washout.Luteolin could dose-related inhibit the L-type calcium current in rat hypoxia treated ventricular myocytes.
luteolin;whole-cell patch clamp;calcium current;myocardial cells
10.3969/j.issn.1005-6521.2015.14.002
2015-05-21
海南省自然科学基金资助项目(809042);国家自然科学基金资助项目(81360029)
闫庆峰(1977—),男(汉),副教授,博士,研究方向:心肺保护。
