人脐带和骨髓间充质干细胞体外分离培养及生物学特性比较
2015-10-27马锡慧肖漓冯凯高钰孔祥瑞毕丽丽石炳毅
马锡慧 肖漓 冯凯 高钰 孔祥瑞 毕丽丽 石炳毅
·论著·
人脐带和骨髓间充质干细胞体外分离培养及生物学特性比较
马锡慧 肖漓 冯凯 高钰 孔祥瑞 毕丽丽 石炳毅
目的 体外分离培养、扩增人脐带间充质干细胞(hUC-MSC)和人骨髓间充质干细胞(hBM-MSC),并对其生物学特性进行比较。方法 采用组织块贴壁法从足月胎儿脐带分离、纯化和培养hUC-MSC,健康成人骨髓肝素抗凝后,采用密度梯度离心法分离、纯化和培养hBM-MSC;用倒置显微镜观察两种细胞的形态及细胞生长增殖情况,流式细胞仪分析检测第3代细胞表面标志的表达,Von Kossa染色及油红O染色检测分化潜能。结果 镜下两种细胞均为贴壁生长,形态为均一的成纤维细胞样,取相同数量的细胞传代接种后,hUC-MSC的增殖速率快于hBM-MSC,两种细胞具有均一的细胞表型,均表达CD29、CD44、CD105,不表达CD45、CD34、HLA-DR、HLA-G、CD80、CD86,两种细胞都有成骨、成脂分化潜能,但hUC-MSC的分化潜能更强。结论 hUC-MSC与hBM-MSC具有相似的生物学特性,且前者具有更强的增殖能力和分化潜能,hUC-MSC有望成为hBMMSC理想的替代来源。
间质干细胞; 骨髓; 脐带; 细胞增殖; 细胞分化; 生物学标记
间充质干细胞(mesenchymal stem cell, MSC)是一类具有自我更新、增殖和多向分化潜能的干细胞,大量研究发现MSC具有向内、中、外3个胚层包括肌腱、韧带、肝细胞、心肌细胞和骨髓基质细胞等分化发育的潜能[1-2],而成人骨髓源MSC数量及增殖分化潜能随年龄的增大而下降,由于疾病的原因,患者常有感染、体质较弱等因素也限制了自体骨髓MSC的应用[3-4]。因此,寻找新的MSC来源成为目前国内外干细胞研究的热点。本研究室已经建立了从人足月胎儿脐带中利用组织块贴壁培养人脐带间充质干细胞(human umbilical cord mesenchymal stem cell,hUC-MSC)的方法并对其生物学特性进行了初步的研究[5]。本研究将hUC-MSC和人骨髓间充质干细胞(human bone marrow mesenchymal stem cell, hBM-MSC)体外分离培养及生物学特性进行比较,旨在进一步探讨hUC-MSC的生物学特性,为其在组织工程中的进一步应用提供理论基础和技术支持。
材料与方法
一、材料
所用脐带均来自于解放军第三〇九医院出生的足月健康胎儿,并获得父母知情同意;正常成人骨髓来自于20 ~ 40岁健康献髓者。α-MEM培养液(美国Hyclone公司),低糖DMEM培养液(美国Hyclone公司),高糖DMEM培养液(美国Hyclone公司),胎牛血清(美国Hyclone公司),倒置显微镜(日本Olympus公司),细胞计数板,超净工作台(北京东联哈尔仪器制造有限公司),流式细胞仪FACSCalibur及单克隆抗体CD45-Percp / CD34-PE / HLA-DR-FITC / CD80-PE / CD86-FITC/ CD29-PE /CD44-FITC/CD105-APC/ HLA-G-PE(美国BD公司),CO2培养箱(Thermo Fisher),0.25%胰酶(美国Sigma公司)一次性塑料培养瓶、皿、吸管及离心管(美国Corning公司),成骨、成脂诱导及染色试剂均购自美国Sigma公司。
二、方法
1. hUC-MSC的分离培养:按本实验室建立的方法进行hUC-MSC的分离培养,参照文献[5]进行,过程如下:无菌条件下取脐带15 ~ 25 cm浸泡于PBS中,6 h之内处理。超净台内取出脐带,用注射器吸取PBS充分洗涤脐带血管及表面残留的血液,将脐带剪成2 cm的小段,沿脐静脉纵向剖开,剔除脐静脉、脐动脉,在脐带外膜之内,动静脉之间含特殊黏液的水凝胶样结缔组织即为Wharton's jelly。
将Wharton's jelly在培养皿中剪碎至1 mm × 1 mm × 1 mm大小的组织块,转移至离心管中,PBS离心洗涤2遍(600 × g,5 min),用含10%胎牛血清(FBS)的α-MEM重悬组织块,转移至T75培养瓶中,每瓶5 ml,轻轻晃动培养瓶使组织块在培养瓶中分布均匀,将瓶盖拧松置于37℃、5% CO2培养箱中培养。次日,向每个培养瓶中补加培养液10 ml继续培养,大部分组织块爬出细胞后用0.25%胰酶消化,细胞计数后以2 × 105/cm2的密度接种于T25 cm2中进行传代,待传代细胞融合率达到90%以上,按1:3继续传代,每次传代前镜下观察细胞形态。
2. hBM-MSC的分离培养:参照文献[6]的报道方法稍作改进以密度梯度离心加贴壁法分离培养hBM-MSC,过程叙述如下:按标准骨髓穿刺程序,从自愿献髓者髂后上棘处抽取骨髓20 ml,1:250肝素抗凝,用等量PBS稀释后,缓慢置于等体积Ficoll分离液上,400 × g离心20 min,吸取白膜层,即单个核细胞层,PBS漂洗,400 × g离心10 min,弃上清液,加入含体积分数为10% FBS的α-MEM重悬后接种于T25 cm2中,48 h后换液,以去除未贴壁细胞。以后每周换液2次。待细胞融合至90%时进行传代,以后的操作同hUC-MSC的传代培养。
3.细胞增殖能力检测:两种细胞首次传代时均以2 × 105/cm2的密度接种于T25 cm2中,待传代细胞融合率达到90%以上,按1:3继续传代,每次传代前镜下观察细胞形态并记录每次传代时间,以比较两种细胞的增殖速率。
4.流式细胞仪检测细胞表面标志:分别取第3代hUC-MSC和hBM-MSC进行表面标志检测,将两种细胞均调整为2 × 105/流式管,各9管,其中,各4管样品管按下表进行标记(表1)。
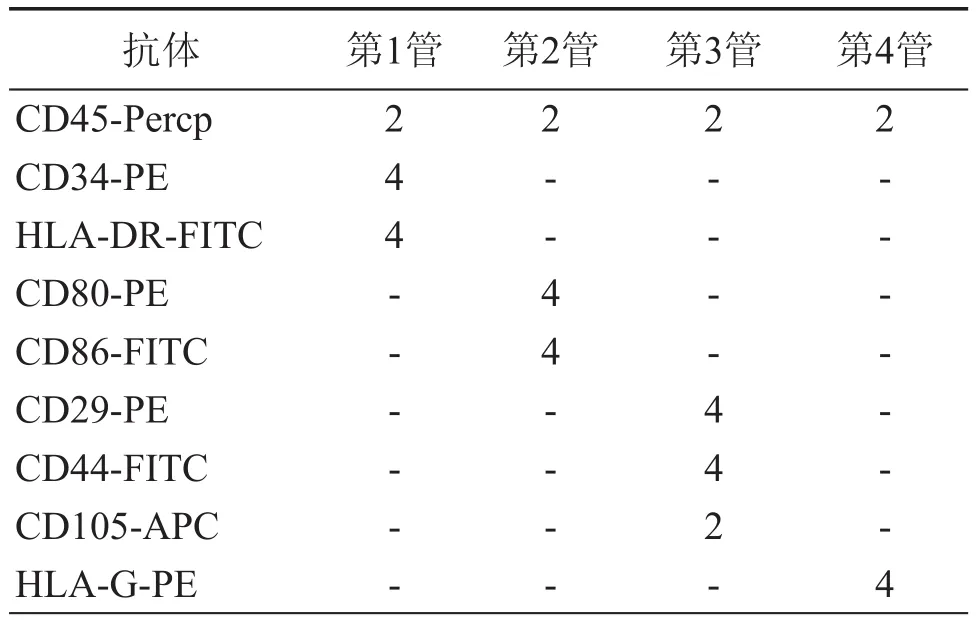
表1 MSC表面标志检测加样(μl )
另外,按上表标记各抗体的同型对照管4管及阴性对照管1管。避光孵育20 min,PBS离心洗涤(300 × g,5 min)1次,每管加入200 μl流式细胞仪固定液,FACSCalibur流式细胞仪检测。
5.细胞分化潜能检测:取第3代hUC-MSC和hBM-MSC分别接种于24孔板进行成骨和成脂诱导,每孔接种细胞数为4 × 104个,成骨诱导液为含体积分数为10%FBS、0.1 μmol/L地塞米松、50 mg/L抗坏血酸、10 mmol/Lβ-磷酸甘油的低糖DMEM培养液,每周换液2次。两周后用4%福尔马林固定,Von Kossa染色[7];成脂诱导液为含体积分数为10%FBS、0.05 mmol/L异甲基-甲基黄嘌呤、200 μmol/L吲哚美辛、10-6mol/L地塞米松、10 g/L胰岛素的高糖DMEM培养液,每周换液2次。两周后用福尔马林固定,油红O染色[8]。另外,两者均设隐性对照。
结 果
一、两种细胞形态观察及生长情况
梯度密度离心法分离的hBM-MSC为圆形单个核细胞,混有少量红细胞,次日换液去除红细胞后,培养瓶内为贴壁细胞,72 h后多数细胞伸出伪足,呈梭形,形态类似成纤维细胞,2周贴壁细胞近90%融合,可进行首次传代。hBM-MSC原代(P0)及第3代(P3)细胞形态(图1a,b)。组织块贴壁法培养hUC-MSC时,7 ~ 10 d可见细胞爬出,长梭形,形态类似成纤维细胞样,换液去除未贴壁组织,2周大部分贴壁组织均可见细胞爬出,且细胞融合率达到90%,呈典型的漩涡状排列生长,可进行首次传代。hUC-MSC原代(P0)及第3代(P3)细胞形态(图1c,d)。
二、两种细胞体外增殖能力比较
两种细胞首次传代时间相同,首次传代二者均以2 × 105/cm2的密度接种于T25 cm2中,以后传代均以1:3进行,培养液均含10%FBS的α-MEM,两种细胞均在体外扩增10代以上,hUCMSC第1代(P1)到第2代(P2)的时间为3 d,短于hBM-MSC(5 d),之后二者的代增时间均加快,hUC-MSC快于hBM-MSC,表明hUC-MSC的增殖能力较强(图2)。
三、两种细胞表面标志的表达
流式细胞仪检测第3代细胞免疫表型显示:hUC-MSC和hBM-MSC均表达CD29、CD44、CD105,不表达CD34、CD45、HLA-DR、HLA-G、CD80、CD86(图3)。
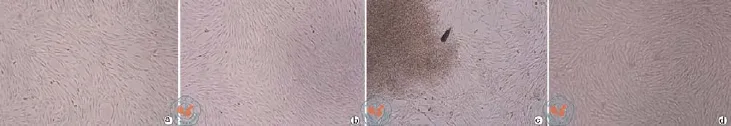
图1 倒置显微镜下观察两种方法培养hBM-MSC和hUC-MSC的形态观察及生长情况(×200)
四、两种细胞分化潜能比较
两种细胞成骨诱导2周后,Von Kossa染色后均有钙盐沉积,且hUC-MSC的着色强度更高,提示hUC-MSC较hBM-MSC具有更强的成骨分化潜能(图4a,b)。
两种细胞成脂诱导2周后,油红O染色后均有脂肪细胞形成,且hUC-MSC形成的脂肪细胞更多,胞浆内的脂肪液滴更多,提示hUC-MSC较hBM-MSC具有更强的成脂分化潜能(图4c,d)。
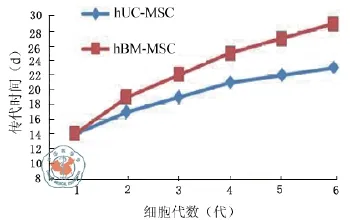
图2 hUC-MSC和hBM-MSC传代时间比较
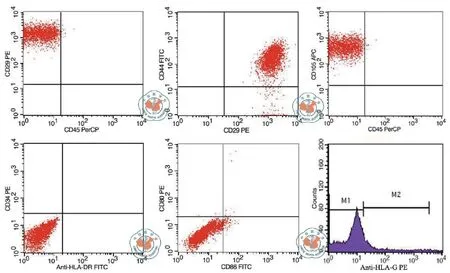
图3 hUC-MSC和hBM-MSC表面标志表达

图4 普通光学显微镜下观察两种方法培养的细胞成骨及成脂诱导情况(×200)
讨 论
目前,骨髓是MSC的主要来源[9]。研究表明,脐带中也存在MSC[5,10],而且,hUC-MSC具有来源丰富、对供者无影响、易于采集和运输、无异体排斥反应和避免伦理争议等诸多优点。另外,已有文献报道:与脐带血相比,脐带是更好的MSC来源[11]。本研究将hUC-MSC和hBM-MSC的形态、生长情况、增殖能力、表面标志及分化潜能进行比较,旨在进一步探讨hUC-MSC的生物学特性,为其进一步应用于组织工程提供理论依据。
本研究中,两种细胞的分离培养方法不同,hUC-MSC采用10 cm脐带分离Wharton's jelly、组织块贴壁获得,而hBM-MSC经采集20 ml骨髓密度梯度离心加贴壁培养获得,因此不能对分离出的细胞数量进行计数,实验显示:来源于10 cm脐带的MSC和来源于20 ml骨髓的MSC首次传代时间一致,而采髓是一种有创操作,因此,从标本的来源考虑,hUC-MSC优于hBM-MSC。
在前期研究中,笔者建立了成熟且简单的从脐带分离MSC的方法,且与hBM-MSC进行了初步的比较[5]。本研究中,通过对两种细胞体外分离培养及生物学特性的比较显示:两种细胞具有相似的细胞形态和生长情况,表面标志一致。与hBM-MSC相比,hUC-MSC具有更强的增殖能力和分化潜能,这与Weiss等[12]研究结果也是一致的。
综上所述,在合理且规范解决脐带来源的基础上,hUC-MSC有望取代hBM-MSC成为组织工程的种子细胞。
1 胡晶琼, 李慧玉, 欧阳为相, 等. 人脐带间充质干细胞的体外分离培养及鉴定[J]. 华中科技大学学报(医学版),2012, 41(5):529-533.
2 Kestendjieva S, Kyurkchiev D, Tsvetkova G, et al. Characterization of mesenchymal stem cells isolated from the human umbilical[J]. Cell Biol Int, 2008, 32(7):724-732.
3 Rebelatto CK, Aguiar AM, Moretão MP, et al. Dissimilar differentiation of mesenchymal stem cells from bone marrow,umbilical cord blood,and adipose tissue[J]. Exp Biol Med (Maywood), 2008, 233(7):901-913.
4 Battula VL, Bareiss PM, Treml S, et al. Human placenta and bone marrow derived MSC cultured in serum-free,b-FGF-containing medium express cell surface frizzled-9 and SSEA-4 and give rise to multilineage differentiation[J]. Differentiation, 2007, 75(4):279-291.
5 冯凯, 肖漓, 马锡慧, 等. 人脐带间充质干细胞分离培养及表面标志检测[J]. 白血病·淋巴瘤, 2013,22(6):354-356.
6 Abdallah BM, Kassem M. The use of mesenchymal(skeletal) stem cells for treatment of degenerative diseases: current status and future perspectives[J]. J Cell Physiol,2009, 218(1):9-12.
7 刘伟,刘萌,祝劲松,等.人骨髓间充质干细胞的体外培养、鉴定及成骨分化[J]. 中国组织工程研究, 2012,16(14):2515-2519.
8 穆晓红, 徐林, 赵子义, 等. 人胎盘与骨髓源间充质干细胞体外培养及生物学特性对比[J]. 中国组织工程研究,2009, 13(19):3708-3712.
9 王恒湘, 郭子宽. 间充质干细胞在组织再生应用中的诸多问题[J]. 组织工程与重建外科杂志, 2008,4(5):241-245.
10 Lu LL, Liu YJ, Yang SG, et al. Isolation and characterization of human umbilical cord mesenchymal stem cells with hematopoiesis-supportive function and other potentials[J]. Haematologica, 2006, 91(8):1017-1026.
11 Caimi PF, Reese J, Lee Z, et al. Emerging therapeutic approaches for multipotent mesenchymal stromal cells[J]. Curr Opin Hematol, 2010, 17(6):505-513.
12 Weiss ML, Medicetty S, Bledsoe AR, et al. Human umbilical cord matrix stem cells:Preliminary characterization and effect of transplantation inarodent model of parkinson's disease[J]. Stem cells, 2006, 24(3):781-792.
Comparison of biological characteristics of human umbilical cord mesenchymal stem cellswith human bone marrow mesenchymal stem cells
Ma Xihui, Xiao Li, Feng Kai, Gao Yu, Kong Xiangrui, Bi Lili, Shi Bingyi. Research Laboratory of Organ Transplantation Research Institute, the 309 Hospital of Chinese People's Liberation Army, Beijing Key Laboratory of Organ Transplantation and Immune Regulation, Beijing 100091, China
Shi bingyi, Email:shibingyi@medmail.com.cn
ObjectiveHuman umbilical cord mesenchymal stem cells(hUC-MSC)and human bone marrow mesenchymal stem cells(hBM-MSC)were isolated, cultured and compared for their biological characteristics. MethodshUC-MSC from full-time fetus were isolated and cultured by tissue adherent method. hBM-MSC were isolated by density gradient centrifugation with heparin from a healthy adult. The morphology and proliferation of two kinds of cells were observed by a inverted microscope andthe surface markers of the third-passage cells were evaluated by flow cytometry. Cell differentiation potential was evaluated with Von Kossa staining and oil red O staining. Results Both kinds of cells attached to the bottom of the wells and formed uniform fibroblast-like clusters under the microscope. The proliferation of hUC-MSC was faster than hBM-MSC in the same culture. Two kinds of cells were uniform in phenotype, expressing CD29, CD44, and CD105. They did not express CD45, CD34, HLA-DR,HLA-G, CD80 and CD86. Both cells had osteogenesis and adipogenesis differentiation potential,but the differentiation potential of hUC-MSC was higher than hBM-MSC. Conclusions hUCMSC and hBM-MSC had similar biological characteristics, and hUC-MSC have higher proliferation and differentiation potential. hUC-MSC are expected to be an ideal alternative forhBM-MSC.
Mesenchymal stem cell; bone marrow; umbilical cord; cell proliferation; cell differentiation; biological markers
2014-09-03)
(本文编辑:蔡晓珍)
10.3877/cma.j.issn.2095-1221.2015.02.002
100091北京,解放军第三〇九医院器官移植研究所移植研究室 北京市器官移植与免疫调节重点实验室
石炳毅,Email:shibingyi@medmail.com.cn
