间充质干细胞对结肠癌细胞Hct-116形成的裸鼠肿瘤的影响
2015-10-27杨小丽宋京翔高琴林晨涂小煌
杨小丽 宋京翔 高琴 林晨 涂小煌
间充质干细胞对结肠癌细胞Hct-116形成的裸鼠肿瘤的影响
杨小丽 宋京翔 高琴 林晨 涂小煌
目的 观察间充质干细胞(MSC)对结肠癌组织的靶向作用及其对肿瘤生长情况的影响。方法 通过注射结肠癌Hct-116细胞建立裸鼠皮下移植瘤模型20只,随机分为实验组和对照组,每组10只,实验组每只裸鼠尾静脉注射0.2 ml标记的MSC细胞悬液,对照组每只裸鼠尾静脉注射0.2 ml生理盐水。观察移植瘤生长情况,每3 ~ 4 d同时测量两组移植瘤瘤长、短径,计算瘤体积,描绘肿瘤生长曲线,于移植MSC14 d,安乐死裸鼠,取皮下移植瘤,称瘤重,计算抑瘤率。肿瘤标本作快速冰冻病理切片,荧光显微镜下观察冰冻病理切片组织Dil阳性细胞;行HE染色,观察病理变化。两组间计量资料比较采用重复测量的方差分析,两两比较采用“球对称”检验。结果 实验组皮下移植瘤组织体积第4天,第7天,第11天,第14天分别为(288.00 ± 57.21)mm3,(394.28 ± 62.24)mm3,(508.13 ± 80.76)mm3,(648.03 ± 104.17)mm3,对照组皮下移植瘤组织体积第4天,第7天,第11天,第14天分别为(292.35 ± 47.31)mm3,(384.95 ± 74.02)mm3,(494.34 ± 92.31)mm3,(607.95 ± 109.58)mm3,两者的差异无统计学意义(P > 0.05);实验组与对照组平均瘤重分别为(1.4770 ± 0.1926)g,(1.4050 ± 0.2088)g,两者差异无统计学意义(P > 0.05)。实验组皮下瘤冰冻病理切片组织于荧光显微镜下观察可见发红色荧光CM-DiI阳性细胞。结论 MSC具有靶向结肠癌组织的作用,对结肠癌组织生长无显著影响。
间质干细胞,骨髓; 结肠肿瘤; 生物学标记; 裸鼠
结直肠癌(colorectal cancer,CRC)在世界范围内的发病率位居恶性肿瘤发病率第4位,其癌症相关死亡率居第2位[1]。虽然如此,但在结直肠癌的治疗领域5年生存率在过去的20年中由50%增至63%[2]。以联合化疗为主的综合治疗可以使中位生存期达24个月[3],尤其靶向治疗是近年来肿瘤治疗的热点。而且也明显提高了肿瘤治疗的有效率。但目前的靶向治疗并非对结肠癌的所有患者均有效,如何寻找更有效的靶向载体及标记物对CRC的诊断和治疗有重要的意义。
间充质干细胞(mesenchymal stem cell,MSC)具有自我更新能力及多种分化潜能,已有大量的实验利用MSC这一特性研究相关疾病的新的治疗方法[4-5],但MSC对于肿瘤组织的作用尚不可知。最新研究表明MSC对肿瘤组织具有极好的靶向作用[6-7],可被募集到肿瘤组织,参与肿瘤间质重塑,而影响肿瘤组织生长[8]。但具体是促进或抑制作用没有统一意见,具体的作用机制也有待进一步深入研究。
本研究通过建立裸鼠结肠癌模型,静脉注射大鼠CM-DiI标记的MSC,荧光显微镜下观察显示红色荧光的CM-DiI阳性细胞,观察MSC迁移情况,同时通过静脉输注治疗剂量的MSC观察肿瘤生长情况,评估MSC对结肠癌生长的影响,为结肠癌患者的临床诊治提供新的思路。
材料与方法
一、材料
BALB/c裸鼠,雄性,4 ~ 6周龄,体重15 ~ 17 g,20只,SD大鼠,雄性,体重60 ~ 80 g,SPF级,均由上海斯莱克实验动物有限责任公司提供。人结肠癌细胞株Hct-116购自中科院上海细胞库。'McCoys 5A培养基购自美国Gibico公司,胎牛血清、DMEM/F-12购自美国HyClone公司,CM-DiI购自美国invitrogen公司。
二、方法
(一)结肠癌模型制备
将对数生长期的Hct-116细胞调整细胞浓度至107/ml。用1 ml无菌注射器吸取细胞悬液0.2 m(l含2 × 106细胞)备用。消毒裸鼠右侧腰部皮肤,将注射器内细胞注射于右侧腰部皮下。共注射20只。注射完毕后,连续观察10 d,待裸鼠右侧腰部长出直径大于5 mm的的皮下瘤,裸鼠结肠癌模型建立。
(二)MSC培养与标记
1.MSC的培养:取4 ~ 6周龄健康雄性SD大鼠体重60 ~ 80 g,处死,酒精浸泡消毒,无菌条件下剥离出股骨和胫骨,用DMEM培养液洗骨髓腔,获得混合细胞悬液。离心,弃上清,加入10 %胎牛血清DMEM制成细胞悬液,接种于培养瓶中,放置于37℃、5%CO2、饱和湿度(95%)的培养箱中培养。48 h首次换液,可见梭状细胞贴壁生长。每3 d换液;每日显微镜观察细胞的形态及生长情况。细胞融合达80%~ 90%时,传代培养。至第3代或第4代可得到足量、纯度高、生长性能好的干细胞。
2.CM-Dil标记MSC:取第3 ~ 5代干细胞,浓缩成106/ml,每ml加入CM-DiI细胞标记液5 μl,37℃的细胞培养箱孵育20 min后,台盼蓝染色并计数。将标记的MSC细胞悬液调整浓度至0.5 × 106个/ml备用。
(三)动物分组
Hct-116细胞注射至裸鼠皮下第10天,将20只裸鼠裸鼠结肠癌模型按随机数字表法分为2组,实验组10只,对照组10只。测2组皮下瘤长径(a)、短径(b),根据肿瘤体积公式:体积= 0.5 ×长径×短径2(V = 0.5ab2),计算瘤体积。测量完毕后,实验组每只裸鼠尾静脉注射0.2 ml浓度为0.5 × 106个/ml的CM-Dil标记的MSC细胞悬液。对照组每只裸鼠尾静脉注射0.2 ml生理盐水。
(四)裸鼠移植瘤体积测量
实验组与对照组裸鼠尾静脉注射MSC细胞悬液或生理盐水后观察裸鼠精神状态、活动情况、食欲及移植瘤生长情况,每3 ~ 4 d测实验组与对照组皮下瘤长径(a)、短径(b),计算瘤体积(同上),描绘肿瘤生长曲线。
(五)结肠癌皮下移植瘤形态学观察及标记的MSC在结肠癌组织中的观察
于裸鼠尾静脉注射MSC或生理盐水后第14天,测实验组与对照组皮下瘤长径(a)、短径(b)随后,处死所有实验裸鼠,剥离2组裸鼠皮下移植瘤,称取瘤重,根据抑瘤率=(对照组平均瘤重-实验组平均瘤重)/对照组平均瘤重×100%,计算抑瘤率。瘤体标本切割成两部分送病理科,一部分作快速冰冻病理切片,荧光显微镜下观察冰冻病理切片组织Dil阳性细胞;另一部分行HE染色,观察病理变化。
三、统计学分析方法
结 果
1.结肠癌皮下瘤体积比较:实验组与对照组经干预后(即实验组尾静脉注射MSC、对照组尾静脉注射生理盐水后),实验组与对照组裸鼠皮下移植瘤体积均较干预前增大。干预前及干预后实验组与对照组裸鼠皮下移植瘤体积所描绘的肿瘤生长曲线(图1)。从数值上看,干预后第4天实验组裸鼠皮下移植瘤体积比对照组体积小;干预后第7天,实验组裸鼠皮下移植瘤体积比对照组体积大;干预后第11天及第14天,实验组裸鼠皮下移植瘤体积均比对照组体积大,但这些数值上的差异经统计学分析后无意义,即干预后第4天、第7天、第11天及第14天实验组与对照组裸鼠皮下移植瘤体积无差异(F = 2.331,P = 0.453,表1)。从实验组与对照组各时间点的肿瘤体积所绘的肿瘤生长曲线也可看出,二者肿瘤体积在个时间点差异不大。
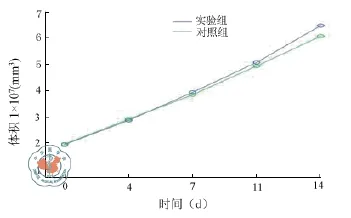
图1 实验组与对照组皮下瘤体积变化曲线(mm3,±s)
表1 实验组与对照组裸鼠皮下移植瘤体积比较(mm3,±s)
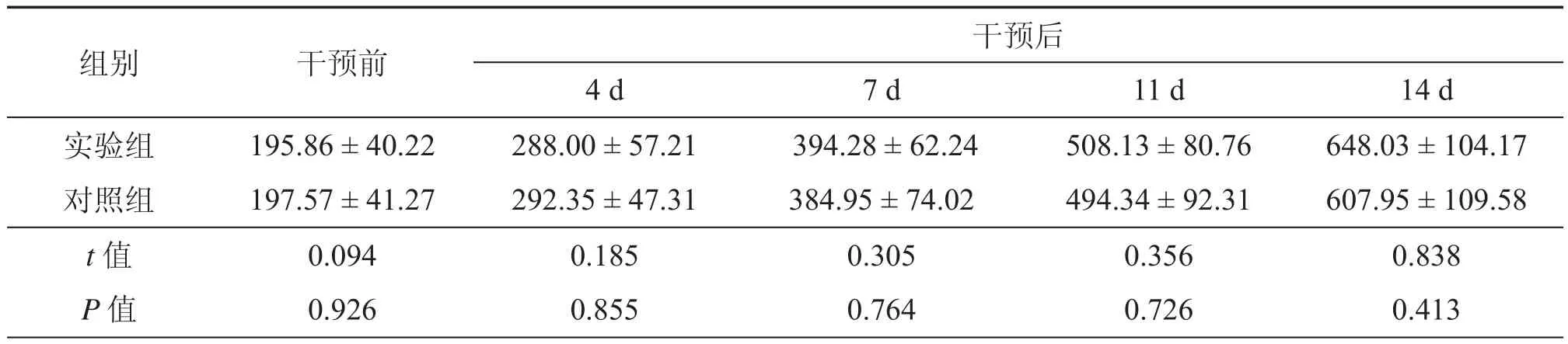
表1 实验组与对照组裸鼠皮下移植瘤体积比较(mm3,±s)
组别干预前干预后4 d7 d11 d14 d实验组195.86 ± 40.22288.00 ± 57.21 394.28 ± 62.24508.13 ± 80.76648.03 ± 104.17对照组197.57 ± 41.27292.35 ± 47.31384.95 ± 74.02494.34 ± 92.31607.95 ± 109.58 t 值0.0940.1850.3050.3560.838 P 值0.9260.8550.7640.7260.413
2.裸鼠皮下瘤瘤重比较:实验结束后,剥离裸鼠皮下瘤,测瘤重。从数值上看,实验组平均瘤重(1.4770 ± 0.1926)g,略大于对照组平均瘤重(1.4050 ± 0.2088)g,但经统计学分析,二者这种瘤重间的差异无统计学意义(P > 0.05),故本实验抑瘤率无法计算。
3.MSC的形态观察、CM-DiI标记荧光观察及其在结肠癌组织中的观察:MSC显微镜下观察原代呈长梭形,合成片,呈菊花状、旋涡状排列;培养至第三代,细胞形态为长梭形,排列有序,呈漩涡样贴壁生长。MSC标记后,荧光显微镜下观察,细胞均显红色荧光,贴壁后细胞呈梭形,呈纤维样,细胞形态呈环状荧光,荧光颗粒多,荧光强,细胞核无荧光(图2a,b)。裸鼠结肠癌皮下移植瘤组织快速冰冻切片在荧光显微镜蓝色通道下观察结果显示实验组结肠癌组织中有红色荧光细胞即CM-DiI标记的MSC(图2c),而对照组结肠癌组织中未观察到红色荧光细胞。图2b为普通光镜观察的结果。
4.结肠癌皮下瘤组织病理分析:对照组结肠癌皮下移植瘤组织病理切片HE染色显示,Hct-116移植瘤细胞为低分化腺癌,癌细胞较大,圆形或椭圆形,细胞浆界限不清,细胞核大小不一,数量不等,存在多核瘤巨细胞,可见病理核分裂像,排列不规则,多弥漫呈片状或巢状,腺腔已不明显或消失,但细胞内充满黏液样分泌物。癌组织周围可见大量片状坏死区,伴淋巴细胞浸润(图3a,b,c)。与对照组相比,实验组(干细胞干预组)结肠癌皮下移植瘤可见癌细胞密度有所降低,癌组织周围坏死区增多,淋巴细胞浸润增多,细胞密度降低,病理性核分裂像减少(图3d,e,f)。
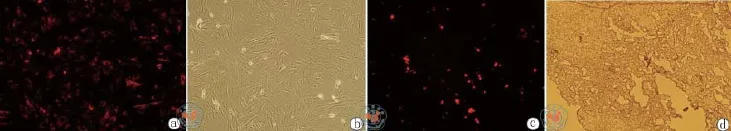
图2 显微镜下观察MSC的形态(×100)
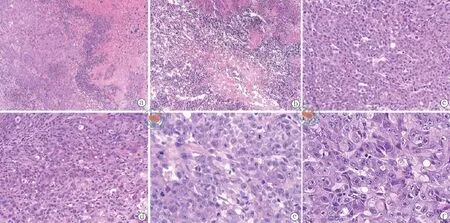
图3 生物倒置显微镜观察干预后实验组与对照组结肠癌皮下瘤组织状况(HE染色)
讨 论
靶向治疗是CRC治疗中的一部分,对于CRC复发及晚期转移患者具有一定作用,对单一化疗效果不明显的患者亦有重要作用[9]。目前CRC靶向药物主要以分子靶向药物为主,而分子靶向药物仅对部分结肠癌患者有效。寻找更为有效的靶向药物是近年来包括CRC在内的肿瘤治疗研究的热点。
骨髓MSC是一类具有强大自我更新能力及多向分化潜能的成体干细胞,在特定的体外和体内条件下不仅可分化为中胚层的骨,软骨细胞等,还可跨胚层横向分化。MSC具有极好的靶向迁移能力和肿瘤趋向性,所以外源MSC进入体内后会聚集在肿瘤组织内,其低免疫原性使得MSC可在宿主体内长期存留[10]。而且MSC在体外分离纯化后能大量扩增,易导入外源基因,并能长时间高效表达[10]。体内的MSC具有免疫调节及支持造血等多种功能。MSC由于具有取材便捷、体外扩增能力强、基因转染效率高和低免疫原性等优点,已成为当前干细胞领域中的研究热点,可作为组织工程中的种子细胞和基因治疗的靶细胞,临床应用前景广阔[6]。
已有研究证实MSC可靶向肝癌、肾癌、胶质瘤及胰腺癌组织[7,11,8,12]。另有研究表明MSC能定向迁移至转移瘤,如前列腺癌肺转移[13]、乳腺癌肺转移[14]、肝癌转移模型[15]。不仅如此,有研究者还利用MSC靶向肿瘤的作用,将MSC作为载体,使表达某些免疫因子的基因在肿瘤组织中高度表达,产生抗肿瘤作用。如将载有IFN-β基因MSC用于胰腺癌模型中[16]、将载有IFN-α基因MSC用于黑色素瘤肺转移[17]、将转染了IL-12的MSC用于肾癌动物模型[11]等。研究表明载有上述免疫因子的MSC在肿瘤动物模型中均发挥着抑制肿瘤生长的作用。本实验通过裸鼠结肠癌模型尾静脉注射CM-DiI荧光标记的MSC,14 d后取裸鼠结肠癌皮下移植瘤冰冻病理观察到荧光标记的MSC,证明MSC对结肠癌组织具有靶向作用。可将某些具有抑瘤作用的基因或药物以MSC作为载体定向运送至结肠癌组织中,发挥抗癌作用。
但MSC本身与肿瘤生长发展的关系尚无定论,影响了MSC用于肿瘤治疗的进一步研究。有研究者将鼠MSC不断传代达一年以上,MSC发生了恶性转化[18]。MSCs可促进肺癌模型中肺癌组织生长[19]。Karnoub等[20]将MSC与乳腺癌细胞混合注射入裸鼠皮下,促进乳腺癌细胞增殖。然而,另有研究证明MSC对某些肿瘤产生了抑制作用。Cousin等[21]在体内、体外实验均证明MSC能抑制胰腺癌细胞的生长。MSC对肿瘤生长的机制亦不明确。本实验就MSC与结肠癌组织的生长的关系做了初步研究。将MSC干预的皮下瘤及对比组瘤体积进行14 d的动态测量并比较,发现二者体积之间随时间变化无明显差异。同时对两组最终瘤重进行测量,发现二者瘤重之间亦无明显差异。通过对结肠癌模型14 d的观察说明MSC对结肠癌皮下移植瘤的生长从大体上观察无影响。但在显微镜下MSC干预组的结肠癌组织已发生着某些变化。对结肠癌皮下移植瘤组织做HE染色病理观察发现,MSC干预组的结肠癌组织较对照组结肠癌癌细胞密度有所降低,癌组织周围坏死区增多,淋巴细胞浸润相对增多。由此不难得出,MSC可募集淋巴细胞至结肠癌组织,并抑制结肠癌细胞增殖、促进结肠癌细胞凋亡。MSC通过何种机制募集淋巴细胞及其促使结肠癌细胞凋亡的机制仍需进一步实验研究。
本实验对MSC作用的结肠癌组织仅做了14 d的动态研究,具有一定局限性。MSC对结肠癌组织的长期影响及其机制的研究尚需进一步的实验研究。但MSC对结肠癌组织的靶向趋化作用已明确。纵然MSC与肿瘤生长关系不明,但研究表明载有免疫因子基因的MSC对肿瘤具有抑制作用[16,17,11]。不仅如此,本实验亦证明MSC并未促进结肠癌组织生长。故将MSC作为载体用于结肠癌的治疗具有一定可行性,可为CRC的治疗带来新的思路。因此,可利用MSC的靶向结肠癌组织的作用,MSC作为运载体将某些抗肿瘤的小分子或者表达抗肿瘤因子的基因定向运载至结肠癌组织,使药物分子能直接快速到达结肠癌组织发挥抗癌作用。
1 Goldberg RM, Meropol NJ, Tabernero J. Accomplishments in 2008 in the treatment of advanced metastatic colorectal cancer[J]. Gastrointest Cancer Res, 2009, 3(5 Supplement 2):S23-27.
2 Greenlee RT, Hill-Harmon MB, Murray T, et al. Cancer statistics, 2001[J]. CA Cancer J Clin, 2001, 51(1):15-36.
3 Falcone A, Masi G, Brunetti I, et al. The triplet combination of irinotecan,oxaliplatin and 5FU/LV (FOLFOXIRI) vs the doublet of irinotecan and 5FU/LV (FOLFIRI) as fi rstline treatment of metastatic colorectal cancer(MCRC): results of a randomized phaseⅢ trial by the Gruppo Oncologico Nord Ovest(G.O.N.O.)[J]. J Clin Oncol, 2006,24(188):3513.
4 Corsten MF, Shah K. Therapeutic stem-cells for cancer treatment:hopes and hurdles in tactical warfare, Lancet Oncol, 2008, 9(4):376-384.
5 Teo AK, Vallier L. Emerging use of stem cells in regenerative medicine[J]. Biochem J, 2010, 428(1):11-23.
6 Hata N, Shinojima N, Gumin J, et al. Platelet-derived growth factor BB mediates the tropism of human mesenchymal stem cells for malignant gliomas[J]. Neurosurgery, 2010, 66(1):144-156.
7 Seong MK, Dal-Soo K, Chang HJ, et al. CXC chemokine receptor 1 enhances the ability of human umbilical cord blood-derived mesenchymal stem cells to migrate toward gliomas[J]. Biochem Biophys Res Commun, 2011,407(4):741-746.
8 BergfelD SA, Declerck YA. Bone marrowderived mesenehymal stem cells and the tumor microenvironment[J]. Cancer Metastasis Review, 2010,29(2):249-261.
9 刘荫华, 徐玲, 姚宏伟. 2010年结直肠癌诊治观点科学解读[J]. 中国实用外科杂志, 2010, 30(9):763-768.
10 Djouad F, Plence P, Bony C, et al. Immunosuppressive effect of mesenchymal stem cells favors tumor growth in allogeneic animals[J]. Blood, 2003, 102(10):3837-3844.
Neurosurgery, 2010, 66(1):144-156.
11 Gao P, Ding Q, Wu Z, et al. Therapeutic potential of human mesenchymal stem cells producing IL-12 in a mouse xenograft model of renal cell carcinoma[J]. Cancer Lett,2010, 290(2):157-166.
12 Zischek C, Niess H, Ischenko I, et al. Targeting tumor stroma using engineered mesenchymal stem cells reduces the growth of pancreatic carcinoma[J]. Ann Surg, 2009, 250(5):747-753.
13 Ren C, Kumar S, Chanda D, et a1. Cancer gene therapy using mesenchymal stem cells expressing interferon-beta in a mouse prostate cancer lung metastasis model[J]. Gene Ther, 2008, 15(21):1446-1453.
14 Sun B, Roh KH, Park JR, et a1. Therapeutic potential of mesenchymal stromal cells in a mouse breast cancer metastasis model[J]. Cytotherapy, 2009, 11(3):289-298.
15 Gao Y, Yao A, Zhang W, et al. Human mesenchymal stem cells overexpressing pigment epithelium-derived factor inhibit hepatocellular carcinoma in nude mice[J]. Oncogene, 2010, 29(19):2784-2794.
16 Kidd S, Caldwell I, Dietrich M, et a1. Mesenchymal stromal cells alone or expressing interferon-beta suppress pancreatic tumors in vivo, an effect countered by anti-inflammatory treatment[J]. Cytotherapy, 2010,12(5):615-625.
17 Ren C, Kumar S, Chanda D, et al. Therapeutic potential of m esenchymal stem cells producing interferon-alpha in a mouse melanoma lung metastasis model[J]. Stem Cells,2008, 26(9):2332-2338.
18 Miura M, Miura Y, Padilla-Nash HM, et a1. Accumulated chromosomal instability in murine bone marrow mesenchymal stem cells leads to malignant transformation[J]. Stem Cells, 2006, 24(4):1095-1103.
19 Hsu HS, Lin JH, Hsu TW, et a1. Mesenchymal stem cells enhance lung cancer initiation through activation of IL-6/JAK2/STAT3 pathway[J]. Lung Cancer, 2012,75(2):167-177.
20 Karnoub AE, Dash AB, Vo AP, et al. Mesenchymal stem cells within tumour stroma promote breast cancer metastasis[J]. Nature, 2007, 449(7162):557-563.
21 Cousin B, Ravet E, Poglio S, et a1. Adult stromal cells derived from human adipose tissue provoke pancreatic cancer cell death both in vitro and in vivo[J]. PLoS One,2009, 4(7):e6278.
Effect of mesenchymal stem cells on Hct-116 tumor development in nude mice
Yang Xiaoli,Song Jingxiang, Gao Qin, Lin Chen, Tu Xiaohuang. Department of General Surgery, Fuzhou General Hospital of Nanjing Military Command, Fuzhou 350025, China
Tu Xiaohuang, Email: fzptwktxhuang@sina.cn
Objective To observe the effect of mesenchymal stem cells(MSC)on the growth of colon cancer. Methods Nude mice xenograft model was established by injecting Hct-116.20 colorectal cancer cells in nude mice. Mice with colorectal cancer were randomly divided into 2 groups: experimental group and control group. The experimental group was injected 2 ml labeled MSC cell suspension(1×106MSC cells) intravenously into the caudal vein. The control group were injected 2ml normal saline intravenously into the caudal vein. The tumor dimensions were measured every three or four days. All mice were sacrificed and tumors were weighed. Tumor tissues were either fixed and observed under the fluorescent microscope,or observed after HE staining.Mauchly's sphericity test was used for repeated measures analysis of variance. Results The tumor volumes in the experimental group at days 4, 7, 11, and 14 were(288.00 ± 57.21)mm3, (394.28 ± 62.24)mm3, (508.13 ± 80.76)mm3, and(648.03 ± 104.17)mm3, respectively; The tumor volumes were(292.35 ± 47.31)mm3,(384.95 ± 74.02)mm3,(494.34 ± 92.31)mm3,and(607.95 ± 109.58)mm3,respectively at days 4, 7, 11, and 14 in the control group(P > 0.05). The average tumor weight in the experimental group was(1.4770 ± 0.1926)g compared with(1.4050 ± 0.2088)g in the control group(P > 0.05). CM-DiI positive cells could be seen at tumor tissue of the experimental group with fluorescent microscope. Conclusion MSC could home to colon cancer tissue and had no effect on the growth of cancer.
Mesenchymal stem cell,bone marrow; colonic neoplasms; biological markers; cell labelling; nude mice
2015-01-02)
(本文编辑:陈媛媛)
10.3877/cma.j.issn.2095-1221.2014.04.010
福建省自然基金(J01406);南京军区“十二五”面上课题(MS121)
350025 福州,南京军区福州总医院普通外科
涂小煌,Email: fzptwktxhuang@sina.cn
