人脐血干细胞对兔后肢动脉球囊损伤后内膜增殖和内皮功能的影响
2015-10-27王富军杜亚萍丁海霞侯琳檀淼
王富军 杜亚萍 丁海霞 侯琳 檀淼
人脐血干细胞对兔后肢动脉球囊损伤后内膜增殖和内皮功能的影响
王富军 杜亚萍 丁海霞 侯琳 檀淼
目的 探讨人脐血干细胞(HUCBSC)移植对兔后肢动脉球囊损伤后动脉局部内膜增殖和内皮功能的影响。方法 新西兰大白兔24只,随机分为正常对照组(A组,8只)、球囊损伤组(B组,8只)及球囊损伤加干细胞移植组(C组,8只)。三组均于全麻下分离兔右侧股动脉;B、C两组均应用3 mm × 40 mm球囊扩张股动脉,每次3 min,共3次,并牵拉球囊,形成局部内膜损伤;C组球囊扩张后,以2.5 × 105的HUCBSC数移植到损伤血管局部,A、B组注入等量的磷酸盐缓冲液(PBS)。术前和术后28 d采用放射免疫法和酶联免疫吸附试验(ELISA)分别测定血浆内皮素-1(ET-1)及血清一氧化氮(NO)水平,并取股动脉采用苏木素-伊红染色(H-E)测定血管内膜面积及内膜面积与中膜面积比值。采用方差分析和配对t检验进行统计分析。结果 术后28 d,B组和C组均可见损伤血管内弹力膜多处断裂,有不同程度的内膜增生,C组内膜面积[(0.231 ± 0.033)mm2]及内膜面积与中膜面积比值(0.967 ± 0.193)明显低于B组[(0.589 ± 0.038)mm2,2.365 ± 0.376;t = 19.632,P < 0.01,t = 9.405,P < 0.01],但明显高于A组(正常对照组)。术后28 d,A、B、C三组静脉血浆ET-1水平分别为(79.91 ± 7.36)ng/L,(131.51 ± 12.88)ng/ L,(103.98 ± 11.13)ng/L,B组明显高于A组(t = 8.014,P < 0.01),C组也明显高于A组(t = 4.329,P < 0.01),但明显低于B组(t = 4.634,P < 0.01)。静脉血清NO水平分别为(120.33 ± 9.02) μmol/L,(48.01 ± 6.20)μmol/L,(102.76 ± 9.73)μmol/L,B组明显低于A组(t = 18.914,P < 0.01),C组也明显低于A组(t = 3.901,P < 0.01),但明显高于B组(t = 14.083,P < 0.01)。结论 HUCBSC血管局部移植可抑制兔后肢动脉球囊损伤后受损血管新生内膜的增殖,促进损伤血管内皮功能的恢复。
脐血干细胞移植; 血管内膜; 内皮
近年来,随着下肢动脉介入治疗的广泛开展,缺血性下肢血管病变患者的预后有了明显改观,但是,介入治疗引起的局部动脉内膜损伤和内皮功能障碍也成为介入治疗后再狭窄和影响其远期预后的主要原因[1]。很多研究已经表明,干细胞移植可促进血管新生,保护血管内皮功能[2-4]。脐血富含造血干细胞、间充质干细胞及内皮祖细胞,取材方便。本研究采用球囊扩张术造成兔后肢动脉内膜损伤模型,动脉损伤局部采用人脐血干细胞(human umbilical cord blood stem cell,HUCBSC)移植,观察其对动脉局部内膜增殖和内皮功能的影响,为介入治疗术后再狭窄的防治提供依据。
材料与方法
一、材料
1.试验动物与分组:新西兰健康雄性大白兔24只(河北医科大学动物实验中心提供),体重(2.2 ± 0.5)kg,分入正常对照组(A组,8只)、球囊损伤组(B组,8只)及球囊损伤加干细胞移植组(C组,8只)。
2.主要药品与试剂:淋巴细胞分离液由天津颢阳公司(密度为1.077 g/ml)提供,低糖DMEM培养液由GIBCO公司提供,磷酸盐缓冲液(phosphate buffered saline,PBS)由福建迈新生物有限公司提供。血浆内皮素(ET)-1放射免疫试剂盒由解放军总医院科技开发中心放射免疫研究所提供,酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)测定血清一氧化氮(NO)试剂盒由上海西唐生物科技有限公司提供。兔后肢动脉腔内扩张使用的球囊(3 mm × 40 mm)由美国美敦力公司提供(为临床下肢介入使用后废弃球囊,经清洗消毒后用于动物实验)。倒置荧光显微镜(日本Nikon公司),病理图像分析系统(德国Leica Qwin Plus公司)。
二、方法
1. HUCBSC混悬液的制备:脐血由河北医科大学第四医院产科提供,来源于足月分娩的健康产妇,艾滋病毒、乙肝、梅毒等检测均呈阴性,产妇及其家属对新生儿脐血可能用于科学研究均签署知情同意书,实验方案经医院医学伦理委员会批准。取新鲜脐血(6 h内用毕),用PBS液等倍稀释后置于50 ml离心管中,按1:1比例加入至人淋巴细胞分离液上,4℃,离心半径8 cm,2 000 r/min,离心20 min后,脐血分5层,中间白膜层即为单个核细胞。用移液器小心吸取富含单个核细胞的混悬液放入另一离心管内,4℃,离心半径8 cm,1 000 r/min,离心15 min,PBS 洗涤3次。用低糖DMEM培养液悬浮,计数细胞浓度为5 × 105/ml。HUCBSC混悬液制备成功[5]。
2.兔右后肢股动脉球囊损伤模型的制备:新西兰健康雄性大白兔24只,适应喂养1周后,3组动物均于无菌条件下行右侧股动脉球囊扩张术,以3%戊巴比妥1 ml/kg静脉注射麻醉,手术开始即给予肝素(200 U/kg)经耳缘静脉注射抗凝,自右侧腹股沟韧带至膝关节上下做一纵行切口,行股动脉及其分支分离术,分离股动脉及分支,并将其分支均自分叉处结扎。于股动脉近心端进行穿刺,B、C两组穿刺后送入3 mm × 40 mm球囊至股动脉,12个大气压充盈球囊后,持续3 min,间歇1 min后重复,共3次,并牵拉球囊,制成兔右后肢股动脉球囊损伤模型。A组仅行右后肢股动脉分离及穿刺,术后缝合穿刺点。
3.HUCBSC移植:B、C两组兔右后肢股动脉球囊损伤模型制成后,恢复血流3 min。3组均用血管夹夹闭已分离股动脉远端,C组用1 ml注射器于股动脉夹闭处近端注入已制备好的HUCBSC混悬液约0.5 ml,A、B组注射等量的PBS。注射完毕,3组均用血管夹夹闭分离的股动脉近端,30 min后,将股动脉近端和远端的血管夹全部去除,恢复股动脉血流。术后缝合伤口,应用肝素(200 U/kg·d)经耳缘静脉注射抗凝3 d。
4.损伤血管病理学观察:HUCBSC移植后28d,A、B、C三组动物(兔)再次分离右后肢股动脉并留取后处死动物,以4%多聚甲醛固定、石蜡包埋后进行横断面切片,切片厚度为5 μm,常规HE染色。采集图像后经计算机病理图像分析系统测定新生内膜面积(内膜面积)、中膜面积及内膜面积与中膜面积比值。
5.血浆ET-1及血清NO水平的测定:HUCBSC移植前及移植后28 d分别采集外周血,根据试剂盒说明书,采用放射免疫法和ELISA分别测定血浆ET-1及血清NO水平。
三、统计学分析方法
应用SPSS14.0统计学软件分析,3组干预后28 d股动脉内膜、中膜面积及内膜与中膜面积比值,3组干预前后血浆ET-1和血清NO水平以±s表示,3组间比较采用方差分析(F检验),组内差异采取t检验两两比较,自身治疗前后采取配对t检验比较。以P < 0.05为差异有统计学意义。
结 果
一、股动脉内膜面积、中膜面积及内膜面积与中膜面积比值的变化
术后28 d,A组动物股动脉内膜完整,弹力膜连续,无断裂。B组动物股动脉内膜连续性中断,明显内膜增生,弹力膜多处断裂。C组动物股动脉有轻度内膜中断和增生,弹力膜轻度断裂(图1)。C组内膜面积、内膜面积与中膜面积比值均显著小于B组(均P < 0.05,表1)。
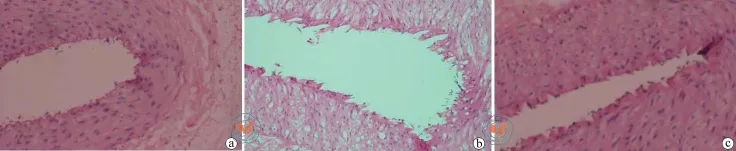
图1 术后28 d各组动物股动脉内膜情况(HE染色×100)
二、血浆ET-1及血清NO水平测定
血浆ET-1水平B、C两组术后28 d较术前明显升高(均P < 0.05),且明显高于同期A组水平(均P < 0.05);C组术后血浆ET-1水平明显低于同期B组(P < 0.05)。血清NO水平:B、C两组术后28 d较术前明显降低(均P < 0.05),且明显低于同期A组水平(均P < 0.05);C组术后血清NO水平明显高于同期B组(P < 0.05,表2)。
表1 三组干预后28 d股动脉内膜、中膜面积及内膜与中膜面积比值比较(±s)
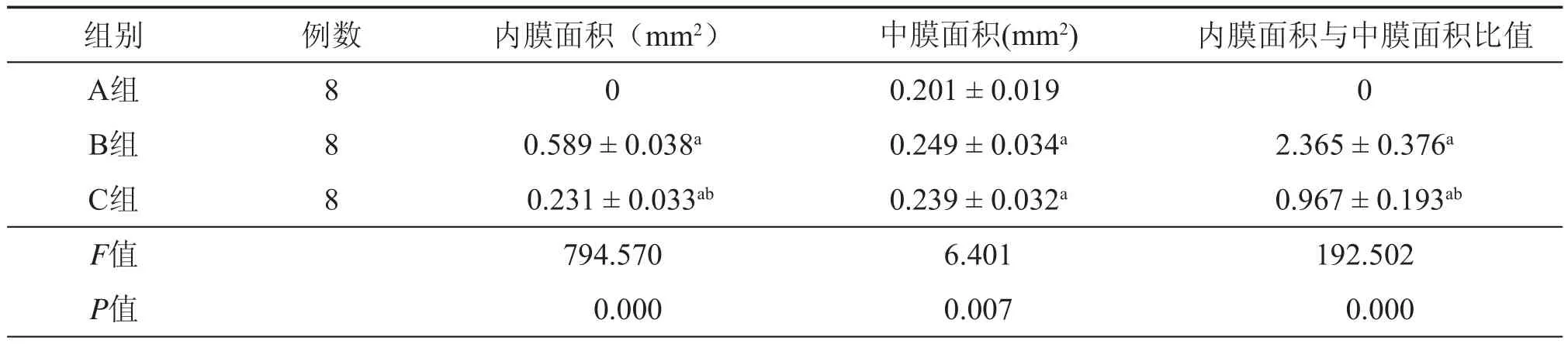
表1 三组干预后28 d股动脉内膜、中膜面积及内膜与中膜面积比值比较(±s)
注:与A组比较aP < 0.05;与B组比较bP < 0.05
组别例数内膜面积(mm2) 中膜面积(mm2)内膜面积与中膜面积比值A组800.201 ± 0.0190 B组80.589 ± 0.038a 0.249 ± 0.034a2.365 ± 0.376aC组8 0.231 ± 0.033ab 0.239 ± 0.032a0.967 ± 0.193abF值794.570 6.401 192.502 P值 0.000 0.007 0.000
表2 三组干预前后血浆ET-1和血清NO水平的变化(±s)
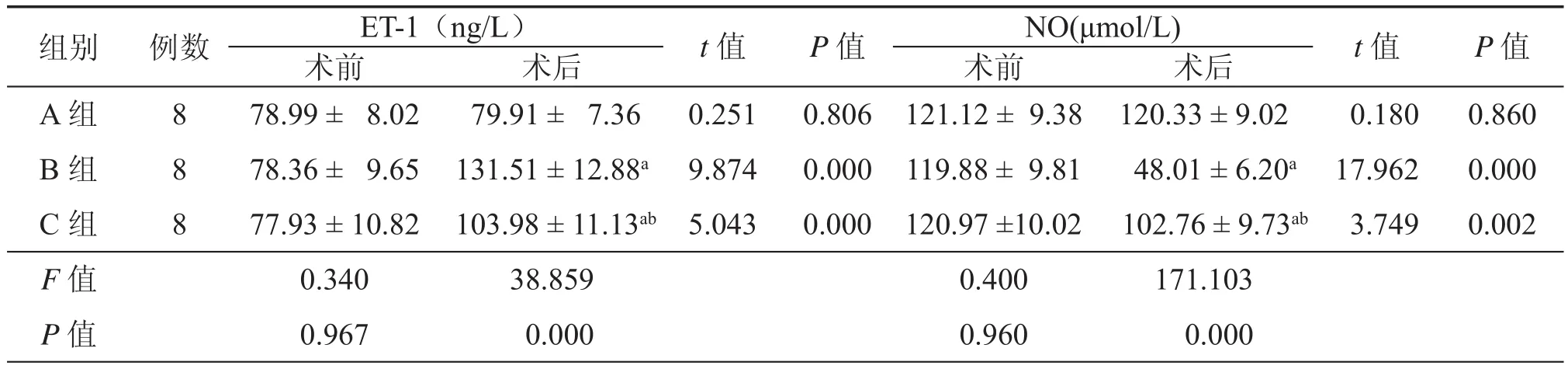
表2 三组干预前后血浆ET-1和血清NO水平的变化(±s)
注:与A组比较aP < 0.05;与B组比较bP < 0.05
组别例数 ET-1(ng/L)t 值P 值NO(μmol/L)t 值P 值术前术后术前术后A 组878.99 ± 8.02 79.91 ± 7.360.2510.806121.12 ± 9.38120.33 ± 9.02 0.1800.860 B 组878.36 ± 9.65131.51 ± 12.88a9.8740.000119.88 ± 9.81 48.01 ± 6.20a17.9620.000 C 组877.93 ± 10.82 103.98 ± 11.13ab5.0430.000120.97 ±10.02 102.76 ± 9.73ab 3.7490.002 F 值0.34038.8590.400171.103 P 值0.967 0.0000.960 0.000
讨 论
缺血性下肢血管病变主要有糖尿病足、下肢动脉硬化闭塞症和血栓闭塞性脉管炎等,其中糖尿病足是患者致残、致死的最主要原因之一,常规药物治疗收效甚微。介入治疗因创伤小、成功率高、疗效确切且简便易行已成为目前治疗下肢缺血的主要手段。但介入后再狭窄严重影响其远期疗效。干细胞移植进行血管再生治疗是介入治疗的良好补充,尤其对部分以微循环障碍为主或者是远端流出道较差的患者,也成为目前治疗糖尿病下肢远端缺血的重要手段。干细胞主要来源于骨髓、外周血及脐血等。HUCBSC资源丰富,较原始,抗原性弱,且免疫排斥反应低,成为异体干细胞移植的首选。随着干细胞基础研究和临床应用的进展,干细胞移植改善糖尿病下肢缺血患者的患肢血流,已有很多研究[2,6]。但介入治疗中局部应用干细胞移植有无内皮保护作用,即有无促进介入治疗所致内膜损伤的修复,抑制炎症反应,防止介入治疗后血管再狭窄等作用却鲜见报道。
本组将人HUCBSC提取后即刻(6 h内)移植到兔后肢球囊损伤动脉段,并阻断血流造成缺血缺氧环境,使其充分归巢。结果显示,干细胞移植组兔股动脉内膜修复明显增快,内膜面积、内膜面积与中膜面积比值均显著小于单纯球囊扩张组,表明HUCBSC移植促进了损伤血管内膜的早期再内皮化,明显促进内膜的修复,并可抑制内膜的过度增殖。
ET-1与NO是一对重要的内皮源性血管活性因子,均由内皮细胞合成和分泌。ET-1可引起血管收缩,促进血管内膜增殖,下调ET-1的表达可改善血管内皮功能及抑制内膜增生[7]。NO可使血管舒张,抑制血小板聚集和血管内膜增殖。研究发现,球囊损伤内皮细胞后,NO合酶的合成和分泌减少,血管新生内膜增生,将内皮祖细胞移植可明显抑制大鼠损伤颈动脉内膜增生,血管舒张功能明显改善[8]。本研究结果显示,实验干预28 d后,与正常对照组比较,球囊损伤组的血浆ET-1水平显著升高,血清NO水平显著降低,球囊损伤组的血管新生内膜面积显著增加,表明球囊损伤血管内皮严重影响ET-1和NO的正常合成和分泌,引起内膜增殖;而HUCBSC移植组血浆ET-1水平显著低于球囊损伤组,血清NO水平显著高于球囊损伤组,从而促进损伤血管内皮的修复,改善损伤血管的内皮功能。但其远期疗效如何,有无预防术后再狭窄的作用,有待于进一步研究探讨。
1 王富军, 刘月芹, 齐会卿, 等. 2型糖尿病下肢动脉病变介入治疗对缺血动脉内血管性血友病因子、纤维蛋白原的影响及其意义[J]. 临床荟萃, 2013, 28(2):158-161.
2 Finney MR, Fanning LR, Joseph ME, et al. Umbilical cord blood-selected CD133(+) cells exhibit vasculogenic functionality in vitro and in vivo[J]. Cytotherapy, 2010,12(1):67-78.
3 王富军, 杜亚萍, 杨艳辉, 等. 自体外周血干细胞移植糖尿病足36例血管内皮功能检测[J]. 中国组织工程研究与临床康复, 2009, 13(23):4589-4592.
4 Hirata Y, Sata M, Motomura N, et al. Human umbilical cord blood cells improve cardiac function after myocardial infarction[J]. Biochem Biophys Res Commun, 2005,327(2):609-614.
5 张弛, 肖日军, 张娜, 等. 脐血干细胞移植治疗糖尿病大鼠下肢缺血的实验研究[J/CD]. 中华损伤与修复杂志:电子版, 2012, 7(1):18-23.
6 王富军, 杜亚萍, 杨艳辉, 等. 自体外周血干细胞移植治疗糖尿病足11例临床研究[J]. 临床荟萃, 2007,22(23):1729-1730.
7 Wegiel B, Gallo DJ, Raman KG, et al. Nitric oxidedependent bone marrow progenitor mobilization by carbon monoxide enhances endothelial repair after vascular injury[J]. Circulation, 2010, 121(4):537-548.
8 Cui B, Huang L, Fang Y, et al. Transplantation of endothelial progenitor cells overexpressing endothelial nitric oxide synthase enhances inhibition of neointimal hyperplasia and restores endothelium-dependent vasodilatation[J]. Microvasc Res, 2011, 81(1):143-150.
Effects of human umbilical cord blood stem cell transplantation on arterial intima proliferation and endothelial function in the rabbit hindlimb artery after balloon injury
Wang Fujun, Du Yaping, Ding Haixia, Hou Lin, Tan Miao. Department of Endocrinology, the Fourth Hospital of Hebei Medical University, Shijiazhuang 050011, China
Wang Fujun, Email:wangfujun139@126.com
Objective To explore the effects of human umbilical cord blood stem cell transplantation on arterial intima proliferation and endothelial function in rabbit hindlimb artery after balloon injury. Methods 24 New Zealand white rabbits were divided into the normal control group (Group A, 8 rabbits), the balloon injury group (Group B, 8 rabbits) and the balloon injury combined with stem cells transplantation group (Group C, 8 rabbits). The rabbit's femoral artery was mobilized under general anesthesia. The femoral arteries were expanded using 3 mm × 40 mm balloon 3 times, 3 minutes each time, in Groups B and C tocause intima injury. In Group C, 2.5 × 105HUCBSCs were transplanted into injured artery. Rabbits in Groups A and B reveived phosphate buffer solution (PBS). The plasma endothelin-1(ET-1) and serum nitric oxide (NO) levels were measured by radioimmunoassay and enzymelinked immunosorbent assay (ELISA) respectively at days 0 and 28. The vascular intimal area and the ratio of intima to media area of femoral artery were measured using hematoxylin eosin staining (H-E) assay. Analysis of variance and paired t test were used for statistical analysis. Results 28 days after intervention, arterial elastic membranes were ruptured at several points and intimas were hyperplastic in injured arteries of Groups B and group C. Intimal area [(0.231± 0.033)mm2] and the ratio(0.967 ± 0.193)of intima to media area in Group C were lower than those in Group B [(0.589 ± 0.038)mm2,2.365 ± 0.376;t = 19.632, P < 0.01,t = 9.405, P < 0.01], but significantly higher than those in Group A. 28 days after intervention, the venous plasma ET-1 levels were (79.91 ± 7.36)ng/L,(131.51 ± 12.88)ng/L,and (103.98 ± 11.13)ng/L in Groups A, B, and C respectively. Rabbits in Group B had significantly higher ET-1 levels than those in Group A (t = 8.014, P < 0.01). Rabbit in Group C had significantly higher ET-1 levels than those in Group A (t = 4.329,P < 0.01), but significantly lower ET-1levels than Group B (t = 4.634, P < 0.01). The serum NO levels were(120.33 ± 9.02)μmol/L,(48.01 ± 6.20)μmol/L, and (102.76 ± 9.73)μmol/L in Goups A, B,and C respectively. The difference was significant between Group B and Group A (t = 18.914,P < 0.01), Group C and Group A (t = 3.901, P < 0.01), Group C and Group B (t = 14.083, P < 0.01). Conclusion HUCBSCs transplantation can inhibit neointimal hyperplasia of rabbit hind limb artery after balloon injury and improve endothelial function.
Cord blood stem cell transplantation; tunica intima; endothelium
2014-08-31)
(本文编辑:陈媛媛)
10.3877/cma.j.issn.2095-1221.2015.02.004
050011 石家庄,河北医科大学第四医院内分泌科
王富军,Email: wangfujun139@126.com
