采用基因组测序技术进行胚胎种植前遗传学筛查的方法学研究及应用
2015-12-06程东凯翁宁许蓬孙晓玲杨凯王丹红许展于洪君邢丽贤房建凯李彩虹刘吉李宝山周娜
程东凯 翁宁 许蓬 孙晓玲 杨凯 王丹红 许展 于洪君 邢丽贤房建凯 李彩虹 刘吉 李宝山周娜
不孕症指有正常性生活,未经避孕一年未妊娠者。我国不孕症发病率7﹪~10﹪。2009《中国不孕不育现状调研报告》显示,全国不孕不育患者人数已超过5 000万[1]。试管婴儿技术能有效帮助不孕不育患者解决生育难题。试管婴儿技术是将卵子与精子取出后置于特定的培养液内培养、受精,受精卵在恒温孵箱中发育为胚胎后移植回母体子宫,最终发育成胎儿。试管婴儿技术作为有效的辅助生殖手段成为大多数不孕不育夫妇的重要选择。
挑选健康胚胎移植是成功妊娠的关键。而通过试管婴儿方法获得的胚胎有40﹪~60﹪存在染色体异常,且随着孕妇年龄越大,胚胎染色体异常的风险越高。染色体异常是导致妊娠失败和自然流产的主要原因。胚胎植入前遗传学筛查是指胚胎植入着床之前进行染色体数目和结构异常的检测,挑选正常的胚胎植入子宫,以获得正常的妊娠,提高患者的临床妊娠率[2-3]。
全基因组扩增(whole genome amplification,WGA)是最近出现的对全部基因组序列进行非选择性扩增的技术,其目的是在没有序列倾向性的前提下大幅度增加DNA的总量。从理论上讲,任何基因都能从WGA的产物中检测出来。通过一些方法分析这些WGA产物,可以得到全面的染色体信息。利用新一代测序技术(nextgeneration sequencing,NGS)有望能够快速、准确检测早期胚胎的染色体数目和结构异常,具有广阔的前景[4-5]。尤其是多重置换扩增(multiple displacement amplification,MDA)法的建立,基本解决了基因组扩增的偏向性。
本文的目的是建立一个采用WGA配合NGS技术进行胚胎植入前遗传学筛查(preimplantation genetic screening,PGS)的方法,并对建立的方法进行了初步临床验证。
材料与方法
一、材料
单细胞DNA提取和全基因组扩增采用德国Qiagen公司的REPLI-g单细胞试剂盒,其扩增原理为MDA。DNA扩增产物纯化采用美国Promega 公 司 的 Wizard®SV Gel和PCR Clean-Up试剂盒。文库构建采用美国Life Tech公司 的 ION XPRESS LIBRARY 试 剂 盒。DNA片段选择琼脂糖为美国Life Tech公司产品(E-Gel®SizeSelect™)。DNA 的磁珠纯化采用美 国 BeckMan 公 司 的 Agencourt®AMPure®XP beads。模板制备采用美国Life Tech公司的ION Template OT2 200 试剂盒。上机测序采用 Life Tech公司的 ION PGM SEQUENCING 200试剂盒。利用Bioanalyzer®analysis软件分析文库片段分布。使用 Ion Torrent测序方法,根据 Ion PGM_ 200 Sequencing Kit V2 only 进行测序操作。数据分析采用北京嘉宝仁和医疗科技有限公司研发的《E&S-MDA-胚胎染色体倍性分析系统》。
患者37岁,2010年1月至2012年5月自然妊娠 3次,均在妊娠45~50d无诱因下自然流产,其后未避孕,至今未孕。来院后子宫输卵管造影示双侧输卵管积水,2013年9月行腹腔镜下双侧输卵管结扎术。男方精液常规大致正常,夫妻双方要求行辅助生殖技术助孕,2013年10月行ICSI助孕。取卵当日签署“经阴道取卵术”,“卵胞浆内单精子显微注射”,“囊胚培养”“胚胎冷冻、解冻及移植”和“染色体数目异常的胚胎植入前遗传学筛查”等知情同意书。
采用长效长方案用药,Gn起始剂量为225 U。行阴道B超引导下经阴道卵泡刺破及取卵术。在100 mm Hg(1 mm Hg=0.133 kPa)负压下穿刺抽吸取卵26个。取出的卵冠丘复合体培养4 h后,放入 80 U/ml透明质酸酶中 20~30 s,配合细玻璃管吹打脱去颗粒细胞,以清楚分辨极体为准,26个卵母细胞中有24个为MII期,2个为GV期。行ICSI操作。次日观察共形成受精卵22个,第5天形成8个囊胚,第6天形成5个囊胚,其中8个为优质囊胚(评分在4BB以上)。在显微镜下对形成的8个优质囊胚行滋养层细胞采集术,每个囊胚各采集滋养层细胞5~10个,按冷冻顺序编号,用于进行PGS检测。
二、方法
1.滋养外胚层细胞活检:取发育至囊胚期的胚胎,在显微镜下取出3~5个细胞,放入含有有 1µl 磷酸缓冲液(PBS)的 PCR管底。
2.MDA全基因组扩增
(1)准备 Buffer D2:使用 Qiagen公司的REPLI-g single cell试剂盒。在超净工作台中操作,操作前紫外杀菌30min。取出试剂盒中的Buffer DLB管,离心使干粉聚集到管底,加500µl无核酸酶的水,震荡混匀,短暂离心(溶解后的Buffer DLB可在-20℃保存6个月)。按表1配制12个反应的 Buffer D2(-20℃可保存 3 个月);(2)细胞裂解:将胚胎细胞离心至管底,用PBS补体积至 4µl。加 3µl Buffer D2,手指轻轻拨动 PCR管混匀,瞬时离心。PCR仪上65℃孵育10min。取出,置冰中。加3µl反应终止液,手指轻轻拨动PCR管混匀,瞬时离心后置冰中;(3)配制扩增反应体系:冰上融化REPLI-g试剂盒中的DNA多聚酶,其余组分室温融化后震荡混匀,瞬时离心后放置冰上。按照表2配制反应体系。DNA多聚酶最后加入;(4)扩增反应:上述反应液混匀后取40µl加入到步骤(2)的 10µl DNA 体系中,混匀,瞬时离心。PCR仪上30℃孵育8h。最后65℃孵育3min使酶失活。

表1 Buffer D2配制(µl)

表2 PCR反应体系配制(µl)
3.MDA 产物纯化:采用 Wizard®SV Gel and PCR Clean-Up 纯化试剂盒。加入 50µl Membrane Binding Solution 于50µl MDA 产物中,混匀后转移至纯化柱内,室温放置 1min,12 000 r/min离心1min。加入 700µl Membrane Wash Solution,离心半径 8.5 cm,12 000 r/min离心 1min,弃上清。加入 500µl Wash Solution,离心半径 8.5 cm,12 000 r/min离心 1min,弃上清。离心半径 8.5 cm,12 000 r/min离心 2min 弃去多余液体,室温晾干(3min)。加50µl无核酸酶水至离心柱膜上,室温放置5min 后,离心半径 8.5 cm,12 000 r/min离心 1min,离心液即为纯化的DNA溶液。
4.纯化DNA检测:取1µl纯化的DNA稀释至 20µl,取 2µl用 Qubit方法测浓度。采用嘉宝仁和公司的MDA产物质量检测试剂盒和表3的PCR反应体系对MDA产物质量进行检测。PCR程序为:95℃孵育5min;然后95℃变性30 s;60℃退火 30 s;72℃延申 30 s。一共 40 循环。最后72℃延伸10min。3﹪的琼脂糖凝胶电泳检测结果。
5.文库构建:采用 Life Tech公司的 ION XPRESS LIBRARY试剂盒构建测序文库,步骤如下:(1)DNA酶切打断:取DNA(100 ng)加入到PCR管中,体系补水至35µl。震荡混匀。震荡混匀Ion Shear™Plus 10×Reaction Buffer 和Enzyme Mix Ⅱ,瞬时离心后放置冰上。加5µl10×Reaction Buffer于PCR管中,吹吸10次混匀。加 10µl Enzyme MIX Ⅱ,吹吸混匀。PCR仪上37℃孵育35min。孵育后立即加入5µl终止缓冲液,震荡混匀,瞬时离心后置于冰上;(2)纯化:加 99µl平衡到室温且充分混匀 的 Agencourt®AMPure®XP Reagent(1.8 倍 样本体积)吹吸约10次,震荡混匀,离心2 s,室温孵育 5min。磁吸3~4min,弃上清。加 500µl新鲜配制70﹪乙醇清洗,磁力架上旋转2周(约30 s),弃上清。重复一次清洗后室温稍晾干沉淀(约 2~3min),加 25µl low TE 洗脱,震荡混匀 5 s,离心 2 s,磁吸3min,吸25µl上清至新的PCR管中;(3)连接头连接反应:按照表4配备反应体系。配好体系后吹吸混匀,放入PCR仪,反应程序如下:25℃ 15min,72℃ 5min。将全部反应液转移到一个1.5ml离心管中,用于纯化;(4)纯化:加 180µl平衡到室温且充分混匀 的 Agencourt®AMPure®XP Reagent(1.8 倍 样本体积),吹吸10次。室温孵育 5min,磁吸3~4min,弃上清。加 500µl 新鲜配制 70﹪ 乙醇清洗,磁力架上旋转2周(约30 s),弃上清。重复一次清洗后室温稍晾干沉淀(约 2~3min),加 20µl low TE 洗脱,震荡混匀 5 s,离心 2 s,磁吸3min,吸20µl上清至新的 PCR管中;(5)片段选择:使用 E-Gel®SizeSelect™ 2﹪ 琼脂糖凝胶。样本上样量为 20µl。Marker上样量为 10µl。电泳进行至 13~14min 时,Marker的 200 bp 条带在收集孔中,250 bp条带在孔的上边缘,此时收集液体,再用10µl水洗收集孔,两次加一起共约25µl。文库插入片段应在 100~110 bp;(6)PCR 扩增:室温解冻 PCR Reaction mix 和Primer mix,轻轻震荡混匀,瞬时离心。按照表5进行PCR反应。反应程序:95℃变性5min。然后95℃变性15 s,58℃退火 15 s,70℃延伸 1min,一共 8 个循环;(7)纯化:加 195µl平衡到室温且充分混匀的Agencourt®AMPure®XP Reagent(1.5 倍 样 本 体积),吹吸10次,震荡混匀,离心 2 s,室温孵育 5min。磁吸3~4min,弃上清。加 500µl新鲜配制70﹪乙醇清洗,磁力架上旋转 2周(约30 s),弃上清。重复1次清洗。室温稍晾干沉淀(约2~3min)。加20µl low TE洗脱,震荡混匀后离心2 s,磁吸3min,吸20µl上清至新的 1.5ml离心管中。加 30µl Agencourt®AMPure®XP Reagent,吹吸10次,震荡混匀后离心 2 s,室温孵育 5min。磁吸3~4min,弃上清。加 500µl新鲜配制 70﹪乙醇,磁力架上旋转2周,弃上清。重复以上步骤1次。最后吸尽上清,室温晾干(磁珠量很少,吸尽上清后已经干燥可直接进行以下洗脱)。加20µl low TE,震荡混匀,离心 2 s,磁吸3min,吸20µl上清至新的 1.5ml离心管中。Qubit方法检测文库浓度。

表3 MDA产物质量检测PCR体系(µl)
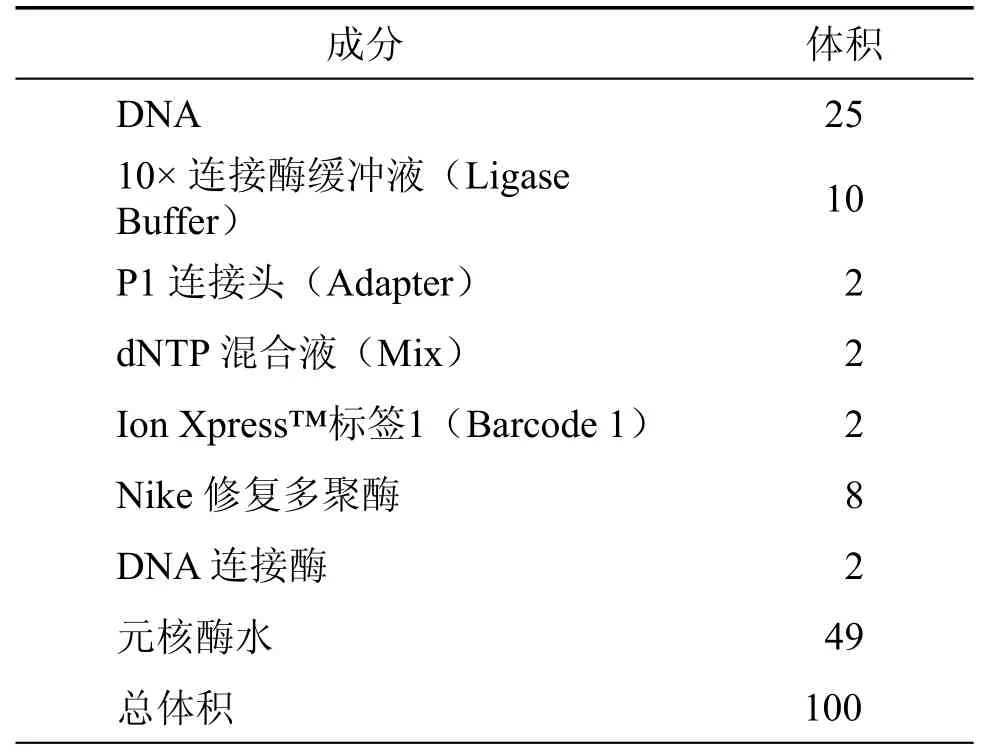
表4 连接头反应体系(µl)

表5 PCR反应体系(µl)
6.乳液PCR反应(One Touch):根据 Qubit检测的文库DNA浓度,稀释文库DNA至 2.5 pg/µl,用于OneTouch反应。使用Ion PGMTMTemplate OT2 200 Kit试剂盒对文库DNA进行扩增,运行5.5h。
7.PGM(ION PGM SEQUENCING 200 KIT V2):程序设定中测序Flow数量选择260Flows,参考基因组选择hg19。Ion xpress选择barcode1,318 芯片测序,运行 2.5 h。
(三)数据分析
登录Torrent Server,下载BAM格式的测序数据,使用《E&S-MDA-胚胎染色体异倍性分析系统》(以下简称E&S系统)分析数据。
E&S系统以正常样本为标准判定染色体拷贝数,在大于10 Mb染色体区域范围内,高于标准1.25倍,则认为该区域重复,低于标准0.75倍,则认为该区域缺失[7]。
结 果
一、PGS方法的建立
使用3﹪的琼脂糖凝胶电泳检测MDA扩增 DNA 产物,上样量为 10µl DNA 产物加 2µl的 6× 上样缓冲液。120 v电压下电泳 30min(图1)。MDA产物检测5条带,证明该MDA产物质控结果合格,可以进行文库构建。Qubit检测文库浓度为0.128 ng/µl。测序数据结果如表6。使用E&S系统分析测序数据结果如图2所示,显示为正常样本。
二、临床验证
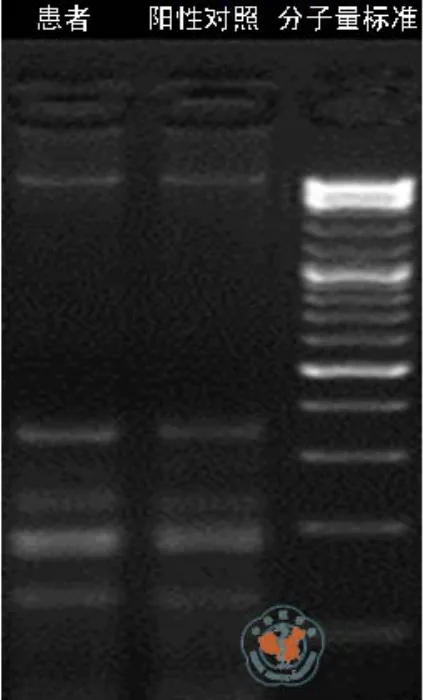
图1 MDA扩增后DNA电泳图
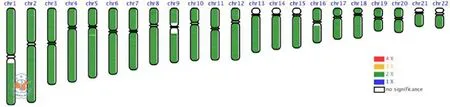
图2 E&S系统数据分析结果,以颜色表示各染色体拷贝数,绿色表示正常二倍体,黄色表示三倍体,蓝色表示单倍体。图中所示样本22条常染色体正常

表6 测序数据量
2014年10月25日对该名患者6枚胚胎滋养层细胞组织行PGS操作,结果显示2枚胚胎正常,4枚异常。2014年1月14日患者再次来诊行囊胚移植,将一枚染色体正常的4AA囊胚复苏并移植,之后常规黄体支持治疗。于移植术后15 d,尿及血检查HCG提示生化妊娠,于胚胎移植后35 d B超检查发现宫内1个妊娠囊,其内可见胎芽及胎心。妊娠16周行无创产前筛查结果正常。于2014年9月27日行剖宫产分娩一男活婴,体格发育正常,体重 3 300 g。
讨 论
PGS是辅助生殖技术与遗传学分析技术相结合的一种植入前诊断技术,广泛应用于胚胎染色体数目异常(非整倍体)的筛查。PGS主要用于无已知遗传学异常,但存在高度胚胎非整倍体风险的夫妇[8],以提高体外受精-胚胎移植(in vitro fertilization-embryo transfer,IVF-ET)的着床率和活产率,降低流产率[9]。目前主要使用PGS的患者是高龄女性,还有复发性流产和胚胎反复种植失败的患者[10]。
随着技术的进步,传统的荧光原位杂交技术(FISH)和目前采用的芯片技术对染色体异常诊断的覆盖率、分辨率、诊断时间和准确度受到不断考验[11]。DNA测序技术在生物技术领域有着广泛的应用,Life tech 公司的 Ion torrent半导体测序技术采用检测氢离子的原理,实现了边合成边测序,具有速度快、准确度高和成本低的特点,为基于单细胞水平的PGS检测开辟了新天地,为进行全面的染色体筛查提供了可能[12-13]。我中心于2013年10月对一例患者行囊胚滋养层细胞活检,并进行全基因组低深度测序,后选择染色体正常的胚胎移植回患者体内,获得临床妊娠并成功分娩。在卵裂期进行胚胎活检,理论上可能会降低胚胎生长速率,与活检卵裂期胚胎单个卵裂球进行全基因组测序相比,囊胚期活检只取将要发育为胎盘的滋养外胚层细胞,内胚层细胞(发育形成胎儿)不受影响。目前研究认为囊胚期活检和全部染色体非整倍体筛查联合应用可提高IVF妊娠结局,是最佳的PGS策略,但仍需要大规模随机临床对照试验验证PGS疗效和远期影响。
1 樊亚丽,张文秀.不孕症治疗的研究进展[J].中国优生优育 ,2013,19(9): 737-739.
2 Wilton L.Preimplantation genetic diagnosis for aneuploidy screening in early human embryos: a review[J].Prenat Diagn,2002,22(6):512-518.
3 Sullivan EA,Wang YA,Hayward I,et al.Single embryo transfer reduces the risk of perinatal mortality,a population study[J].Hum Reprod,2012,27(12):3609-3615.
4 Vendrell X,Bautista-Llácer R.A methodological overview on molecular preimplantation genetic diagnosis and screening: a genomic future?[J].Syst Biol Reprod Med,2012,58(6):289-300.
5 Fiorentino F,Bono S,Biricik A,et al.Application of nextgeneration sequencing technology for comprehensive aneuploidy screening of blastocysts in clinical preimplantation genetic screening cycles[J].Hum Reprod,2014,29(12):2802-2813.
6 Ross MG,Russ C,Costello M,et al.Characterizing and measuring bias in sequence data[J].Genome Biol,2013,14(5):R51.
7 Wells D,Kaur K,Grifo J,et al.Clinical utilisation of a rapid low-pass whole genome sequencing technique for the diagnosis of aneuploidy in human embryos prior to implantation[J].J Med Genet,2014,51(8):553-562.
8 Ly KD,Agarwal A,Nagy ZP.Preimplantation genetic screening: does it help or hinder IVF treatment and what is the role of the embryo? [J].J Assist Reprod Genet,2011,28(9):833-849.
9 Martín J,Cervero A,Mir P,et al.The impact of nextgeneration sequencing technology on preimplantation genetic diagnosis and screening[J].Fertil Steril,2013,99(4):1054-1061.
10 Wang L,Wang X,Zhang J,et al.Detection of chromosomal aneuploidy in human preimplantation embryos by next generation sequencing[J].Biol Reprod,2014,90(5):95.
11 Mastenbroek S,Twisk M,van der Veen F,et al.Preimplantation genetic screening: a systematic review and meta-analysis of RCTs[J].Hum Reprod Update,2011,17(4):454-466.
12 Treff NR,Forman EJ,Scott RT Jr.Next-generation sequencing for preimplantation genetic diagnosis[J].Fertil Steril,2013,99(6):e17-18.
13 Jan TS,Georgia K,Christina V,et al.Looking to the future: developments in preimplantation genetic diagnosis[J].Obstet Gynecol,2012,7(4):293-295.
