电解池与原电池试题题型浅探
2015-10-27姜富灵
姜富灵
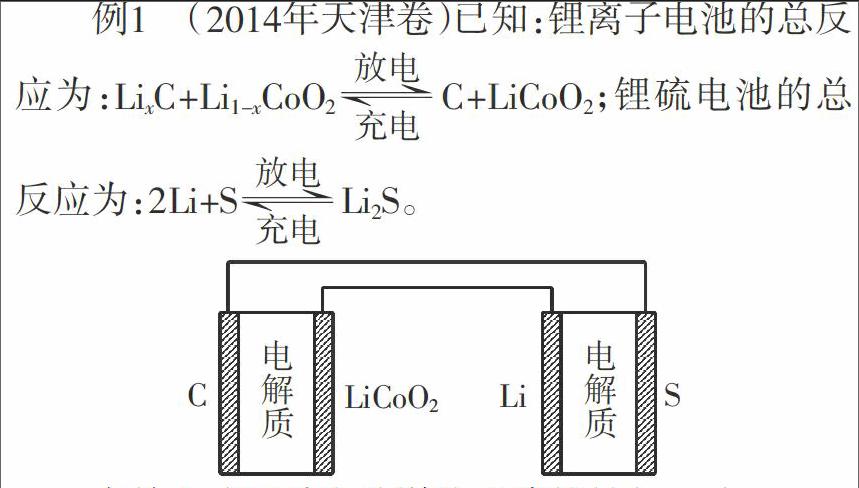

电解池与原电池知识点的试题是各地高考试卷的重要组成部分,常以图文并茂或纯文字叙述的形式出题,试题题型多为选择或填空。从平时教学及答卷情况看,半数学生对此类问题解答困难,失分相对较多,因此,本文就此类问题的高考试题题型谈一点自己的看法。
一、考查电极种类和电极产物的判断
电极种类和电极产物的判断是近年的常考题,也是电化学中的基础题,在做题时需要我们细心、认真分析所给电池和选项。电极种类的判断比较容易,其基本依据是:失电子发生氧化反应的为阳极(负极),得电子发生还原反应的为阴极(正极)。判断电极的产物时,我们要掌握所给的阳离子得电子的难易程度和阴离子失电子的难易程度。以此为出发点逐步分析所给问题,问题便会迎刃而解。
有关上述两种电池说法正确的是( )。
A.锂离子电池放电时,Li+向负极迁移
B.锂硫电池充电时,锂电极发生还原反应
C.理论上两种电池的比能量相同
D.上图表示用锂离子电池给锂硫电池充电
解析:锂离子电池放电时,Li+向正极迁移,即A项错误;锂硫电池充电时,锂电极中Li+得电子还原为Li,即B项正确;根据所给两种电池的总反应式,可知两种反应中的元素的变价不同,因此两种电池的比能量不同,即C项错误;在给电池充电时,要正极接正极,负极接负极,所以应该Li极连接C极、S极连接LiCoO2极,即D项错误。
答案:B
二、考查根据氧化还原反应书写电极反应式
根据氧化还原反应书写电极反应式是每年高考的必考题,在解题时我们首先要分析所给化学反应方程式中元素化合价的变化情况,找出氧化反应(负极或阳极)和还原反应(正极或阴极),然后结合电解质溶液确定电极反应式。对于比较复杂或陌生的化学方程式,我们可以用总反应减去一个电极反应式,从而得出另一个电极反应式。
例2 (2013年安徽理综卷)热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如右图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。
下列有关说法正确的是( )。
A.正极反应式:Ca+2Cl--2e-=CaCl2
B.放电过程中,Li+向负极移动
C.每转移0.1mol电子,理论上生成20.7gPb
D.常温时,在正负极间接上电流表或检流计,指针不偏转
解析:由电池总反应式可知,Ca发生氧化反应,为原电池的负极,电极反应式为Ca+2Cl--2e-=CaCl2,发生还原反应的为原电池的正极,电极反应式为PbSO4+2e-+2Li+=Li2SO4+Pb,即A项错误;在原电池中,阴离子向负极迁移,阳离子向正极迁移,即B项错误;根据正极的电极反应式可知,每转移0.1mol电子,理论上生成0.05molPb,合10.35g,即C项错误;常温下,电解质为固态,离子不能移动,不能产生电流,因此在正负极间接上电流表或检流计,指针不偏转,即D项正确。
答案:D
三、综合考查
在近几年的高考中,对知识点的考查越来越趋向综合性,这类题也往往是试卷中的把关题和压轴题。具有丰富的学科知识、多样的解题方法和超强的综合分析能力,是考生解答这类题的关键。
例3 (2014年新课标Ⅰ卷摘编)次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式:_________。
(2)H3PO2的工业制法是:将白磷(P4)与氢氧化钡溶液反应生成PH3气体和Ba(H2PO2)2,后者再与硫酸反应,写出白磷与氢氧化钡溶液反应的化学方程式:_________。
解析:(1)由于H3PO2是一元强酸,可以完全电离,其电离方程式为H3PO2=H2PO-2+H+。(2)由题意、电子守恒和原子守恒,可得白磷与氢氧化钡溶液反应的化学方程式为:2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3↑。
答案:(1)H3PO2=H2PO-2+H+ (2)2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3↑
(作者单位:西安电子科技大学附中)
