EM L4-A LK融合基因在肺癌转移灶中的表达及临床特点
2015-10-26韦丽丽于忠和
韦丽丽 于忠和
北京军区总医院肿瘤科,北京100700
EM L4-A LK融合基因在肺癌转移灶中的表达及临床特点
韦丽丽于忠和▲
北京军区总医院肿瘤科,北京100700
目的探讨肺癌患者转移灶中棘皮动物微管相关蛋白样4-间变性淋巴瘤激酶(EML4-ALK)的阳性表达率及其与临床病理特征、血清指标的关系和使用靶向治疗后的效果。方法使用实时荧光定量PCR法(FQ-PCR)对71例肺癌转移灶中EML4-ALK融合基因进行检测,同时检测患者血清标志物癌胚抗原(CEA)、癌糖原(CA125)及血管内皮生长因子(VEGF)水平,分析EML4-ALK融合基因在转移灶中表达情况及与血清标志物水平的相关性。结果在淋巴结、脑、骨、体表软组织、肝、结肠和胸膜转移组织中检测到EML4-ALK融合基因阳性表达的组织有淋巴结、脑、骨和胸膜,总阳性表达率为7.04%。转移灶组织中EML4-ALK融合基因表达阳性率与病理类型、性别、年龄、吸烟状态、分化程度和分期因素无明显相关(P>0.05),但临床上仍以腺癌、不吸烟者人群较多见。血清CEA、CA125、VEGF水平在EML4-ALK融合基因阳性组和阴性组中差异无统计学意义(P>0.05)。接受克唑替尼治疗的肺癌患者6个月疾病控制率为66%。结论使用FQ-PCR技术检测肺癌转移灶中EML4-ALK融合基因是可行的,可以为腺癌、不吸烟这些优势人群提供靶向治疗策略。
EML4-ALK融合基因;实时荧光定量PCR反应;肺癌;转移
肺癌是我国乃至全球最常见的恶性肿瘤之一,目前肺癌患者生存期较短,其5年生存率不足15%[1]。肺癌极大地威胁了人类的健康安全。既往对肺癌的治疗主要依赖含铂双药的联合化疗,尽管如此,肺癌的生存期也不尽人意。近年来,随着肺癌分子分型的进展和多个肺癌驱动基因的发现,以及靶向药物的成功应用,肺癌患者的生活质量和生存期大大改善。棘皮动物微管相关蛋白样4-间变性淋巴瘤激酶(echinoderm microtubule associated protein like4-anaplastic lymphoma kinase,EML4-ALK)融合基因是继表皮生长因子受体(epidermal growth factor receptor,EGFR)基因后的又一肺癌驱动基因重大发现。从2007年发现EML4-ALK融合基因到2011年ALK抑制剂克唑替尼在美国上市,短短4年时间,使得肺癌靶向治疗再次上升到一个新台阶,这表明了肺癌分子靶向治疗出现了里程碑式的跨越。EML4-ALK融合基因最初是由Soda等[2]用反转录聚合酶链反应(reverse transcription polymerase chain reaction,RT-PCR)方法在1例肺腺癌患者手术标本中检测出来的。中国台湾学者对比了荧光原位杂交技术(fluorescence in situ hybridization,FISH)和免疫组织化学法(immunohistochemistry,IHC)这两种检测方法,发现RT-PCR技术可以检测到EML4-ALK融合基因的多种不同亚型以及ALK抑制剂对不同亚型者疗效反应[3]。临床上可见多数肺癌患者因出现淋巴结转移和远处转移而就诊。目前关于肺癌转移灶如淋巴结、脑、骨等组织中ALK融合基因表达情况如何,至今没有明确定论。因此,本研究主要使用FQ-PCR技术检测肺癌转移灶组织中EML4-ALK融合基因的表达情况及其与临床病理学特征、血清学指标之间的关系,从而指导临床靶向治疗。
1 资料与方法
1.1一般资料
选自2013年4月~2014年11月就诊北京军区总医院经细胞学或病理学明确诊断的肺癌患者新鲜组织或石蜡组织标本71例,男40例,女31例;腺癌54例,非腺癌17例(鳞癌13例,混合细胞癌1例,小细胞癌2例,大细胞癌1例);年龄26~84岁,中位年龄为57.9岁;吸烟29例,不吸烟42例;低分化32例,中高分化39例;转移灶中淋巴结组织40例,脑组织10例,骨组织10例,体表软组织8例,肝组织1例,结肠组织1例,胸膜组织1例。所有标本的采集及处理已征求了患者知情同意并获得医院伦理委员会批准实施。
1.2基因检测方法
1.2.1标本收集收集手术切除或活检的转移灶新鲜组织存放于中性10%福尔马林固定后立即送检及收集石蜡包埋组织(转移灶)尽快送检。
1.2.2提取RNA采用Roche公司High Pure FFPE RNA Mico Kit进行提取石蜡包埋组织中的RNA。用Invitrogen公司TRIZOL试剂盒提取新鲜组织中RNA。
1.2.3纯化RNA、测定RNA浓度脱蜡消化后的RNA含有蛋白质、无机盐等小分子杂质,需要在Wash bufferⅠ/ⅡSolution作用下反复纯化。然后用核酸测定仪Nanodrop测定RNA浓度,用RNase-free EB做空白对照。
1.2.4逆转录反应将待测RNA加入逆转录反应液和逆转录酶进行反应,42℃保温1 h,再95℃保温5 min后冰上冷却,得到cDNA用于PCR扩增。
1.2.5实时荧光定量PCR(Fluorescence quantitive polymerase chain reaction,FQ-PCR)反应严格按照人类EML4-ALK融合基因检测试剂盒荧光PCR法说明书(厦门艾德公司)进行分装、加样,然后设置程序:第一阶段(1个循环):95℃,5 min;第二阶段(15个循环):95℃,25 s;64℃,20 s;72℃,20s;第三阶段(31个循环):93℃,25 s;60℃,35 s;72℃;20 s。最后收集第三阶段60℃FAM信号,执行实时PCR。
1.2.6判定结果根据FAM信号扩增曲线和Ct值判定,若存在FAM信号扩增曲线并且Ct值<30,则样品EML4-ALK融合基因为阳性。若FAM信号无扩增曲线或者是Ct≥30,则EML4-ALK融合基因为阴性。
1.3疗效评价
依照RECIST实体瘤疗效评价标准进行判定:完全缓解(CR),部分缓解(PR),稳定(SD),进展(PD)。疾病控制率(DCR)包括CR+PR+SD。给予靶向药物治疗的患者每2个月复查一次影像学检查以评价疗效。
1.4血清学指标检测
所有患者均在空腹下抽取静脉血5 mL,分离血清。血清血管内皮生长因子(vascular endothelial growth factor,VEGF)采用北京建平生物科技有限公司的VEGF试剂盒,通过酶联免疫吸附法(ELISA)进行测定。血清癌胚抗原(carcinoembryonic,CEA)、癌糖原(carbohydrare antigen,CA125)采用罗氏公司的Roche Eleesys E601分析仪,采用全自动电化学发光免疫法检测。所有操作程序按说明书执行。参考值:CEA为0~4.6 ng/mL,CA125为0~35 U/mL,VEGF为6.25~142.2 pg/mL。
1.5统计学方法
采用SPSS 16.0统计学软件进行数据分析,计量资料数据用均数±标准差(x±s)表示,两组间比较采用t检验;计数资料用率表示,组间比较采用χ2检验,小样本数据用Fisher's Exact Test检验;以P<0.05为差异有统计学意义。
2 结果
2.1EML4-ALK融合基因在转移灶中的状态及其与临床病理特征的关系
肺癌转移灶组织中存在EML4-ALK融合基因阳性的组织有淋巴结、脑、骨和胸膜,总阳性率为7.04%(5/71),其在每种组织中的阳性表达率分别为2.5%、10.0%、20.0%和100.0%。因标本量偏少,统计学分析未发现转移灶中EML4-ALK融合基因与病理类型、性别、年龄、吸烟状态、分化程度、分期相关(P>0.05),但临床上仍以腺癌、不吸烟者人群较多见。见表1~2。2.2 EML4-ALK融合基因与血清学指标关系
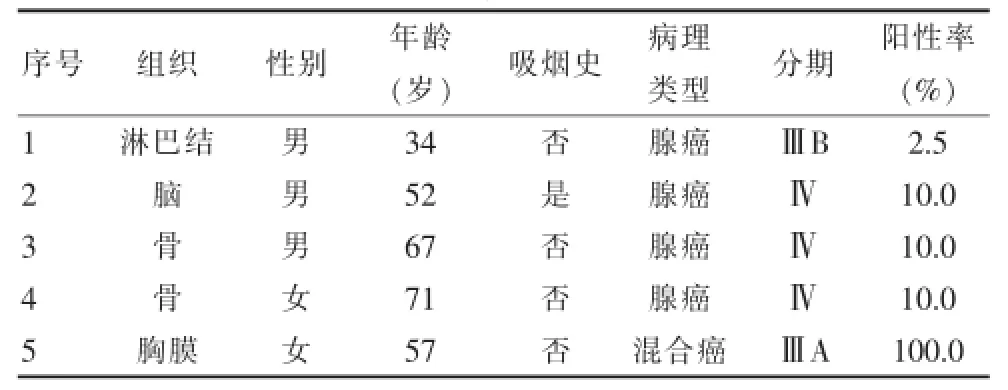
表1 5例EML4-ALK融合基因阳性患者临床病理特征

表2 转移灶中EML4-ALK融合基因表达状态与临床特征的关系
EML4-ALK融合基因阳性患者与阴性患者CEA、CA125、VEGF血清水平比较,差异无统计学无意义(P>0.05)。见表3。

表3 EML4-ALK融合基因状态与癌胚抗原、癌糖原125、血管内皮生长因子的关系(x±s)
2.3ALK抑制剂(克唑替尼)治疗EML4-ALK融合基因阳性患者的临床效果
研究的5例患者中3例服用了克唑替尼治疗,其中1例患者首先给予了培美曲塞二钠注射液(江苏豪森药业股份有限公司,批号141101)联合注射用卡铂(齐鲁制药有限公司,批号40800610A)方案一线化疗6个周期后出现了疾病进展,从而接受克唑替尼(美国辉瑞公司,批号13-110772)250 mg每日2次口服治疗,现已服用6个月,随访至2014年11月底未出现疾病进展。另1例脑转移患者给予克唑替尼250 mg每日2次口服治疗4个月后突发猝死而治疗中断。最后1例患者给予克唑替尼250 mg,每日2次,口服,9个月后出现疾病进展,改用培美曲塞联合卡铂全身化疗1个周期,因不能耐受化疗等相关副反应,遂停止治疗,2个月后患者死亡。3例接受克唑替尼治疗6个月疗效评价为稳定,疾病控制率为66%。
3 讨论
众所周知,肺癌发病率近些年增长迅速。关于最新的中国恶性肿瘤流行病谱研究报告指出,中国恶性肿瘤中每年肺癌新发及死亡病例分别为60万例和49万例,居恶性肿瘤之首位[4]。文献报道EML4-ALK融合基因作为驱动基因占非小细胞肺癌比例约为5%,相当于每年全球约有60 000例患者患病[5],故预测中国约每年有30 000例新发EML4-ALK阳性肺癌患者,占据了新发患者的一半。如何挑选出这一部分人群给予针对性的靶向治疗至关重要。
跟以往化疗不同,靶向治疗要求“先检测后用药”,只有明确检测出驱动基因,才能优化用药人群,从而改善生活质量,延长生存期。EML4-ALK融合基因的检测常用的方法有IHC、RT-PCR和FISH。三种方法各有优缺点,对于患者而言,不仅要确保检测方法的准确性和可靠性,还要充分考虑患者的经济因素,选择适合患者的检测手段是适应国情、人情的需要。本研究中选用FQ-PCR技术检测,在于其高度敏感,而且可用于检测EML4-ALK融合基因的亚型,并且经济适中。
本研究着重检测了肺癌转移灶中ALK融合基因表达情况及其与临床特征及血清学之间的关系。研究显示,在所检测的淋巴结、脑、骨、体表软组织、肝、结肠以及胸膜中,存在EML4-ALK融合基因阳性表达的组织有淋巴结、脑、骨和胸膜,其余组织未见表达,总的阳性率为7.04%。文献报道EML4-ALK阳性患者容易出现胸膜、心包或肝脏的转移[6]。本研究中有1例胸膜转移者出现了ALK融合基因阳性。但是由于本次标本量偏少,统计学分析还未发现不同转移灶中EML4-ALK融合基因与病理类型、性别、年龄等因素的相关性。钟山等[7]采用特异引物即时荧光PCR法研究了268例非小细胞肺癌患者手术标本EML4-ALK融合基因表达情况,结果显示,EML4-ALK融合基因阳性率为4.1%,在性别、年龄、吸烟状态及组织学分型之间差异无统计学意义(P>0.05)。最近一项关于EML4-ALK融合基因阳性表达非小细胞肺癌患者特征的荟萃分析[8]显示,EML4-ALK融合基因与不吸烟或很少吸烟、女性、腺癌高度相关。本研究与报道相似,临床上EML4-ALK融合基因阳性仍以腺癌、年轻、不吸烟者人群较多见。
与此同时,本研究还检测了患者的血清肿瘤标志物水平,选取了反映肺腺癌的主要指标CEA、CA125和目前已知最强的VEGF。三者的含量在EML4-ALK阳性组和阴性组水平分别为(15.48±2.00)μg/L、(34.20± 16.27)kU/L、(403.31±128.73)ng/L和(70.9±17.13)μg/L、(37.29±18.13)kU/L、(363.88±108.30)ng/L,均明显高于正常值。但是两组之间对比,三项指标差异无统计学无意义(P>0.05)。Fukui等[9]研究了720例肺腺癌患者EML4-ALK融合基因表达情况,发现EML4-ALK阳性组血清CEA水平要低于阴性组的水平(P= 0.04),正常CEA水平是EML4-ALK阳性表达患者的特征之一,与本研究结果不一致。考虑与本研究样本量较少以及研究人群个体差异有关。至于血清肿瘤标志物水平与ALK融合基因表达情况的关系还需大样本资料验证。
ALK抑制剂克唑替尼的最新临床试验[10]结果表明,靶向治疗要优于化疗,其中位无疾病进展时间分别为10.4个月和7.0个月,并且克唑替尼治疗组客观缓解率达到74%;在减轻肺癌症状及改善生活质量方面,克唑替尼也要优于化疗。基于克唑替尼良好的疗效和耐受性,美国食品和药物管理局、欧洲药品评价局和中国食品药品监督管理总局先后批准克唑替尼用于ALK阳性非小细胞肺癌患者的治疗[11]。本研究中有3例EML4-ALK融合基因阳性患者接受了克唑替尼250 mg,2次/d靶向治疗,6个月疗效评价为稳定,疾病控制率为66%。
综上所述,对于临床上可以行肺癌转移灶组织活检的患者,应该在明确病理诊断同时尽早做基因检测。肺癌分子诊断指南[12]也强调了对于肺腺癌患者应该接受EML4-ALK融合基因检测,并且适用于转移灶组织。因此,了解并掌握肺癌转移灶基因表达情况有利于肺癌患者准确、规范使用靶向药物。
[1]甄永生,蒙志宏,靳强,等.周围型肺癌CT表现及与血清肿瘤标志物CYFRA21-1的相关研究[J].河北医药,2014,36(22):3404-3406.
[2]Soda M,Choi YL,Enemoto M,et al.Identification of the transforming EML4-ALK fusion gene in non-small-cell lung cancer[J].Nature,2007,448:561-566.
[3]Wu YC,Chang IC,Wang CL,et al.Comparison of IHC,FISH and RT-PCR methods for detection of ALKrearrangements in 312 non-small cell lung cancer patients in Taiwan[J].PLoS One,2013,8:e70839.
[4]陈万青,张思维,曾红梅,等.中国2010年恶性肿瘤发病与死亡[J].中国肿瘤,2014,23(1):1-10.
[5]Shaw AT,Kim DW,Nakagawa K,et al.Crizotinib versus chemotherapy in advanced ALK-positive lung cancer[J].N Engl J Med,2013,368(25):2385-2394.
[6]Doebele RC,Lu X,Sumey C,et al.Oncogene status predicts patterns of metastatic spread in treatment-naive non-small cell lung cancer[J].Cancer,2012,118(18):4502-4511.
[7]钟山,张海萍,郑捷,等.非小细胞肺癌患者EML4-ALK融合基因检测及其与临床病理特征的关系[J].中华病理学杂志,2013,42(4):252-256.
[8]Wang Y,Wang S,Xu S,et al.Clinicopathologic features of patients with non-small cell lung cancer harboring the EML4-ALK fusion gene:a meta-analysis[J].PLoS One,2014,9(10):e110617.
[9]FukuiT,YatabeY,KobayashiY,etal.Clinicoradiologiccharacteristics of patients with lung adenocarcinoma harboring EML4-ALK fusion oncogene[J].Lung Cancer,2012,77(2):319-325.
[10]Solomon BJ,Mok T,Kim DW,et al.First-line crizotinib versus chemotherapy in ALK-positive lung cancer[J].N Engl J Med,2014,371(23):2167-2177.
[11]Wang J,Cai Y,Dong Y,et al.Clinical characteristics and outcomes of patients with primary lung adenocarcinoma harboring ALK rearrangements detected by FISH,IHC,and RT-PCR[J].PLoS One,2014,9(7):e101551.
[12]Lindeman NI,Cagle PT,Beasley MB,et al.Molecular Testing Guideline for Selection of Lung Cancer Patients for EGFR and ALK Tyrosine Kinase Inhibitors:Guideline from the College of American Pathologists,International Association for the Study of Lung Cancer,and Association for Molecular Pathology[J].J Thorac Oncology,2013,8(7):823-859.
Initially exploring the characteristics of EML4-ALK fusion gene mutation in the metastasis of lung cancer
WEI LiliYU Zhonghe▲
Department of Oncology,the Military General Hospital of Beijing,Beijing100700,China
Objective To evaluate the positive expression of the EML4-ALK fusion gene in the metastasis of lung cancer,research the association between EML4-ALK fusion gene and the clinic opathological characteristics as well as the serum markers,and understand the efficacy of targeted therapy.Methods EML4-ALK fusion gene status of 71 cases of patients with metastases tissue lung cancer were detected using FQ-PCR and the serum levels of CEA,CA125 and VEGF were detected.Correlation between EML4-ALK fusion gene expression and serum marker levels were analyzed. Results The metastatic sites with EML4-ALK fusion gene mutation were lymph nodes,brain,bone and pleural tissue,in which the positive expression rate of EML4-ALK fusion gene was 7.04%.Although there was no obvious correlation between the EML4-ALK fusion gene and pathological type,gender,age,smoking status,degree of differentiation and stage(P>0.05),most patients were adenocarcinoma or non-smokers.The levels of serum CEA,CA125 and VEGF in EML4-ALK fusion gene-positive patients had no significant difference with those of negative patients(P>0.05).The 6 months disease control rate of patient receiving Crizotinib treatment was 66%.Conclusion It is feasible that FQ-PCR technique can be used to detect EML4-ALK fusion gene in metastasis,which may provide targeted treatment strategy for those advantaged generation,such as adenocarcinoma or non-smokers patients.
EML4-ALK gene;FQ-PCR;Lung cancer;Metastasis
R73
A
1673-7210(2015)05(b)-0004-04
2014-12-19本文编辑:程铭)
国家自然科学基金资助项目(81372489)。
