化疗栓塞治疗肝癌合并肝动-静脉分流的预后因素分析
2015-10-25刘秋松梅雀林李彦豪何晓峰陈勇曾庆乐赵剑波王江云庞桦进
刘秋松,梅雀林,李彦豪,何晓峰,陈勇,曾庆乐,赵剑波,王江云,庞桦进
·肿瘤介入Tumor intervention·
化疗栓塞治疗肝癌合并肝动-静脉分流的预后因素分析
刘秋松,梅雀林,李彦豪,何晓峰,陈勇,曾庆乐,赵剑波,王江云,庞桦进
目的探讨聚乙烯醇(PVA)联合碘油化疗药乳剂(或化疗药物)在肝癌合并肝动-静脉分流栓塞治疗的生存预后因素。方法2013年1月—2014年6月,97例肝癌并肝动-静脉分流的患者(慢速型分流21例,中速型分流40例,快速型分流36例),分别应用PVA-300、PVA-500及PVA-700行末梢性化疗栓塞,其中慢、中速型加用碘油化疗乳剂栓塞,快速型仅加用化疗药物。应用Kaplan-Meier法、Log-Rank检验进行生存分析,Cox比例风险模型进行多因素回归分析。结果97例肝癌合并肝动-静脉分流的患者中位生存期为281 d,6、12、18个月生存率分别为67%、37.2%、14.2%。多因素分析结果显示:术前AFP≥400 ng/ml(HR=3.763,P=0.002)、门静脉癌栓形成(HR=2.669,P=0.021)及疾病进展(HR=2.55,P=0.039)为独立危险因素;而栓塞次数≥3次(HR=0.216,P=0.001)、分流完全及次全栓塞(HR=0.22,P= 0.030)及采用综合治疗(HR=0.181,P<0.001)为独立保护因素。结论PVA联合碘油化疗药乳剂(或化疗药物)末梢性化疗栓塞肝癌合并肝动-静脉分流是一种可行、有效的方法。栓塞次数较多、分流完全、次全栓塞以及采用综合治疗的患者预后较好,而术前AFP高水平、门静脉癌栓形成及疾病进展为患者预后危险因素。
聚乙烯醇;化疗栓塞,治疗性;癌,肝细胞;肝动静脉分流;预后因素分析
中晚期肝癌(HCC)常合并肝动-静脉分流(hepatic arteriovenous shunts,HAVS),发生率31.2%[1],分为肝动脉-门静脉分流(APVS)、肝动脉-肝静脉分流(AHVS)和混合型,其中APVS占76%~90%[2]。采用合适的栓塞剂行分流动脉末梢栓塞是有效治疗动静脉分流的基础[3]。根据分流速度将HAVS分为3型[4-5],并依此选择相应规格大小的聚乙烯醇(PVA)栓塞分流道。本研究回顾性分析2013年1月至2014年6月本院收治的97例HCC合并HAVS患者的资料,探讨应用PVA联合碘油化疗药乳剂(或化疗药物)末梢性化疗栓塞HCC合并HAVS的预后影响因素。
1 材料与方法
1.1 临床资料
2013年1 月至2014年6月,97例HCC合并HAVS患者在我院行PVA联合碘油化疗药乳剂(或化疗药物)末梢性化疗栓塞。其中男88例(90.7%),女9例(9.3%)。年龄25~77岁,中位年龄50岁。HAVS属慢速型21例(21.7%),中速型40例(41.2%),快速型36例(37.1%),不同分流速度类型的基线情况详见表1。排除标准:如BCLC-D期、严重的凝血功能障碍、门静脉主干被癌栓完全阻塞且侧支血管形成少等。在介入治疗过程中分别采用不同规格PVA联合碘油化疗乳剂(或化疗药物)进行末梢性化疗栓塞。
1.2 方法
1.2.1 治疗方法采用常规插管至肝总和(或)肠系膜上动脉造影,评估肿瘤供血及HAVS类型、速度,然后进一步超选择插管或引入微导管超选择插管至分流供血动脉及肿瘤供血动脉进行化疗栓塞。根据A-V显影时间,选用不同粒径PVA(COOK公司,美国)栓塞,慢速型:PVA-300;中速型:PVA-500;快速型:PVA-700。碘油化疗药乳剂制备:表柔比星10~20 mg、奥沙利铂50~100 mg、丝裂霉素10 mg、碘油5~15 ml及1∶1比例的对比剂混合制成。对慢、中速型分流可先行PVA(0.5~1瓶PVA+30~40 ml稀释对比剂)栓塞,待分流速度明显减缓或停滞,再应用适量碘油化疗乳剂栓塞肿瘤供血动脉。如试行栓塞发现碘化油乳剂沉积不良,可将PVA与碘油化疗乳剂混合均匀后再行栓塞。而快速型因其分流速度较快,宜采用单纯化疗药物溶于适量对比剂后与PVA混合均匀再一同栓塞。如后续治疗中造影发现HAVS消失,则仅行TACE。
1.2.2 观察指标和随访收集患者栓塞前后的Child-Pugh分级、ECOG评分、腹水、食管胃底静脉曲张程度、AFP水平、分流栓塞程度等指标。本研究采用改良的实体瘤疗效评价标准(mRECIST)[6]。分流栓塞程度是依据栓塞后即刻造影复查,将栓塞程度分为3级:完全栓塞,即分流完全闭塞,造影复查未见静脉显影;次全栓塞,造影复查示少许分流残留,分流明显缓慢或分流范围明显缩小;不完全栓塞,造影复查示分流明显残留。
随访方法为电话随访、再次入院和门诊定期随访。生存期计算方法为患者首次接受分流栓塞治疗至末次随访或死亡,研究终止时间为2014年12月31日。
1.3 统计学分析
对患者栓塞前后的计量资料采用均数±标准差表述,计数资料组间比较采用χ2检验,计量资料采用秩和检验。采用Kaplan-Meier法计算累计生存率,Log-Rank检验行差异显著性检验。采用Cox比例风险模型进行多因素回归分析,单因素分析中P值<0.05为列入标准,自变量筛选采用基于偏最大似然估计的前进法(Forward:LR)进行多因素分析。采用SPSS 19.0软件进行统计学分析,以P<0.05为差异有统计学意义。
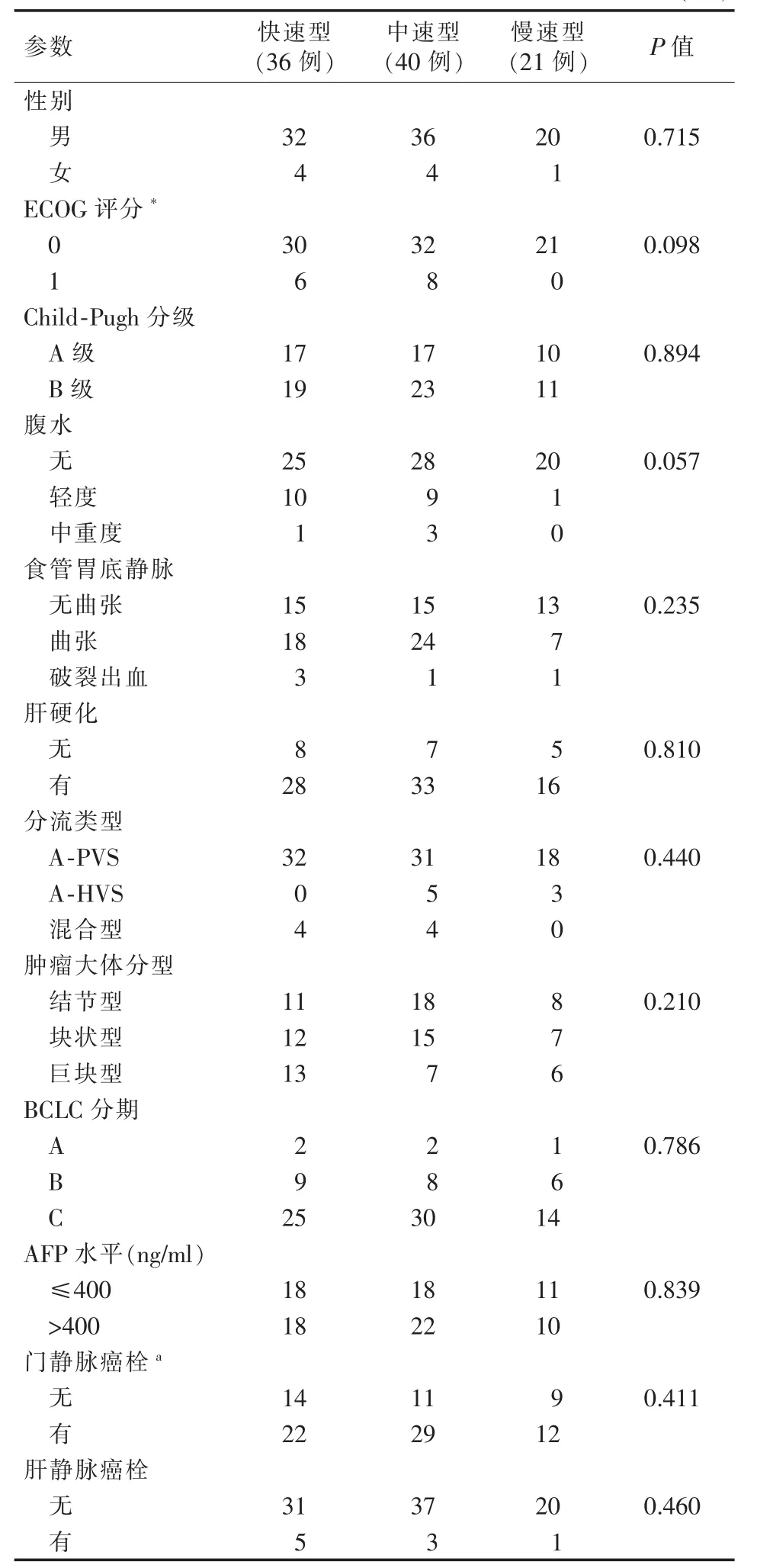
表1 不同分流速度类型患者的基线情况(例)
2 结果
2.1 患者临床基线及栓塞治疗情况
不同分流速度类型患者栓塞前的临床基线情况,如年龄、性别、Child-Pugh分级、ECOG评分、肿瘤直径、AFP水平、BCLC分期、门静脉癌栓等差异均无统计学意义(均P>0.05,表1)。本研究97例患者共行190例次栓塞治疗,其中分流栓塞治疗150例次,1~5次/例,中位栓塞次数3次,治疗间隔中位时间为49 d。
2.2 不同分流速度类型栓塞后的即刻栓塞率对比情况
150 例次分流栓塞中,3种分流速度类型的完全及次全栓塞率差异有统计学意义(Kruskal-Wallis检验,P= 0.02)。(表2)。

表2 不同分流速度类型的即刻栓塞率对比情况
2.3 肿瘤反应
本研究共计行190例次栓塞,其中可评价疗效95例次,完全缓解1例次,部分缓解10例次,稳定30例次,进展54例次,疾病控制率(CR+PR+SD)为43.15%(图1)。疾病控制组较进展组的生存期差异有统计学意义(χ2=5.175,P=0.023)。
2.4 生存期

图1 HCC栓塞治疗前后图像
97例患者中位生存期281 d,6、12、18个月生存率分别为67%、37.2%、14.2%。快速型、中速型、慢速型中位生存期分别为211 d、230 d和378 d。快速型6、12个月生存率分别为61.1%、23.6%,中速型6、12个月生存率分别为60.8%、33.6%,慢速型6、12个月生存率分别为83.4%、54.7%。采用Kaplan-Meier法、Log-Rank检验显示不同分流速度类型生存期无显著性差异(χ2=2.112,P=0.146)。
2.5 生存期的单、多因素分析结果
单因素分析结果显示:首次栓塞前及末次栓塞后AFP表达水平、血清白蛋白、腹水、门静脉癌栓、肿瘤大体分型、栓塞次数、完全及次全栓塞、综合治疗及疾病控制情况均与预后相关(均P<0.05),而年龄、栓塞前BCLC分期、ECOG评分、凝血酶原时间、总胆红素、食管胃底静脉曲张、肝硬化、肝静脉癌栓、分流类型、分流速度、碘油累计量、奥沙利铂累计量、表柔比星累计量、丝裂霉素累计量及索拉非尼应用与患者预后无关(均P>0.05)。Cox回归分析结果显示:术前AFP≥400 ng/ml(HR=3.763,P= 0.002)、门静脉癌栓形成(HR=2.669,P=0.021)及疾病进展(HR=2.55,P=0.039)为独立危险因素;而栓塞次数≥3次(HR=0.216,P=0.001)、完全及次全栓塞(HR=0.220,P=0.030)及综合治疗(HR=0.181,P<0.001)为独立保护因素。(表3)

表3 97例HCC合并HAVS生存期的单、多因素分析
3 讨论
HCC合并HAVS常提示预后不良,HAVS一方面导致门静脉高压、顽固性腹水、消化道出血、盗血性肝功能减退、肝内外转移等,另一方面栓塞治疗时栓塞剂可通过分流道导致误栓正常肝组织、肺动脉栓塞等[7]。使用不同栓塞剂栓塞HCC合并HAVS的疗效不尽相同,长效栓塞剂如PVA、无水乙醇、NBCA等,因可达到末梢栓塞、不可吸收或对末梢血管栓塞破坏,其疗效相对较好[8-9]。Kim等[10]报道应用PVA联合碘油栓塞19例肝癌伴动门静脉分流,中位生存期为162 d。Shi等[11]报道应用NBCA栓塞伴有重度动门静脉分流的肝癌12例,中位生存期为275 d,6个月、1年、2年的生存率分别为67%、33%、8%。本研究97例患者中位生存时间281 d,6、12、18个月生存率分别为67%、37.2%、14.2%,疗效优于既往报道应用PVA栓塞HAVS的疗效。
基础肝功能状态影响肿瘤疗效及生存期。良好的肝功能储备是患者治疗的基础保障,可明显减少术后肝功能衰竭等严重并发症[12-13]。肝脏肿瘤负荷越大、多发浸润性生长其预后越差[14]。AFP高表达预示着肿瘤生物学行为较差、肿瘤负荷较大及预后较差[15]。门静脉癌栓是分流形成的重要因素之一[16],亦是影响肝癌预后的重要因素[3,12,14]。本组患者中AFP(≥400 ng/ml)高表达50例(51.5%),伴有门静脉主干和(或)左右支癌栓形成63例(64.9%),多因素分析均显示为独立危险因素。
本研究单、多因素分析均发现栓塞次数≥3次的患者生存获益更多(HR=0.216,P=0.001),提示经多次栓塞治疗可较为有效控制肝脏病灶,提高生存率。栓塞后分流闭塞、分流速度减缓,一方面可降低门静脉压力、减少食管胃底静脉曲张破裂出血风险,另一方面可改善肝脏营养灌注,利于肝功能改善,从而改善患者生存[13]。本研究各分流速度类型间生存期差异无统计学意义(χ2=2.112,P=0.146),分析原因可能因肿瘤再次进展和栓塞的不良反应从而导致患者肝功能损害,部分抵消了分流栓塞治疗的生存获益。
本研究显示TACE联合射频消融(RFA,6/97)、经皮穿刺瘤内注药(4/97)、放疗(2/97)及索拉非尼(12/97)等综合治疗可提高HCC合并HAVS患者的生存期。TACE是不能手术切除肝癌的首选治疗方法,但治疗后肿瘤完全坏死率仅达10%~20%[17]。联合RFA可提高肿瘤坏死率、减少肿瘤负荷,从而提高患者生存期及降低肿瘤复发率[18-19]。放疗可以通过抗肿瘤及抗血管作用弥补TACE的部分不足,可对门静脉癌栓等TACE疗效欠佳部位有效治疗,并可改善门静脉癌栓合并APVS的疗效[20-21]。经皮穿刺瘤内注药可在透视下实时监测,创伤小,并发症少,并可安全有效治疗膈顶、大血管旁等物理消融禁区的病灶;另其较好的适形效果及较大的弥散范围,可较彻底地灭活残存肿瘤[22]。TACE联合索拉菲尼可延长患者生存期及无进展生存期[23-25]。但亦有meta分析提示TACE联合索拉非尼治疗无法手术切除肝癌仅改善肿瘤无进展时间,而对生存期无改善[26]。本研究分层分析显示是否联合应用索拉非尼的生存期差异未达统计学意义(χ2=3.167,P=0.075)。
文献报道TACE中使用不同化疗药物方案其生存期类似,影响疗效的关键是达到末梢性栓塞,导致肿瘤组织坏死。控制、减少化疗药物使用量有利于保护肝功能,减少术后并发症及病死率[8]。本研究单因素分析显示奥沙利铂累计用量(>100 mg)亦仅对近期生存期有影响(Breslow检验,P=0.016),而表柔比星、丝裂霉素的累计使用量对生存期影响均无统计学差异。
肝外动静脉分流栓塞治疗经验表明,栓塞后即刻造影出现较高栓塞率者,在血管明显狭窄、血管收缩、血流速度缓慢等多因素作用下,形成的血栓将极可能导致分流完全闭塞[27-28]。本研究多因素分析结果显示完全及次全栓塞为生存期独立保护因素,与文献报道吻合,证明该疗效评价方法的有效性及可行性。
本研究结果显示:依据动-静脉显影时间,选用不同粒径PVA联合碘油化疗药乳剂(或化疗药物)末梢性化疗栓塞治疗HCC合并HAVS可行、有效。栓塞次数≥3次、分流完全及次全栓塞以及采用综合治疗的患者预后较好,而术前AFP高水平表达(≥400 ng/ml)、门静脉癌栓形成及疾病进展为患者预后危险因素。
[1]Ngan H,Peh WC.Arteriovenous shunting in hepatocellular carcinoma:its prevalence and clinical significance[J].Clin Radiol,1997,52:36-40.
[2]刘圣,施海彬,杨正强,等.α-氰基丙烯酸正丁酯栓塞治疗肝细胞癌并肝动脉-门静脉瘘的临床价值[J].中华放射学杂志,2009,43:279-283.
[3]孙磊,施海彬,刘圣,等.肝细胞癌肝动脉门静脉分流形成的相关因素分析[J].介入放射学杂志,2012,21:206-210.
[4]Mei Q,Li Y.Transcatheter arterial embolization of hepatic arteriovenous shunts in patients with hepatocellular carcinoma[J].Semin Intervent Radiol,2012,29:237-240.
[5]李彦豪,何晓峰,陈勇.实用临床介入诊疗学图解[M].第3版,北京:科学出版社,2012:344-347.
[6]Lencioni R,Llovet JM.Modified RECIST(mRECIST)assessment for hepatocellular carcinoma[J].Semin Liver Dis,2010,30:52-60.
[7]Zhou WZ,Shi HB,Liu S,et al.Arterioportal shunts in patients with hepatocellular carcinoma treated using ethanol-soaked gelatin sponge:therapeutic effects and prognostic factors[J].J Vasc Interv Radiol,2015,26:223-230.
[8]Maluccio MA,Covey AM,Porat LB,et al.Transcatheter arterialembolization with only particles for the treatment of unresectable hepatocellular carcinoma[J].J Vasc Interv Radiol,2008,19:862-869.
[9]周卫忠,刘圣,杨正强,等.氰基丙烯酸酯胶栓塞原发性肝细胞癌合并重度肝动脉门静脉瘘12例疗效分析[J].介入放射学杂志,2013,22:641-645.
[10]Kim YJ,Lee HG,Park JM,et al.Polyvinyl alcohol embolization adjuvant to oily chemoembolization in advanced hepatocellular carcinoma with arterioportal shunts[J].Korean J Radiol,2007,8:311-319.
[11]Shi HB,Yang ZQ,Liu S,et al.Transarterial embolization with cyanoacrylate for severe arterioportal shunt complicated by hepatocellular carcinoma[J].Cardiovasc Intervent Radiol,2013,36:412-421.
[12]Hu HT,Kim JH,Lee LS,et al.Chemoembolization for hepatocellular carcinoma:multivariate analysis of predicting factors for tumor response and survival in a 362-patient cohort[J].J Vasc Interv Radiol,2011,22:917-923.
[13]Vogl TJ,Nour-Eldin NE,Emad-Eldin S,et al.Portal vein thrombosis and arterioportal shunts:effects on tumor response after chemoembo-lization of hepatocellular carcinoma[J].World J Gastroenterol,2011,17:1267-1275.
[14]Chern MC,Chuang VP,Liang CT,et al.Transcatheter arterial chemoembolization for advanced hepatocellular carcinoma with portal vein invasion:safety,efficacy,and prognostic factors[J].J Vasc Interv Radiol,2014,25:32-40.
[15]毕新宇,阎涛,赵宏,等.甲胎蛋白水平与肝细胞癌预后的相关性分析[J].中华医学杂志,2014,94:2645-2649.
[16]欧阳墉,欧阳雪晖.肝内肝动脉-门静脉分流的研究进展[J].医学影像学杂志,2005,15:1019-1023.
[17]Ni JY,Sun HL,Chen YT,et al.Prognostic factors for survival after transarterial chemoembolization combined with microwave ablation for hepatocellular carcinoma[J].World J Gastroenterol,2014,20:17483-17490.
[18]Ni JY,Liu SS,Xu LF,et al.Meta-analysis of radiofrequency ablation in combination with transarterial chemoembolization for hepatocellular carcinoma[J].World J Gastroenterol,2013,19:3872-3882.
[19]含笑,吕维富.经肝动脉化疗栓塞联合射频消融治疗原发性肝癌远期疗效的荟萃分析[J].介入放射学杂志,2013,22:387-391.
[20]Yoon SM,Lim YS,Won HJ,et al.Radiotherapy plus transarterial chemoembolization for hepatocellular carcinoma invading the portal vein:long-term patient outcomes[J].Int J Radiat Oncol Biol Phys,2012,82:2004-2011.
[21]Oh D,Shin SW,Park HC,et al.Changes in arterioportal shunts in hepatocellular carcinoma patients with portal vein thrombosis who were treated with chemoembolization followed by radiotherapy[J].Cancer Res Treat,2015,47:251-258.
[22]陈勇,赵剑波,曾庆乐,等.经皮穿刺瘤内注入碘油化疗药乳剂治疗原发性肝癌[J].中华普通外科杂志,2009,24:992-995.
[23]Chen J,Chen S,Xi W,et al.Transcatheter arterial chemoembolization and chemotherapy plus sorafenib in a large hepatocellular carcinoma with arterioportal shunt[J].Case Rep Oncol Med,2014,2014:392403.
[24]Chao Y,Chung YH,Han G,et al.The combination of transcatheter arterial chemoembolization and sorafenib is well tolerated and effective in Asian patients with hepatocellular carcinoma:final results of the START trial[J].Int J Cancer,2015,136:1458-1467.
[25]Berk V,Kaplan MA,Tonyali O,et al.Efficiency and side effects of sorafenib therapy for advanced hepatocellular carcinoma:a retrospective study by the anatolian society of medical oncology[J].Asian Pac J Cancer Prev,2013,14:7367-7369.
[26]Liu L,Chen H,Wang M,et al.Combination therapy of sorafenib and TACE for unresectable HCC:a systematic review and metaanalysis[J].PLoS One,2014,9:e91124.
[27]Chan WS,Poon WL,Cho DH,et al.Transcatheter embolisation of intrahepatic arteriovenous shunts in patients with hepatocellular carcinoma[J].Hong Kong Med J,2010,16:48-55.
[28]Yoshida K,Melake M,Oishi H,et al.Transvenous embolization of dural carotid cavernous fistulas:a series of 44 consecutive patients[J].AJNR Am J Neuroradiol,2010,31:651-655.
Polyvinyl alcohol chemoembolization for the treatment of hepatocellular carcinoma associated with hepatic arteriovenous shunt:analysis of prognostic factors
LIU Qiu-song,MEI Que-lin,LI Yan-hao, HE Xiao-feng,CHEN Yong,ZENG Qing-le,ZHAO Jian-bo,WANG Jiang-yun,PANG Hua-jin.Department of Interventional Radiology,Affiliated Nanfang Hospital,Southern Medical University,Guangzhou,Guangdong Province 510515,China
LI Yan-hao,E-mail:cjr.liyanhao@vip.163.com
ObjectiveTo analyze the survival prognostic factors in patients with hepatocellular carcinoma(HCC)complicated by hepatic arteriovenous shunts(HAVS)who were treated with chemoembolization by using polyvinyl alcohol(PVA)together with iodine oil chemotherapeutic emulsion(or chemotherapeutic agents).MethodsFrom January 2013 to June 2014,a total of 97 HCC patients associated with HAVS were admitted to authors'hospital to receive interventional chemoembolization.The HAVS patterns included slow-flow shunt type(n=21),moderate-flow shunt type(n=40)and fast-flow shunt type(n=36). PVA-300,PVA-500 and PVA-700 were separately used for peripheral chemoembolization;additional iodine oil chemotherapeutic emulsion was employed for patients with slow-flow shunt type and moderate-flow shunt type HAVS,and only chemotherapeutic agent was added to patients with fast-flow shunt type HAVS.The prognostic factors were retrospectively analyzed by using univariate Kaplan-Meier method,Log-Rank test,and a Cox proportional hazards model was used for multivariate regression analysis.ResultsThe median survival time of the 97 HCC patients associated with HAVS was 281 days,with the 6-month,12-month and18-month survival rates being 67%,37.2%and 14.2%respectively.Multivariate analysis results indicated that preoperative AFP level≥400 ng/ml(HR=3.763,P=0.002),formation of portal vein tumor thrombus(HR=2.669,P=0.021)and disease in progress(HR=2.55,P=0.039)were the independent risk factors;and the independent protection factors included≥3 times of embolization procedure(HR=0.216,P=0.001),complete and sub-complete occlusion of HAVS(HR=0.22,P=0.030)and use of comprehensive treatment(HR=0.181,P<0.001).ConclusionFor the treatment of HCC associated with HAVS,percutaneous interventional chemoembolization by using polyvinyl alcohol(PVA)together with iodine oil chemotherapeutic emulsion(or chemotherapeutic agents)is clinically feasible and effective.For patients who have received≥3 times of embolization procedure and comprehensive therapies,and their shunts have been completely or subcompletely obstructed,the prognosis is usually better;while the preoperative AFP level≥400 ng/ml(HR= 3.763,P=0.002),the formation of portal vein tumor thrombus(HR=2.669,P=0.021)and the disease in progress(HR=2.55,P=0.039)are the independent risk factors.(J Intervent Radiol,2015,24:1056-1061)
polyvinyl alcohol;chemoembolization,therapeutic;carcinoma,hepatocellular;hepatic arteriovenous shunt;analysis of prognostic factor
R735.7
A
1008-794X(2015)-12-1056-06
2015-04-08)
(本文编辑:俞瑞纲)
10.3969/j.issn.1008-794X.2015.12.008
510515广州南方医科大学附属南方医院介入科
李彦豪E-mail:cjr.liyanhao@vip.163.com
