替罗非班在颅内破裂动脉瘤介入治疗术中预防性应用研究
2015-10-25梁晓东王子亮李天晓贺迎坤赵同源许岗勤汪勇锋周腾飞邵秋季
梁晓东,王子亮,李天晓,贺迎坤,赵同源,许岗勤,汪勇锋,周腾飞,邵秋季
·神经介入Neurointervention·
替罗非班在颅内破裂动脉瘤介入治疗术中预防性应用研究
梁晓东,王子亮,李天晓,贺迎坤,赵同源,许岗勤,汪勇锋,周腾飞,邵秋季
目的探讨替罗非班在颅内破裂动脉瘤介入栓塞治疗术中应用的安全性和有效性。方法回顾性分析2012年1月至2014年11月因颅内动脉瘤破裂在河南省人民医院接受介入栓塞治疗且术中应用替罗非班患者的临床资料。替罗非班应用方案:支架释放前或单纯弹簧圈栓塞完成时经静脉给予负荷剂量(8.0 μg/kg,3 min内推注完毕),继而维持剂量(0.1 μg·kg-1·min-1)至术后24 h,撤药前2 h给予负荷剂量抗血小板口服药物替换。观察分析替罗非班相关颅内出血和血栓栓塞事件。结果入组208例患者中支架辅助栓塞166例(79.81%),单纯弹簧圈栓塞42例(20.19%)。替罗非班相关颅内出血4例(1.92%,均发生在支架辅助栓塞队列),其中术中3例(1.44%),术后1例(0.48%);血栓栓塞事件6例(2.88%,支架辅助栓塞5例,单纯弹簧圈栓塞1例),其中术中支架内血栓形成1例(0.48%),术后维持用药期间血栓栓塞相关症状5例(2.40%)。结论经静脉负荷剂量继而维持剂量替罗非班在颅内破裂动脉瘤介入栓塞治疗术中预防性应用是安全、有效的。
替罗非班;颅内动脉瘤;破裂;预防;抗血小板;出血;血栓栓塞
颅内动脉瘤介入栓塞治疗多采用电解脱弹簧圈及支架植入术[1-3],血栓栓塞成为术后主要并发症之一[4],而动脉瘤破裂时血管痉挛、炎症及凝血机制激活使血栓事件更易发生[5-7],术中快速起效的抗血小板药物就成为近年研究热点。替罗非班是一种非肽类、可逆性血小板表面糖蛋白Ⅱb/Ⅲa受体拮抗剂,具有静脉给药后起效快、血浆半衰期短(约2 h)[8]、撤药后、膜修复等优点[10],受到越来越多神经介入医师青睐。替罗非班在冠状动脉成形术中应用的安全性和有效性已得到证实[11],但在脑血管介入治疗术中如何应用尚无统一标准。本文就负荷剂量继而维持剂量替罗非班在颅内破裂动脉瘤介入栓塞术中预防性应用的安全有效性进行回顾分析。现报道如下。
1 材料与方法
1.1 临床资料
收集2012年1月至2014年11月在河南省人民医院接受介入栓塞术且术中负荷剂量继而维持剂量应用替罗非班的208例颅内破裂动脉瘤患者临床资料,其中男67例,女141例;平均年龄(56± 11)岁(16~81岁);伴有高血压病100例(48.08%),糖尿病13例(6.25%),高脂血症5例(2.40%)。支架辅助栓塞166例(79.81%),单纯弹簧圈栓塞42例(20.19%)。术前Hunt-Hess分级:Ⅰ级25例(12.02%),Ⅱ级90例(43.27%),Ⅲ级72例(34.62%),Ⅳ级21例(10.09%)。纳入标准:①发现蛛网膜下腔出血至介入手术治疗间隔时间≤1个月;②术中负荷剂量继而维持剂量替罗非班应用者;③术前影像检查证实颅内动脉瘤破裂。排除标准:①术中血栓形成后急救性应用者;②术中应用抗血小板口服药物者;③术后应用肝素者;④术前血小板计数<90× 109/L;⑤严重肾功能不全(肌酐清除率<30 ml/min);⑥术前Hunt-Hess分级>Ⅳ级。
1.2 介入手术治疗过程及用药方案
对入院时病情较重患者,先稳定病情。所有患者术前均接受头颅CTA或DSA造影明确动脉瘤形态、大小、位置、解剖关系,治疗组内讨论后确定治疗方案;对复杂动脉瘤、手术风险极高者,全科医师集体讨论后拟定最佳手术方案;若需急症手术,则DSA造影与手术治疗一次性完成。无论是DSA造影还是动脉瘤介入栓塞术,术前均取得患者或授权委托人知情同意。
介入栓塞术在全身麻醉下进行,经股动脉穿刺入路,术中依据体重给予负荷剂量肝素50~70 U/kg,继而1 000 U/h静脉维持。在支架释放前或单纯弹簧圈栓塞完成时,给予负荷剂量替罗非班8.0 μg/kg,3 min内静脉推注完毕,继而静脉维持剂量0.1 μg· kg-1·min-1至术后24 h;替罗非班停用前2 h给予负荷剂量氯吡格雷300 mg+肠溶阿司匹林100 mg或300 mg,同时替罗非班静脉维持剂量减半;术后2 d起每天给予常规剂量氯吡格雷75 mg+肠溶阿司匹林100 mg,行抗血小板聚集治疗。弹簧圈或支架植入后每隔5~10 min作一次局部脑血管造影,查看载瘤动脉近端及远端前向血流状态。手术结束前在DSA下行头颅CT平扫,查看颅内是否有新发出血。若术中造影发现出血,即刻对出血部位行弹簧圈栓塞,同时给予鱼精蛋白(5 mg∶1 000 U肝素);若术中发现血栓,再次给予负荷剂量替罗非班并密切观察30 min,前向血流状态未改善或加重则辅以机械方式开通。鉴于术后额外应用肝素抗凝可能增加颅内出血风险[12-13],我们自2012年1月起对破裂动脉瘤介入栓塞术后仅给予维持剂量替罗非班,未常规应用肝素。
所有患者术后均在本中心神经科重症监护病房停留至少24 h,由专业医护人员密切观察患者生命体征,注意穿刺部位有无皮下淤血、渗血。术后及时复查头颅CT或MRI,查看是否有新发出血或血栓栓塞事件。对术中支架辅助栓塞者,术后2 d起常规剂量氯吡格雷75 mg和肠溶阿司匹林100 mg联用3~6个月,之后长期口服肠溶阿司匹林或氯吡格雷;对单纯弹簧圈栓塞者,术后2 d起氯吡格雷75 mg和肠溶阿司匹林100 mg联用2~4周,之后口服其中一种1~3个月。
1.3 出血与血栓栓塞事件定义
替罗非班相关出血事件包括以下两方面:①术中相关出血,即替罗非班应用后DSA发现对比剂外溢,伴或不伴栓塞材料突出瘤体之外;②术后维持用药期间及替罗非班停用后4 h内头颅CT证实颅内新发出血。血栓栓塞事件包括术中DSA发现血管内充盈缺损与术后维持用药期间出现血栓栓塞相关症状(经CT或MRI证实)。本研究中所有患者临床、影像学资料均由2位具有10年以上工作经验的神经介入放射学医师分别查阅并分析。
1.4 统计学处理
采用SPSS 17.0软件对数据进行统计学处理。计量资料以均数±标准差()表示,P<0.05表示差异有统计学意义。
2 结果
2.1 动脉瘤影像学特点
208 例入组患者共有257枚动脉瘤,其中介入干预228枚(表1);37例患者为多发动脉瘤,171例为单发动脉瘤。动脉瘤大小(按照瘤体最大直径计算):1.3~16.0 mm,中位值5.0 mm;形态:每例患者至少有1个动脉瘤形态不规则。
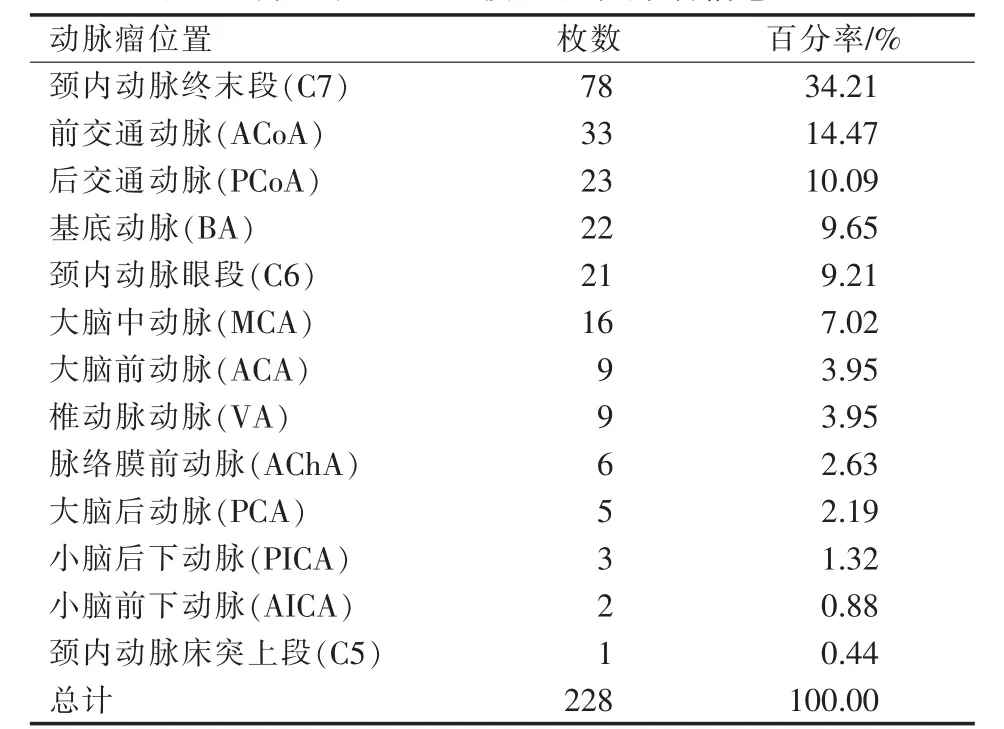
表1 介入栓塞228枚破裂动脉瘤信息汇总
2.2 栓塞材料
本组166例患者辅助使用支架(Enterprise支架93例,Solitaire支架60例,Neuroform支架10例,Enterprise支架+Solitaire支架1例,Neuroform支架+ Enterprise支架1例,LVIS支架1例),42例患者单纯使用弹簧圈。
2.3 出血及血栓栓塞事件
本研究中替罗非班相关颅内出血4例(1.92%),均为支架辅助栓塞患者,其中术中出血3例(1.44%),术后致死性出血1例(0.48%);未发现替罗非班相关血小板减少患者,亦未发现腹膜后、胃肠道、泌尿系统出血患者。发现血栓栓塞事件6例(2.88%),其中术中1例(0.48%),术后5例(2.40%,其中1例经单纯弹簧圈栓塞)。
3 讨论
3.1 应用方案
血栓事件是颅内破裂动脉瘤介入治疗术中主要并发症之一[1-7],为预防术中及术后血栓相关并发症发生,最大限度减低致死、致残率,替罗非班被越来越多地应用于神经介入领域。然而迄今尚无统一的临床应用标准。本中心参照替罗非班治疗预后和再狭窄随机疗效研究(RESTORE)试验方案(10 μg/kg,推注时间持续3 min,继而维持剂量0.15 μg·kg-1· min-1至术后36 h),在支架植入前或单纯弹簧圈栓塞完成后,经静脉给予负荷剂量替罗非班8.0 μg/kg,3 min内推注完毕,继而静脉维持剂量0.1 μg·kg-1· min-1至术后24 h。
研究表明,替罗非班经静脉负荷剂量继而维持剂量应用后5~10 min即可达到较高血小板抑制率[14-15],且负荷剂量后10 min检测点抑制率低于95%患者似乎更易于发生主要不良事件(心肌梗死、心肌缺血及急性靶血管血运重建)[14]。负荷剂量氯吡格雷300 mg在2~4 h内即可达到38%~54%抑制率[16-17],为确保撤药后血小板功能处于较好抑制状态,在替罗非班停用前2 h给予氯吡格雷300 mg+肠溶阿司匹林100 mg或300 mg,同时替罗非班维持量减半。
3.2 并发症
本研究中替罗非班相关颅内出血共4例(1.92%),均发生在支架辅助栓塞队列中,且主要发生在术中(3例,均与操作技术相关)。替罗非班应用期间出现6例(2.88%)血栓栓塞事件,其中5例发生在支架辅助栓塞队列中,1例发生在非支架辅助栓塞队列中,这表明即使支架植入前给予快速抗血小板药物替罗非班,支架辅助栓塞患者仍易出现血栓栓塞并发症。
对比Chalouhi等[18]报道的颅内动脉瘤支架辅助弹簧圈栓塞治疗起始方案,两者均为负荷剂量继而维持剂量,但本研究负荷剂量及给药时间与之不同(8.0 μg/kg,3 min内静脉推注对0.4 μg·kg-1·min-1,30 min内静脉维持),且本研究替罗非班相关颅内出血率较低(1.92%=4/208对18.8%=3/16),相关致死性出血率亦低于其起始方案(0.48%=1/208对12.5%= 2/16)。分析原因,Chalouhi等起始方案中较高颅内出血率可能与其术中同时给予负荷剂量氯吡格雷600 mg+肠溶阿司匹林325 mg抗血小板药物有关。Yi等[8]报道在颅内动脉瘤介入治疗术中应用负荷剂量依替非巴肽180 μg/kg,结果破裂动脉瘤队列表现出较高相关出血率(6.3%)。同样,Walsh等[19]多中心研究显示,动脉瘤介入治疗术中经不同途径使用阿昔单抗后出现较高的相关出血率(17.65%)和致死性出血率(7.84%);与依替非巴肽、阿昔单抗较高出血率相比,静脉应用替罗非班似乎较为安全。对比Amenta等[20]研究(在破裂宽颈动脉瘤支架辅助栓塞术中给予负荷剂量氯吡格雷600 mg)结果,本研究药物相关颅内出血率、致死性出血率均较低,分别为1.92%对7.7%、0.48%对4.6%。综上可知,负荷剂量继而维持剂量替罗非班在颅内破裂动脉瘤介入栓塞术中预防性应用是安全的。
Ries等[21]研究发现颅内破裂动脉瘤术中肝素化后辅以静脉维持阿司匹林,可降低血栓事件发生率(10.09%对20.00%,P=0.047)。本研究中术前、术中均未口服氯吡格雷或肠溶阿司匹林等抗血小板药物,而是将负荷剂量替罗非班作为术中负荷剂量氯吡格雷+阿司匹林的一种替代性药物应用,与Ries等颅内动脉瘤破裂组(术中肝素+阿司匹林,n= 109,血栓率为10.09%)相比,表现出较低血栓事件发生率(术中肝素+替罗非班,n=208,血栓率为2.88%)。对比Amenta等[20]研究结果,本研究血栓事件发生率亦较低(2.88%对7.7%)。
近年来,各种支架辅助栓塞技术在颅内动脉瘤介入治疗术中应用的可行性已得到肯定[22-23],但并发症亦随之而来。余天垒等[3]纳入Enterprise支架与Solitaire支架辅助栓塞颅内复杂动脉瘤患者108例,术前5 d给予肠溶阿司匹林300 mg+氯吡格雷75 mg或鼻饲给予肠溶阿司匹林300 mg+氯吡格雷300 mg(急症手术患者),术后30 d出血、血栓事件总并发症发生率高达11.72%(出血率2.34%,血栓率9.38%),而本研究中总并发症发生率为4.81%(出血率1.92%,血栓率2.88%)。
综上所述,对于颅内破裂动脉瘤,术中应用肝素+负荷剂量氯吡格雷或阿司匹林维持可明显降低血栓事件发生率[20-21],但本研究中术中肝素+负荷剂量替罗非班应用则表现出更低血栓事件发生率,且未增加颅内出血事件发生率,这说明负荷剂量继而维持剂量替罗非班作为术中负荷剂量抗血小板口服药物的一种替代性选择,是安全、有效且可行的。
然而,本研究为回顾性研究,缺乏随机、对照等特性;未对用药前后血小板抑制率进行定点监测,因此不能对其抑制率与出血、血栓事件相关性进行分析。对替罗非班在颅内破裂动脉瘤介入治疗术中预防性应用进行前瞻性、多中心随机对照试验研究,则显得更有临床意义。
本研究结论认为,经静脉3 min内给予负荷剂量替罗非班8.0 μg/kg,继而维持剂量0.1 μg·kg-1· min-1至术后24 h方案,在颅内破裂动脉瘤介入治疗术中预防性应用是安全、有效的,也许可作为术中负荷剂量抗血小板口服药物的一种替代方案。
[1]Vinuela F,Duckwiler G,Mawad M.Guglielmi detachable coil embolizationofacuteintracranialaneurysm:perioperative anatomical and clinical outcome in 403 patients.1997[J].J Neurosurg,2008,108:832-839.
[2]Workman MJ,Cloft HJ,Tong FC,et al.Thrombus formation at the neck of cerebral aneurysms during treatment with guglielmi detachable coils[J].AJNR Am J Neuroradiol,2002,23:1568-1576.
[3]余天垒,于耀宇,李延良,等.Enterprise支架与Solitaire支架辅助弹簧圈栓塞治疗颅内复杂动脉瘤疗效分析[J].中国临床神经外科杂志,2014,19:651-653.
[4]Baptista T,Braz A,Patricio M,et al.Thromboembolic complications during endovascular treatment of ruptured intracranial aneurysmsprevention and therapy[J].Acta Med Port,2012,25:25-29.
[5]Dumont AS,Dumont RJ,Chow MM,et al.Cerebral vasospasm after subarachnoid hemorrhage:putative role of inflammation[J]. Neurosurgery,2003,53:123-133.
[6]Ikeda K,Asakura H,Futami K,et al.Coagulative and fibrinolytic activation in cerebrospinal fluid and plasma after subarachnoid hemorrhage[J].Neurosurgery,1997,41:344-349.
[7]Vermeulen M,Van Vliet HH,Lindsay KW,et al.Source of fibrin/fibrinogen degradation products in the CSF after subarachnoid hemorrhage[J].J Neurosurg,1985,63:573-577.
[8]Yi HJ,Gupta R,Jovin TG,et al.Initial experience with the use of intravenous eptifibatide bolus during endovascular treatment of intracranial aneurysms[J].AJNR Am J Neuroradiol,2006,27:1856-1860.
[9]Harder S,Klinkhardt U,Alvarez JM.Avoidance of bleeding during surgery in patients receiving anticoagulant and/or antiplatelet therapy:pharmacokinetic and pharmacodynamic considerations[J].Clin Pharmacokinet,2004,43:963-981.
[10]Giordano A,D'angelillo A,Romano S,et al.Tirofiban induces VEGF production and stimulates migration and proliferation of endothelial cells[J].Vascul Pharmacol,2014,61:63-71.
[11]No authors listed.Effects of platelet glycoproteinⅡb/Ⅲa blockade with tirofiban on adverse cardiac events in patients with unstable anginaoracutemyocardialinfarctionundergoingcoronaryangioplasty.The RESTORE Investigators.Randomized Efficacy Study of Tirofiban for Outcomes and REstenosis[J].Circulation,1997,96:1445-1453.
[12]Geeganage CM,Sprigg N,Bath MW,et al.Balance of symptomatic pulmonary embolism and symptomatic intracerebral hemorrhage with low-dose anticoagulation in recent ischemic stroke:a systematic review and meta-analysis of randomized controlled trials[J]. J Stroke Cerebrovasc Dis,2013,22:1018-1027.
[13]Kwiatt ME,Patel MS,Ross SE,et al.Is low-molecular-weight heparin safe for venous thromboembolism prophylaxis in patients with traumatic brain injury?A Western Trauma Association multicenter study[J].J Trauma Acute Care Surg,2012,73:625-628.
[14]Steinhubl SR,Talley DJ,Braden BA.Point-of-care measured platelet inhibition correlates with a reduced risk of an adverse cardiac event after percutaneous coronary intervention:results of the Gold(AU-Assessing Ultegra)multicenter study[J].ACC Curr J Rev,2001,10:59-60.
[15]McClellan KJ,Goa KL.Tirofiban.A review of its use in acute coronary syndromes[J].Drugs,1998,56:1067-1080.
[16]Müller I,Seyfarth M,Rüdiger S,et al.Effect of a high loading dose of clopidogrel on platelet function in patients undergoing coronary stent placement[J].Heart,2001,85:92-93.
[17]Vilahur G,Choi BG,Zafar MU,et al.Normalization of platelet reactivity in clopidogrel-treated subjects[J].J Thromb Haemost, 2007,5:82-90.
[18]Chalouhi N,Jabbour P,Kung D,et al.Safety and efficacy of tirofiban in stent-assisted coil embolization of intracranial aneurysms[J]. Neurosurgery,2012,71:710-714.
[19]Walsh RD,Barrett KM,Aguilar MI,et al.Intracranial hemorrhage following neuroendovascular procedures with abciximab is associated with high mortality:a multicenter series[J].Neurocrit Care,2011,15:85-95.
[20]Amenta PS,Dalyai RT,Kung D,et al.Stent-assisted coiling of wide-necked aneurysms in the setting of acute subarachnoid hemorrhage:experience in 65 patients[J].Neurosurgery,2012,70:1415-1429.
[21]Ries T,Buhk JH,Kucinski T,et al.Intravenous administration of acetylsalicylic acid during endovascular treatment of cerebral aneurysms reduces the rate of thromboembolic events[J].Stroke,2006,37:1816-1821.
[22]崔艳蜂,徐浩,祖茂衡,等.Solitaire AB支架在辅助栓塞颅内宽颈动脉瘤中的临床应用[J].介入放射学杂志,2013,22:617-620.
[23]黄志伟,李学东,覃军,等.Solitaire AB支架辅助栓塞颅内动脉瘤临床随访研究[J].介入放射学杂志,2015,24:282-286.
The prophylactic application of tirofiban in interventional treatment for ruptured intracranial aneurysms:a clinical research
LIANG Xiao-dong,WANG Zi-liang,LI Tian-xiao,HE Ying-kun,ZHAO Tong-yuan,XU Gang-qin,WANG Yong-feng,ZHOU Teng-fei,SHAO Qiu-ji.Interventional Therapy Center,Henan Provincial People's Hospital,People's Hospital of Zhengzhou University,Zhengzhou,Henan Province 450003,China
LI Tian-xiao,E-mail:dr.litianxiao@vip.163.com
ObjectiveTo evaluate the safety and efficacy of the prophylactic use of tirofiban in endovascular treatment of ruptured intracranial aneurysms.MethodsThe clinical data of 208 patients with ruptured intracranial aneurysm,who were admitted to Henan Provincial People's Hospital during the period from January 2012 to November 2014 to receive interventional embolization therapy and intra-operative infusion of tirofiban,were retrospectively analyzed.The application scheme of tirofiban was as follows:before the deployment of stent or after the complete of simple coil embolization,a load dose of tirofiban was intravenously administrated(8.0 μg/kg,injection in 3 min),which was followed by a maintenance dose(0.1 μg/kg/min)lasting for 24 hours.Loading dose of antiplatelet drugs was orally given two hours before the cessation of tirofiban infusion.Events of intracranial hemorrhage and thromboembolism related to tirofiban were recorded and the results were analyzed.ResultsOf the 208 patients,stent-assisted coil embolization was performed in 166(79.81%)and simple coil embolization in 42(20.19%).Tirofiban-related intracranial hemorrhage occurred in 4 patients(1.92%),all of the 4 patients received stent-assisted coil embolization;during the operation hemorrhage occurred in 3 patients(1.44%)and after the operation in 1 patients(0.48%). Thromboembolic events occurred in 6 patients(2.88%),among them stent-assisted coil embolization was employed in 5 patients and simple coil embolization in one patient;the thromboembolic events occurred during the operation in one patient(0.48%)and after the operation when postoperative use of tirofiban wasstill maintained in 5 patients(2.40%).ConclusionIn interventional embolization treatment for ruptured intracranial aneurysms,intravenous infusion of a load dose of tirofiban followed by a maintenance dose of tirofiban is safe and effective.(J Intervent Radiol,2015,24:1034-1038)
tirofiban;intracranial aneurysm;rupture;prophylaxis;antiplatelet;hemorrhage;thromboembolism
R743.3
A
1008-794X(2015)-12-1034-05
2015-05-22)
(本文编辑:边佶)
10.3969/j.issn.1008-794X.2015.12.002
450003郑州大学人民医院(河南省人民医院)介入治疗中心
李天晓E-mail:dr.litianxiao@vip.163.com
