细菌群体感应及其在病原菌防治中的应用
2015-10-25梁心琰阮海华
梁心琰 阮海华
(天津商业大学生物技术与食品科学学院,天津 300134)
细菌群体感应及其在病原菌防治中的应用
梁心琰 阮海华
(天津商业大学生物技术与食品科学学院,天津 300134)
细菌分泌一种或多种化学信号分子,这些化学信号分子作为诱导因子感知和判断菌群密度和周围环境的变化。当菌群达到一定阈值时会启动一系列相关基因的表达以调控菌体的群体行为,细菌的这种生理行为称为群体感应。大量的研究表明,不同类型的细菌具有不同的群体感应系统。群体感应机制广泛存在于病原菌中,并与其侵染过程、毒力基因表达及致病性密切相关。利用这种群体感应机制作为靶点进行病原菌的防治是医学领域广泛关注的问题。在此就细菌群体感应及其在病原菌防治中的应用进行阐述。
细菌;群体感应;自身诱导因子;调控;病原菌防治
DIO: 10.13560/j.cnki.biotech.bull.1985.2015.01.005
20世纪70年代,Nealson和Hastings[1]通过研究海洋细菌费氏弧菌(Vibrio fischeri)和哈氏弧菌(Vibrio harveyi)生物发光现象发现了菌群间的交流及相互作用。90年代 Greenberg 等将这种细菌分泌小信号分子即诱导因子(Autoinducer),以及该因子在微生物小群体间共同行为转导中所起的调控作用定义为群体感应(Quorum sensing,QS)[1]。群体感应参与调控细菌的多种生理过程,如生物发光、生物膜及孢子形成、细胞分化、质粒的接合转移、运动性及胞外多糖形成等,并与致病菌毒力因子的诱导、细菌与真核生物的共生、细菌素的合成及抗菌药物的研发等与人类关系密切的细菌的生理特性相关[2]。
迄今为止,大量研究发现,介导微生物群体感应的化学信号分子主要分为3类:(1)以N-酰基高丝氨酸内酯类(Acyl-homoserine lactones,AHLs)及其衍生物作为信号分子,主要作用于革兰氏阴性菌;(2)氨基酸和短肽类(Autoinducing peptide,AIPs),主要作用于革兰氏阳性菌;(3)呋喃硼酸酯类(Furanostl borate diester),即AI-2。AI-2是由LuxS蛋白介导产生的一类信号分子,是一类种间信号分子,在革兰氏阳性菌和革兰氏阴性菌中均存在,可感知不同种属微生物间的数量进而调控其行为[3]。此外,最新研究表明,在某些细菌中还发现了一类新的信号系统AI-3,这类信号分子能产生类似肾上腺素的级联放大反应[4]。
1 群体感应系统的分类
细菌群体感应系统首先由酶催化合成信号分子,信号分子经扩散或转运系统到达胞外,当累积到一定浓度后,被位于膜上的感应系统识别,引起受体蛋白的构象的变化,最终激活靶基因的表达,该表达产物能使细菌适应外界环境的变化。细菌群体感应包括种间和种内两种群体感应系统。
1.1 细菌种内的群体感应系统
1.1.1 革兰氏阴性菌的群体感应系统 革兰氏阴性菌的群体感应系统主要以N-酰基高丝氨酸内酯类及其衍生物作为信号分子[5]。AHLs由LuxI(以海洋费氏弧菌的Luciferase编码基因LUX1命名)类蛋白酶催化脂肪酸代谢途径中的酰基-酰基载体蛋白的酰基侧链与S-腺苷甲硫氨酸中高丝氨酸结合后内酯化而成,其含有高丝氨酸内酯环和一个酰胺链,酰胺链中的碳原子数(从4-18个,多为偶数,奇数中只有7)和第3位上取代基(氢、羟基和羧基)决定了该类信号分子对细菌的不同调控功能[6]。如图1所示,AHLs信号分子由一个疏水性的高保守丝氨酸内酯环的头部和一个亲水性的可变的酰胺侧链的尾部组成,可变的酰基链的尾部决定了它的多样性。AHLs带有短的酰胺侧链使其被动地进出细菌细胞壁,而带有长的酰胺侧链的AHLs靠主动转运机制跨过细菌细胞膜[7]。因此,AHLs为膜透过性分子,可跨过细菌细胞膜。当AHLs分子在环境中积累到一定浓度时,AHLs分子跨过细胞膜与胞内LuxR受体蛋白的氨基端结合,形成特定构象,使羧基端与靶DNA序列相结合,从而调控某些功能基因的表达。同时AHLs信号分子与其受体蛋白形成的复合物也对AHLs信号分子及其受体蛋白本身的产生具有反馈调节效应。

图1 LuxI-LuxR型调节系统[8]
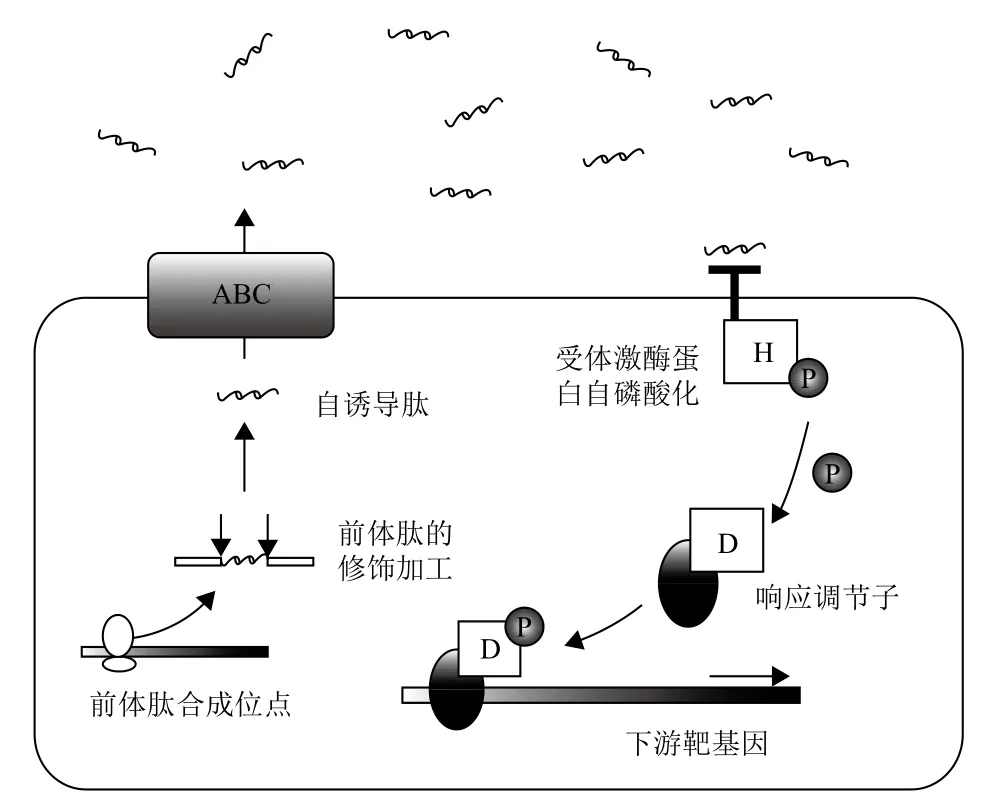
图2 革兰氏阳性菌群体感应系统[8]
1.1.2 革兰氏阳性菌的群体感应系统 革兰氏阳性菌的群体感应系统主要利用氨基酸和短肽类作为信号分子,AIPs是由体内前体肽经加工修饰后生成的成熟的寡肽信号分子,如图2所示,它不能自由穿透细胞膜,需要ABC转运系统(ATP-Binding-cassette)或其他膜通道蛋白的帮助运送到达胞外进而行使功能。这种寡肽信号AIPs随菌体浓度增加而增加,当达到一定浓度时,被位于膜上的受体激酶蛋白与AIPs信号分子识别后,促进此双组分磷酸激酶系统中的组氨酸残基磷酸化,后经天冬氨酸残基传递给受体蛋白,磷酸化的受体蛋白与DNA特定靶位结合,从而起到基因调控表达作用。
1.2 细菌种间群体感应系统
细菌除了种内的群体感应,也存在种间的群体感应。 Mok和Bassler等[9]研究发现,哈氏弧菌QS系统既能识别AHLs分子,也能识别AI-2类分子,并通过识别AI-2类分子感知自身或其他菌数量,进而调节自身行为[10]。AI-2信号分子在任何检测的菌种中均为呋喃酰硼酸二酯,这一点与AHLs和AIPs信号分子具有细菌特异性不同。细菌识别AI-2信号分子的方式与革兰氏阳性菌中双组份激酶的识别系统类似。双组份激酶识别AI-2信号分子后把磷酸化基团传递给受体蛋白并启动相关基因的表达[11]。AI-2信号分子是上下对称的双五环结构的S-腺苷甲硫氨酸。由LuxS基因编码的蛋白酶催化形成AI-2分子前体物经一系列中间反应后,最终在硼酸离子参与下形成呋喃酰硼酸二酯。因此,LuxS基因被认为是合成AI-2的标志基因,且在革兰氏阳性菌及革兰氏阴性菌中均较保守。
1.3 其他QS系统
另外,其他一些细菌基因组中含有LuxS的类似物,能产生AI-3小分子。研究表明,肠出血性大肠埃希氏菌(Enterohemorrhagic escherichia coli)的动力、黏附性及毒力基因的表达受其自身诱导物AI-3参与的QS系统调节[12]。肾上腺素/去甲肾上腺素可诱导肠出血性大肠埃希氏菌毒力基因的表达,而AI-3的作用可被肾上腺素受体拮抗剂抑制,由此可推测AI-3与肾上腺素/去甲肾上腺素结构相似。在真菌中,也有类似细菌的群体感应效应。白色念珠菌(Candida albicans)群体效应分子法尼醇(Farnesol)是真核生物中第一个被发现的群体感应分子[13]。它能通过改变宿主细胞膜通透性而增强白色念珠菌的致病性[14],还能削弱宿主细胞免疫功能[15]、调控生物膜的形成[16]、介导真菌间的相互拮抗作用[17]。另一种在白色念珠菌中发现的群体感应分子是对羟苯基乙醇(Tyrosol)。该分子与farnesol的作用相反,可促进白色念珠菌由酵母相向菌丝相的转变[18],与farnesol共同调控此转换。此外,新生隐球菌(Cryptococcus neoformans)中也有群体感应样分子QSP1(Quorum sensing like peptide,QSP1)的存在,并且发现QSP1与新生隐球菌菌落的形成有关[19]。将从正常菌株培养液上清中分离出的QSP1加入不能正常生长的Δqsp1突变菌平板中可促进该突变菌株形成正常菌落。另有研究[20]发现荚膜组织胞浆菌(Histoplasmosis capsulati)细胞壁中α-1,3葡聚糖糖苷与其致病性密切相关。体外条件下该菌接种密度对糖苷的产生具有显著影响,接种密度高合成糖苷,接种密度低则不合成糖苷。如果向低密度培养体系中加入高密度培养的上清液则低密度体系可以合成糖苷。这是由于该菌在高密度培养时释放一种相对分子量大于6 000(kD)的物质,其效应类似于细菌中的自身诱导物,可促进糖苷的合成,构成细胞的胞壁组分。目前真菌的群体感应现象研究开展尚浅,不断有新群体效应分子被发现,如在酵母(Saccharomycetes)中发现的phenylethanol和tryptophol[21]被证实也属于群体感应分子,但其理化性质及作用机制尚未明确。一旦建立真菌群体感应同致病性的联系,并明确其机制就可开发以真菌群体感应为靶点的新型抗菌药物及治疗手段。
2 细菌群体感应在病原菌防治中的应用
2.1 抑制QS系统的应用
抑制QS系统的应用主要包括3个方面:第一,控制病原菌的群体感应从而抑制致病毒素的分泌;第二,抑制QS系统的效应使病原菌难以形成对抗生素有抗性作用的生物被膜,解除病原菌的抗药性;第三,抑制病原菌的群体感应效应可调节和加强受感染者自身免疫系统的抗病能力[22]。该应用的优势包括:不会产生抗药性;具较强的专一性,即在抑制有害菌作用的过程中不会伤害有益菌,尤其是竞争性抑制剂抑制有害菌,有时甚至可以促进有益菌的生长。
2.2 抑制QS系统的途径
2.2.1 产生降解病原菌信号分子的酶,使病原菌QS系统不能启动它所控制的基因 Dong等[23]从芽孢杆菌(Bacillus)240B1中分离出能够降解AHLs的酶——AiiA。AiiA编码一个AHLs内酯水解酶来水解AHLs的内酯键,使其难以达到引发致病因子表达的临界浓度,从而使病原菌失去致病力[24]。VonBodman和Bauer等在根癌土壤杆菌(Agrobacterium tumefaciens)中发现了与AiiA类似的内酯酶——AttM[25],也能够有效减弱该菌的致病性。
2.2.2 QS系统抑制剂干扰病原菌生物被膜的形成 近年来,人们发现细菌能产生一种具有协调性、功能性和高度结构性的膜状复合物——生物被膜(Bacterialbiofilm,BF),其表面包被多聚糖基质,内部包含众多输送养料的管道。目前的研究发现近80%以上的人类细菌感染与BF的形成有关[26]。多数细菌BF的形成、发展及功能调节需QS信号分子参与[27-29]。其中,QS信号调控BF的功能主要表现在两个方面:第一,调控BF的形成,提高菌群耐药性;第二,直接参与多重耐药泵的调控,提高菌群耐药性[30]。例如,霍乱弧菌(Vibrio cholerae)和液化沙雷氏菌(Serratia liquefaciens)中QS信号分子调控被膜所需的外聚物合成和细胞聚集,并触发其他被膜相关应答从而增强其抗药性[31]。AHLs是细菌BF内的信息传递分子,对形成和维持细菌BF三维结构起着重要作用,所以不产生AHL的缺陷性菌株群体细胞极易被十二烷基磺酸钠破坏[32]。例如,Bauer等[33]通过合成化合物干扰A1分子信号进而干扰细菌的QS系统,使细菌不发生聚集并形成BF。更多的研究也证实了这一点,Geske等[34]发现对铜绿假单胞菌(Pseudomonas aeruginosa)使用铁螯合剂可对抗细菌BF的形成。Matsunaga等[35]发现多种儿茶素在亚抑菌浓度可抑制啮蚀艾肯菌(Eikenella corrodens)BF的形成。Lee等[36]报道了3-吲哚乙腈可减少大肠埃希氏菌O157∶H7细菌BF的形成。因此,通过干扰细菌QS信号来破坏细菌BF形成为解决细菌由于BF引起的细菌耐药提供了全新的思路。
2.2.3 产生病原菌信号分子的类似物与信号分子受体蛋白竞争结合 阻断病原菌的QS系统 AHLs信号分子的类似物或拮抗剂可以与AHLs竞争其胞内特异受体蛋白,破坏AHLs的调控机制,使病原菌失去致病力。海洋红藻产生的卤化呋喃酮结构和AHLs结构相似,用该卤化呋喃酮处理费氏弧菌后,其QS系统被竞争性抑制[37]。另外,吡咯酮类化合物、某些取代的HSL化合物、二酮哌嗪类化合物等也能够起到相类似的竞争性抑制的作用[38]。事实上,通过人工合成的卤代呋喃酮结构,如Manny等[39]合成的如呋喃酮56可以阻断AHLs分子与受体蛋白结合且效果显著。Hentzer等[40]用一种新的呋喃酮衍生物呋喃酮C-30作为铜绿假单胞菌的QS拮抗剂,抑制了编码多药外排泵和毒力因子基因的表达。Daniels等[41]的研究亦显示,一些卤代呋喃酮化合物还能抑制AI-2分子介导的QS信号系统。实际上除了卤代呋喃酮,许多呋喃酮衍生物同样具有群感效应的拮抗作用[42]。目前呋喃类化合物及其衍生物是研究较多的QS系统抑制剂,但其成分复杂且部分化合物具有细胞毒性[43],所以针对呋喃类化合物的作用还有待进一步研究。
2.2.4 利用QS系统中的信号分子来诱发宿主生物的抗性 豌豆、马铃薯、苜蓿属等植物宿主不仅能产生抑制因子干扰细菌QS系统,还能产生AHLs类似物激活QS系统。Schuhegger等[44]研究发现番茄根际可产AHLs的细菌的存在可以诱导植物水杨酸和乙烯依赖的防卫反应,使植物产生对病原真菌交链孢属病菌(Alternaria)的系统诱导抗性。这证明细菌QS系统的信号分子确实能够诱发植物的一些反应,也为植物抗病性研究提供了新的思路。
另外,还可通过其他方式利用细菌群体感应防治病原菌。Lwewnza等[45]研究发现洋葱伯克霍尔德菌能借助铜绿假单胞菌产生的AHL物质来控制自身的致病性。作为微生态治疗制剂的益生菌乳酸杆菌(Lactobacillus)、粪链球菌(Streptococcus faecalis)、芽孢杆菌(Bacillus cohn,1872)、双歧杆菌(Bifidobacterium)和酵母菌可产生过氧化氢、有机酸、杀菌素和抗生素等,对病原菌有明显的生物拮抗作用。Brackman等[46]将具有QS抑制活性的物质与抗生素联用,发现QS抑制剂可提高生物被膜细菌对药物的敏感性,揭示了这种联用方式可能是未来治疗的一种趋势。
3 结语
从发现至今,细菌间交流、联系及在真核细胞侵染中发挥重要作用的QS系统愈来愈被世界各国的研究者所重视。掌握并有效地利用其机制来控制病原菌生物膜的形成、毒力因子的产生、细菌间基因交换等功能无疑为抵御细菌致病、感染、病原菌监测诊断和细菌耐药性研究提供了一条新的途径,同时也为QS机制全方位应用于生物技术领域提供了条件,因而具有极为广阔的前景。
[1]Nealson KH, Hastings JW. Bacterial bioluminescence:its control and ecological significance[J]. Microbiol Rev, 1979, 43(4):496-518.
[2]梁燕, 王志钢. 细菌的群体感应及与病原菌致病性的关系[J].生物技术通报, 2011(6):35-39.
[3]Atkinson S, Williams P. Quorum sensing and social networking in the microbial world[J]. J R Soc Interface, 2009, 6(40):959-978.
[4]Walter M, Sperandio V. Quorum sensing in Escherichia coli and Salmonella[J]. Int J Med Microbiol, 2006, 296(2-3):125-131.
[5]李晓玲, 王玥莹, 罗联响, 等. 天然产物抗细菌的群体感应系统的研究进展[J]. 广东医学院院报, 2013, 31(5):593-596.
[6]Miller MB, Bassler BL. Quorum sensing in bateria[J]. Annu Rev Microbiol, 2001, 55:165-199.
[7]张晓兵, 府伟灵. 细菌群体感应系统研究进展[J]. 中华医院感染学杂志, 2010, 20(11):1639-1642.
[8] 陶金莉, 迟莉丽, 沈亚领, 等.细菌的群体行为调控机制-Quorum sensing[J]. 微生物通报, 2004, 31(4):106-110.
[9] Mok KC, Wingreen NS, Bassler BL. Vibrio harveyi quorum sensing:a coincidence detector for two controls gene expression[J]. EMBO J, 2003, 22(4):870-881.
[10] 郭静, 李慕岩, 孙明, 等. 细菌的群体感应及其研究进展[J].国际检验医学杂志, 2012, 33(1):1964-1977.
[11] Antunes LC, Ferreira RB. Intercellular communication in bacteria[J]. Crit Rev Microbiol, 2009, 35(2):69-80.
[12] Kendall MM, Sperandio V. Quorum sensing by enteric pathogens[J]. Curr Opin Gastroenterol, 2007, 23(1):10-15.
[13] Hornby JM, Jensen EC, Lisec AD, et al. Quorum sensing in the dimorphic fungus Candida albicans is mediated by farnesol[J]. Appl Environ Microbiol, 2001, 67(7):2982-2992.
[14] Nickerson KW, Atkin AL, Hornby JM. Quorum sensing in dimorphic fungi:farnesol and beyond[J]. Appl Environ Microbiol, 2006, 7(6):3805-3813.
[15] Navarathna DH, Nickers on KW, Duhamel GE, et al. Exogenous farnesol interferes with the normal progression of cytokine expression during candidiasis in a mouse model[J]. Infect Immun,2007, 75(8):4006-4011.
[16] Ramage G, Saville SP, Wickes BL, et al. Inhibition of Candida albicans biofilm formation by farnesol, a quorum-sensing molecule[J]. Appl Environ Microbiol, 2002, 68(11):5459-5463.
[17] Semighini CP, Hornby JM, Dumitru R, et al. Farneso-linduced apoptosis in Aspergillus nidulans reveals a possible mechanism for antagonistic interactions between fungi[J]. Mol Microbiol, 2006,59(3):753-764.
[18] Chen H, Fujita M, Feng Q, et al. Tyrosol is a quorum-sensing molecule in Candida albicans[J]. Proc Natl Acad Sci USA,2004, 101(14):5048-5052.
[19] Lee H, Chang YC, Nardone G, et al. TUP1 disruption in Cryptococcus neoformans uncovers a peptide-mediated density-dependent growth phenomenon that mimics quorum sensing[J].Mol Microbiol, 2007, 64(3):591-601.
[20] Kügler S, Schurtz ST, Groppe EL, et al. Phenotypic variation and intracellular parasitism by histoplasma Capsulatum[J]. Proc Natl Acad Sci USA, 2000, 97(16):8794-8798.
[21] Chen H, Fink GR. Feedback control of morphogenesis in fungi by aromatic alcohols[J]. Genes Dev, 2006, 20(9):150-161.
[22]Boyen F. Quorum sensing in veterinary pathogens:mechanisms,clinical importance and future perspectives[J]. Vet Microbiol,2009, 135(3-4):187-195.
[23] Dong YH, Xu JL, Li XZ, et al. AiiA, an enzyme that inactivates the acylhomoserine lactone quorum-sensing signal andattenuates the virulence of Erwinia carotovora[J]. Proc Natl Acad Sci USA,2000, 97(7):3526-3531.
[24] Gotz C, Fekete A, Gebefuegi I, et al. Uptake, degradation and chiral discrimination of N-acyl-D/L-homoserine lactones by barley(Hordeum vulgare)and yam bean(Pachyrhizus erosus)plants[J]. Anal Bioanal Chem, 2007, 389(5):1447-1457.
[25] Von Bodman SB, Bauer WD, Coplin DL.Quorum sensing in plantpathogenic bacteria[J].Annu Rev Phytopathol, 2003, 41:455-482.
[26] Palmer RJ Jr, Stoodley P. Biofilms 2007:Broadened horizons and new emphases[J]. J Bacteriol, 2007, 189(22):7948-7960.
[27] Sakuragi Y1, Kolter R. Quorum-sensing regulation of the biofilm matrix genes(pel)of Pseudomonas aeruginosa[J]. J Bacteriol,2007, 189(14):5383-5386.
[28] Ahmed NA, Petersen FC, Scheie AA. AI-2 quorum sensing affects antibiotic susceptibility in Streptococcus anginosus[J]. J Antimicrob Chemother, 2007, 60(1):49-53.
[29] Davies D. Understanding biofilm resistance to antibacterial agents[J]. Nat Rev Drug Discov, 2003, 2(2):114-122.
[30] 朱艮苗, 杨维青.群体感应系统对细菌耐药的调控作用[J].中国抗生素杂志, 2011, 36(1):7-10.
[31] de Kievit TR, Iglewski BH. Bacterial quorum sensing in pathogenic relationships[J]. Infect and Immun, 2000, 68(9):4839-4849.
[32] Horton RE, Grant GD, Matthews B, et al. Quorum sensing negatively regulates multinucleate cell formation during intracellular growth of Burkholderia pseudomallei in macrophage-like cells[J]. PLoS One, 2013, 8(5):e63394.
[33] Bauer WD, Robinson JB.Disruption of bacterial quorum sensing by other organisms[J]. Curr Opin Biotechnol, 2002, 13(3):234-237.
[34] Geske GD, Wezeman RJ, Siegel AP, et al.Small molecule inhibitors of bacterial quorum sensing and biofilm formation[J]. J Am Chem Soc, 2005, 127(37):12762-12763.
[35] Matsunaga T, Nakahara A, Minnatul KM, et al. The inhibitory effects of catechins on biofilm formation by the periodontopathogenic bacterium, Eikenella corrodens[J]. Biosci Biotechnol Biochem,2010, 74(12):2445-2450.
[36] Lee JH, Cho MH, Lee J. 3-indolylacetonitrile decreases Escherichia coli O157:H7 biofilm formation and Pseudomonasaeruginosa Virulence[J]. Environ Microbiol, 2011, 13(1):62-73.
[37] Givskov M, Manefield M. Eukaryotic interference with homoserine lactone-mediated prokaryotic signalling[J]. J Bacteriol, 1996,178(22):6618-6622.
[38] 郭嘉亮, 陈卫民. 细菌群体感应信号分子与抑制剂研究进展[J]. 生命科学, 2007, 19(2):224-232.
[39] Manny AJ, Kjelleberg S, Kumar N, et al. Reinvestigation of the sulfuric acid-catalysed cyclisation of brominated 2-alkyllevulinic acids to 3-alkyl-5-methylene-2(5H)-furanones[J]. Tetrahedron, 1997, 53(46):15813-15826.
[40] Hentzer M, Wu H, Andersen JB, et al. Attenuation of Pseudomonas aeruginosa virulence by quorum sensing inhibitors[J]. EMBO J,2003, 22(15):3803-3815.
[41] Daniels R, Vanderleyden J, Michiels J. Quorum sensing and swarming migration in bacteria[J]. Microbiol Rev, 2004, 28(3):261-289.
[42] Shobharani P, Agrawal R. Interception of quorum sensing signal molecule by furanone to enhance shelf life of fermented milk[J]. Food Control, 2010, 21(1):61-69.
[43] Kuehl R, AI-Bataineh S, Gordon O, et al. Furanone at subinhibitory concentrations enhances Staphylococcal biofilm formation by LuxS repression[J]. Antimicrob Agents Chemother, 2009, 53(10):4159-4166.
[44] Schuhegger R, Ihring A, Gantner S, et al. Induction of systemic resistance in tomato by N-acyI-L-homoserine Laetone-producing rhizosphere bacteria[J]. Plant Cell Environ, 2006, 29(5):909-918.
[45] Lewenza S, Conway B, Greenberg EP, et al. Quorum sensing in Burkholderia cepacia: identification of the LuxRI homologs CepRI[J]. J Bacteriol, 1999, 181(3):748-756.
[46] Brackman G, Cos P, Maes L, et al. Quorum sensing inhibitors increase the susceptibility of bacterial biofilm to antibiotics in vitro and in vivo[J]. Antimicrob Agents Chemother, 2011, 55(6):2655-2661.
(责任编辑 狄艳红)
Quorum Sensing and Its Application in Preventing and Therapeutic Effect for Pathogenic Bacteria
Liang Xinyan Ruan Haihua
(Department of Biotechnology and Food Science,Tianjin University of Commerce,Tianjin 300134)
Bacteria releases one or several chemical molecules served as signal to estimate the density of bacteria and sense the change of environment. This chemical communication, called as “quorum sensing”(QS)is defined as a density dependent mechanism by which bacteria coordinate expression of specific target genes in response to a critical concentration of signal molecules. A many of studies had showed that the construction of various QS system depends on the type of bacteria. QS system exists widely in pathogenic bacteria, which build up the capability of infection, expression of toxic genes and pathogenesis. Therefore, it is a concerned topic in medicine realm that prevents and cures the diseases caused by pathogenic bacteria by targeting the QS system. Here, this review discussed the QS and its application in preventing and therapeutic effect for pathogenic bacteria.
bacteria;quorum sensing;autoinducer;control;pathogen therapeutic
2014-07-14
国家自然科学基金项目(81101220),天津市应用基础与前沿研究计划项目(12JCQNJC08100),“十二五”综投天津市高校中青年骨干创新人才支持计划,天津市创新团队建设项目(TD12-5049)
梁心琰,女,研究方向:微生物与发酵;E-mail:liangxinyanmm@163.com
阮海华,女,博士,副教授,研究方向:微生物与基因工程;E-mail:ruanhaihua@tjcu.edu.cn
