苏云金芽胞杆菌chiA73基因的克隆、表达和酶活性分析
2015-10-25张圆周国旺李海涛刘荣梅赵一夔高继国
张圆 周国旺 李海涛 刘荣梅 赵一夔 高继国
(东北农业大学生命科学学院,哈尔滨 150030)
苏云金芽胞杆菌chiA73基因的克隆、表达和酶活性分析
张圆 周国旺 李海涛 刘荣梅 赵一夔 高继国
(东北农业大学生命科学学院,哈尔滨150030)
旨在对苏云金芽胞杆菌几丁质酶基因进行分子鉴定和酶活测定,从产几丁质酶活力高的Bt DLD171菌株中提取基因组DNA,通过PCR法克隆得到几丁质酶chiA73 基因(GenBank登录号为KJ508093)。结果显示,对chiA73 基因进行表达,获得大小约74 kD的表达产物。用荧光底物对表达产物进行酶活测定,发现表达产物只能水解荧光底物4-甲基伞形酮几丁三糖[4-MU-(GlcNAc)3],而不能水解4-甲基伞形酮几丁单糖(4-MU-GlcNAc)。结果表明,ChiA73为一种内切几丁质酶,在pH值为8、温度为40℃时酶活性最高。
苏云金芽胞杆菌;几丁质酶;chiA73;荧光底物;酶活性
在自然界中,除纤维素外,几丁质是存在最广泛的有机化合物。几丁质是由N-乙酰-D-氨基葡萄糖(GlcNAc)以β-1,4糖苷键连接而成的高分子聚合物[1],它可以与蛋白质结合形成多种组织结构,如许多无脊椎动物的外骨骼、大多数真菌和藻类的细胞壁[2]。此外,几丁质蛋白复合物是围食膜的重要组成部分,围食膜是昆虫防止病原侵入的一道天然屏障[3]。近期研究发现由于几丁质及其衍生物具有无毒的生物降解性和生物相容性,因此被广泛应用于食品、制药和生物技术等行业[4]。
几丁质酶是细菌、真菌、昆虫、植物和动物体内普遍合成的一种具有生物催化活性的水解酶类[5],它能特异地催化水解几丁质的 β-1,4-糖苷键生成 N-乙酰-D-氨基葡萄糖。几丁质酶的作用十分广泛,不仅用于甲壳素衍生物的生产,而且用于控制植物病原真菌的代谢,以及增强苏云金芽胞杆菌的杀虫活性[6,7]。由细菌产生的几丁质酶主要分为两大类:一类为内切几丁质酶(endochitinase,EC3.2.1.14),此类酶可随意裂解几丁质和几丁质寡聚物并释放出可溶性低分子量混合物;另一类为外切几丁质酶(exochitinase),分为两个亚类:一类为几丁二糖酶(chitobiosidase,EC3.2.1.29),可从非还原端裂解几丁质和几丁质寡聚物,释放的最终产物主要是二乙酰几丁二糖[(GlcNAc)2];另一类为N-乙酰氨基葡萄糖苷酶(N-acetylglucosaminidases,EC3.2.1.30),同几丁二糖酶一样可从非还原端裂解几丁质和几丁质寡聚物,释放N-乙酰葡糖胺单体(GlcNAc),它也是唯一可以水解(GlcNAc)2的酶[8-10]。
苏云金芽胞杆菌(Bacillus thuringiensis,Bt)因为对多种害虫具有毒杀作用而一直为人们所关注,目前已有十多个亚种的苏云金芽胞杆菌被证明能产生几丁质酶。目前,对Bt几丁质酶的研究已经从最初的酶的分离纯化发展到几丁质酶基因的克隆表达,从对产几丁质酶菌株的筛选发展到几丁质酶的定向改造,但这些过程均与酶活性的检测紧密相连。目前,大多数报道采用DNS方法测定几丁质酶活性[11,12],本研究在完成对苏云金芽胞杆菌DLD171菌株中几丁质酶chiA73基因克隆表达的基础上,采用荧光底物对表达产物进行酶活测定[19],旨在为几丁质酶的后期开发利用提供参考。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒 Bt DLD171菌株由本实验室自己分离得到,表达菌株E. coli Rosetta(DE3)与载体pEB由本实验室自己保存。
1.1.2 培养基 液体LB培养基:胰蛋白胨10 g、酵母提取物5 g、氯化钠10 g、蒸馏水1 000 mL,pH7.0。固体LB培养基:在液体LB培养基中加13 g/L的琼脂。固体1/2LB培养基:胰蛋白胨5 g、酵母提取物2.5 g、氯化钠5 g、琼脂13 g、蒸馏水1 000 mL,pH7.0。
几丁质酶诱导固体培养基[13]:(NH4)2SO43 g、K2HPO40.7 g、KH2PO40.3 g、MgSO4·7H2O 0.5 g、FeSO4·H2O 0.5 g、胶体几丁质3 g、酵母粉3 g、琼脂13 g、蒸馏水 1 000 mL,pH7.2。
几丁质酶发酵培养基[8]:蛋白胨2 g、酵母提取物 2 g、K2HPO40.7 g、KH2PO40.3 g、MgSO4·7H2O 0.5 g、FeSO4·H2O 0.5 g、细粉几丁质12 g、蒸馏水1 000 mL,pH6.8。
1.2 方法
1.2.1 几丁质酶产酶菌的筛选 几丁质酶的筛选通过水解圈法进行,将Bt菌株直接接种在几丁质诱导固体培养基上,观察其生长情况和水解圈的有无[14]。
1.2.2 晶体形态观察 将Bt菌株DLD171在1/2LB培养基上培养48 h后,将胞晶混合液滴于载玻片上,涂抹均匀,烘干固定,石炭酸复红染液染色3 min,清水冲洗,100×油镜进行镜检[15]。
1.2.3 几丁质酶基因的克隆和测序 Bt DLD171菌株在LB培养基中培养,提取基因组DNA。使用引物上游序列(5'-ATGGCTATGAGGTCTCAAAAATT-3')和下游序列(5'-CTAGTTTTCGCTAATGACGGC-3')扩增几丁质酶基因[16],引物设计基于chiA HD-73的全长序列[19]。PCR扩增时使用KOD高保真酶,PCR反应程序:94℃ 2 min;98℃ 10 s,52℃ 30 s,68℃ 2 min,30个循环;最后68℃延伸10 min。将扩增产物进行纯化并与pEB载体连接,转化到E. coli Rosetta(DE3)中[17]。提取质粒,送至北京金维智公司进行测序。
1.2.4 基因诱导表达及SDS-PAGE分析 将重组的大肠杆菌菌株进行诱导表达,诱导条件为:IPTG 1 mg/mL,30℃,150 r/min,震荡培养6 h。将诱导的培养液在4 000 r/min的条件下离心5 min并收集菌体,用预冷的20 mmol/L Tris-HCl(pH8.0)悬浮菌体两次。最后用2 mL 20 mmol/L Tris-HCl(pH8.0)悬浮菌体,并在冰水混合物中超声波破碎菌体,超声时工作3 s,间歇3 s,将破碎完全的菌液离心取上清备用[18]。
1.2.5 几丁质酶活性测定 挑取Bt单菌落于5 mL LB试管中,30℃、220 r/min振荡培养12 h后,按1%的接种量接种在几丁质酶发酵培养基中,30℃、220r/min振荡培养5 d。将培养物在4℃、12 000 r/min条件下离心20 min取上清备用。使用荧光几丁质低聚糖进行几丁质酶活性测定,4-甲基伞形酮几丁三糖[4-MU-(GlcNAc)3]和4-甲基伞形酮几丁单糖(4-MU-GlcNAc)作为反应底物。使用的酶液为上述表达的几丁质酶和Bt直接发酵的酶,测定体系为:荧光底物10 μL,几丁质酶10 μL,磷酸缓冲液(pH7)580 μL,37℃反应1 h后加入600 μL Na2CO3终止反应[20]。使用荧光分光光度计(LS45)对反应产物进行荧光测定,测定时仪器的参数设为激发光340 nm和发射光415 nm,用于测量4-甲基伞型酮(4-methylumbelliferone)发出的荧光。为了量化这种酶,一个酶活力单位定义为在1 h释放1 μmol的4-methylumbelliferone 所需的酶量[19]。每个实验一次平行3次,整个实验重复3次。
1.2.6 pH值和温度对几丁质酶活力的影响 用4-MU-(GlcNAc)3作为底物,测定表达的几丁质酶ChiA73的最适pH,缓冲溶液为pH 4-10的柠檬酸-磷酸氢二钠缓冲溶液。在最适pH时,使用4-MU-(GlcNAc)3作为底物测定ChiA73在温度为20-80℃时酶活性的大小。每个实验一次平行3次,整个实验重复3次。
2 结果
2.1 晶体形态观察
BtDLD171菌株产生的晶体形态,光学显微镜(图1)下箭头所示,从左到右依次为菌体、芽胞和晶体。
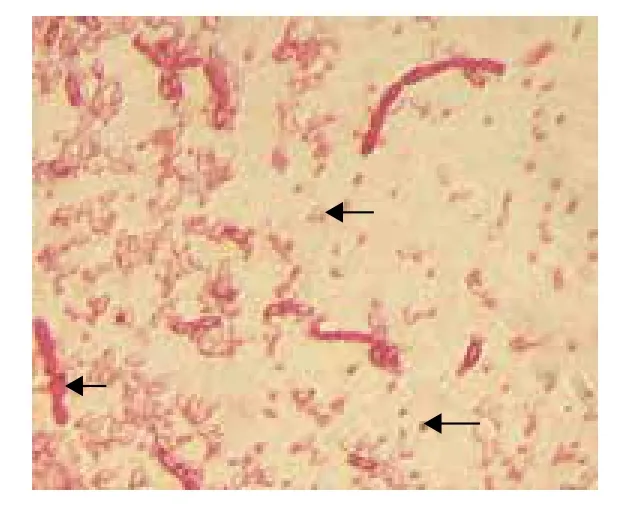
图1 Bt DLD171的光学显微镜图片
2.2 几丁质酶基因chiA73的克隆和序列分析
PCR扩增结果(图2)所示,将测序结果提交到GenBank,获得登录号为KJ508093。并将其命名为chiA73,几丁质酶chiA73序列全长为2 031 bp,编码676个氨基酸残基。chiA73与其他来源于GenBank报道的Bt几丁质酶基因有94%-99%的相似度。
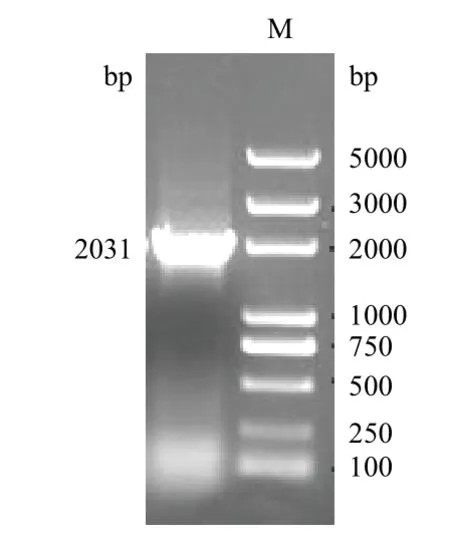
图2 chiA73基因扩增结果
2.3 几丁质酶ChiA73蛋白结构分析
使用SignalP(http://www.cbs.dtu.dk/services/Sig nalP/)分析结果(图3)表明,几丁质酶ChiA73的切割位点在Ala-34和Asp-35之间,催化区域由Gly-147 到Ser-222共76个氨基酸组成,粘蛋白III型同源区(FN3)由Ile-479到Thr-574共96个氨基酸组成,几丁质结合域(CBD)由Val-587 到Lys-629共43个氨基酸组。
2.4 chiA73在大肠杆菌中的表达
对chiA73基因进行诱导表达,提取蛋白并进行SDS-PAGE电泳检测。结果(图4)显示,表达产物的大小约74 kD。以空质粒 pEB 转入 Rosetta(DE3)菌株作为阴性对照,未发现74 kD的蛋白,说明在大肠杆菌中成功表达了几丁质酶ChiA73。
2.5 原菌发酵液与表达蛋白ChiA73的活性检测
用两种荧光几丁质低聚糖作为底物对几丁质酶酶活进行测定,结果(表1)显示,在pH值为7时,原菌发酵液对4-MU-(GlcNAc)3具有较高的水解活性,同时对4-MU-GlcNAc具有一定的水解活性。表达的几丁质酶ChiA73只对4-MU-(GlcNAc)3具有高的水解活性,对4-MU-GlcNAc没有水解活性。E. coli DE3自身的蛋白未检测到水解活性。结果表明原菌发酵液不仅具有内切几丁质酶活性,还具有N-乙酰氨基葡萄糖酶活性。而表达的几丁质酶ChiA73只具有内切几丁质酶活性,说明几丁质酶ChiA73是一种内切几丁质酶。

图3 ChiA73的氨基酸序列
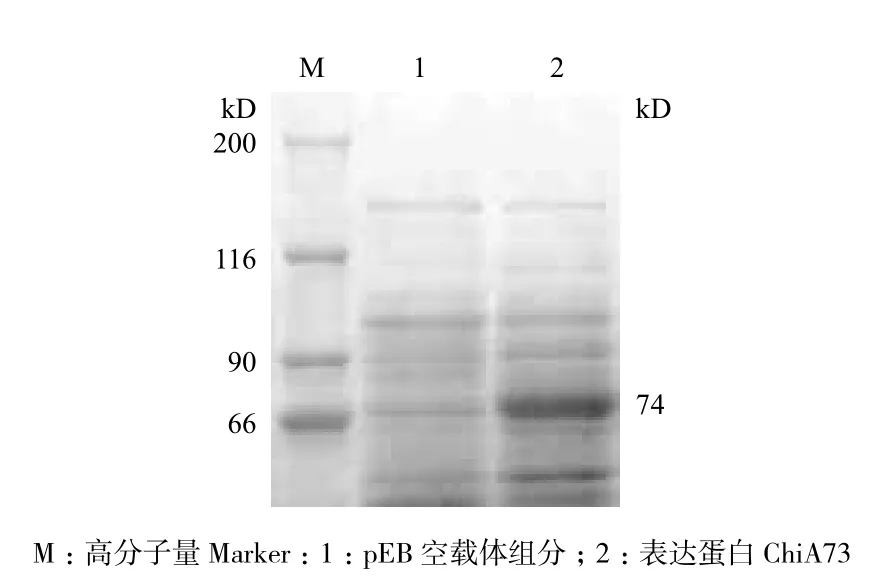
图4 ChiA73表达蛋白SDS-PAGE电泳
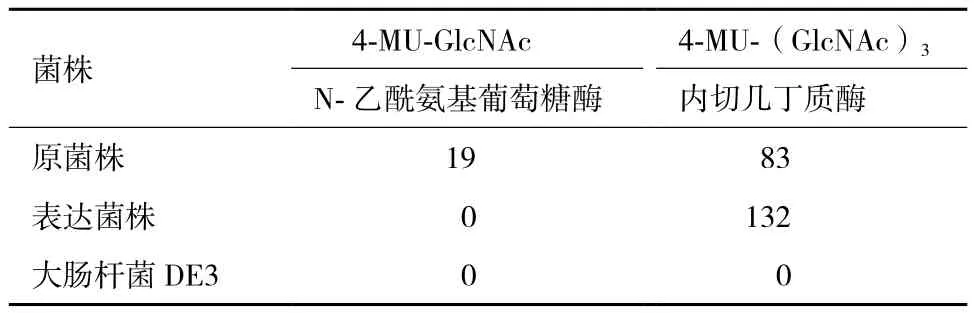
表1 不同底物下几丁质酶的活性分析/(U·m L-1)
2.6 pH值和温度对几丁质酶ChiA73活性的影响
在37℃下,改变酶活测定体系的pH值,结果(图5-A)显示,在pH 4-10范围内,几丁质酶均具有一定活性,pH为8时酶活性最高。在pH为8时,改变测活体系的反应温度,结果(图5-B)显示,在温度20-80℃范围内几丁质酶均有活性,在40℃时几丁质酶酶活性最高。
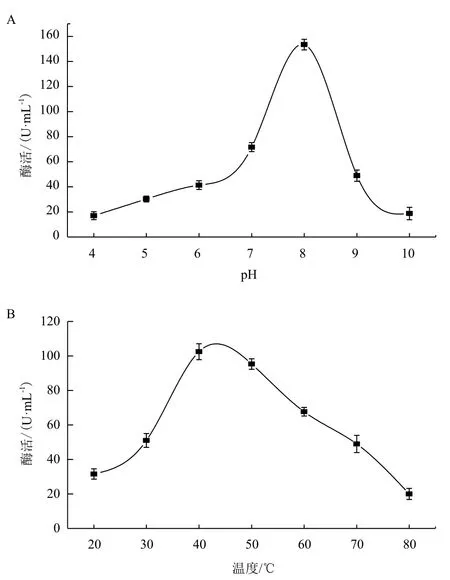
图5 pH(A)和温度(B)对内切几丁质酶活性的影响
3 讨论
几丁质酶酶活的检测方法有很多种,如DNS试剂检测法,此方法可快速测定几丁质酶总酶活,但无法测定单个几丁质酶的活性,更不能用于鉴定几丁质酶的种类[12]。而使用荧光几丁质低聚糖对几丁质酶酶活进行测定,可以弥补DNS试剂检测法的不足。最为常用的荧光剂是4-甲基伞形酮,此方法区分3种几丁质酶的原理为:内切几丁质酶能水解4-MU-(GlcNAc)3但不能水解4-MU-GlcNAc;只有N-乙酰氨基葡萄糖酶可以水解4-MU-GlcNAc;而几丁二糖酶只能水解4-MU-(GlcNAc)2生成4-甲基伞形酮[21]。本研究从Bt DLD171菌株中克隆得到几丁质酶基因ChiA73,并证实ChiA73为一种内切几丁质酶,这与Barboza-Corona等[19]对ChiA-HD73的鉴定结果一致。
几丁质酶ChiA73由信号肽、催化区、粘蛋白III型同源区和几丁质结合区4个结构域组成。蛋白质前体的信号肽断裂位点在Ala-34和Asp-35之间,符合革兰氏阳性细菌的断裂位点,革兰氏阴性菌的断裂位点在Leu-33和Ala-34之间。 成熟的ChiA73蛋白质在N端存在一个催化区,与糖基水解酶18家族的催化区有较高的同源性,其中Asp-207、Asp-209和Glu-211高度保守,与几丁质酶的活性相关。催化区之后是粘蛋白III型同源区,该结构域对几丁质酶与几丁质的结合作用无影响,却与胶状几丁质降解程度有关。除几丁质酶外,纤维素酶、α-淀粉酶、PHB解聚酶等也存在粘蛋白III型同源区域[22]。ChiA73蛋白质C端几丁质结合区中的Trp-591、Tyr-595和Trp-626也是高度保守的,该结构域能特异结合不可溶几丁质(如胶状几丁质或再生几丁质)及晶体几丁质。
大多数几丁质酶在偏酸的环境下酶活最高,而对ChiA73理化性质研究表明其最适pH值为8。研究表明,Bt几丁质酶可协同Bt产生的晶体蛋白进行杀虫[23],Bt在害虫体内的作用位点是昆虫中肠,而中肠液偏碱性,碱性条件下ChiA73具有较高的活性为其杀虫增效作用提供了条件。此外,Bt几丁质酶还可以抑制真菌的生长,本研究为Bt几丁质酶在生物防治及农业生产上的应用提供了参考。
4 结论
本研究从Bt DLD171菌株中克隆得到几丁质酶chiA73基因,基因序列全长为2 031 bp,编码676个氨基酸残基,分子量约为74 kD,GenBank登录号为KJ508093。将该基因在大肠杆菌 Rosetta(DE3)中表达,表达的ChiA73蛋白只具有内切几丁质酶活性,且最适pH为8、最适温度为40℃。结果表明,荧光剂4-甲基伞形酮几丁质低聚糖法是一种行之有效的几丁质酶酶活检测法,并且可以用于鉴定几丁质酶的种类。
[1] 陈少波, 吴根福. 几丁质酶研究进展[J]. 科技通报, 2004(3):258-262.
[2]Barboza-Corona JE, Nieto-Mazzocco E, Velazquez-Robledo R, et al. Cloning, sequencing, and expression of the chitinase gene chiA74 from Bacillus thuringiensis[J]. Applied and Environmental Microbiology, 2003, 69:1023-1029.
[3]李力, 黄胜元, 关雄. 产几丁质酶的苏云金杆菌菌株筛选及酶合成条件研究[J]. 中国病毒学, 2000, S1:97-100.
[4]孙慎侠, 付昌斌, 伦永志, 等. 芽胞杆菌菌株产几丁质酶发酵条件的研究[J]. 中国微生态学杂志, 2003(3):20-22.
[5]祁红兵, 刘铭, 李红敬. 产几丁质酶苏云金芽胞杆菌的筛选及其对甜菜夜蛾高毒菌株的增效活性[J]. 江苏农业科学, 2003(6):61-63.
[6]张利平. 几丁质酶及其在农业生产中的应用[J]. 浙江柑橘,2013(2):11-13.
[7]张新军, 范丽卿, 岳海梅, 等. 几丁质酶产生菌发酵条件初步研究[J]. 中国农学通报, 2010, 24:42-46.
[8]周樱, 王风平, 肖湘. 豚鼠气单胞菌CB101中几丁质酶基因的克隆及其异源表达的全酶蛋白和酶片段的功能研究[J]. 自然科学进展, 2002(8):70-74.
[9]关海宁, 徐桂花, 刁小琴. 微生物产几丁质酶的研究概况及其应用[J]. 中国食物与营养, 2006(8):33-34.
[10]Chernin L, Ismailov Z, Haran S, et al. Chitinolytic Enterobacter agglomerans antagonistic to fungal plant pathogens[J]. Applied and Environmental Microbiology, 1995, 61:1720-1726.
[11]Susuki K, Sugawara N, Susuki M, et al. Chitinases A, B, and C1 of Serratia marcescens 2170 p roduced by recombinant Escherichia coli:Enzymatic properties and synergism on chitindegradation[J]. Bioscience, Biotechnology, and Biochemistry,2002, 66:1075-1083.
[12] 魏巍, 贺淹才, 刘爱花. 几丁质酶酶活测定方法的研究进展[J]. 全国工业催化信息站, 2006, 14:11-14.
[13]檀建新, 陈忠义, 张杰, 等. 产几丁质酶菌的分离鉴定及其抑菌作用的初步研究[J]. 植物保护, 2007, 27(2):1-3.
[14]卢伟, 赵秋敏, 陈艳玲, 等. 几丁质酶在苏云金芽胞杆菌中的分布及抑小麦赤霉菌菌株的筛选[J]. 南开大学学报:自然科学版, 2007(3):97-101.
[15]Baroy F, Lecadet MM, Deleluse A. Cloning and sequencing of three new putative toxin genes from Clostridium bifermentans[J]. Gene, 1998, 211(2):293-299.
[16]乔贝贝, 裘梁, 董德刚, 等. 1株产几丁质酶菌株的鉴定[J].贵州农业科学, 2013, 41(7):132-134.
[17]宋福平, 张杰, 黄大昉, 等. 苏云金芽胞杆菌cry基因PCRRFLP鉴定体系的建立[J]. 中国农业科学, 1998, 31(3):13-18.
[18]刘东明. 苏云金芽胞杆菌新型cry1基因克隆, 表达及活性分析[D]. 哈尔滨:东北农业大学, 2011.
[19]Barboza-Corona JE, Reyes-Rios DM, Salcedo-Hernández R, et al. Molecular and biochemical characterization of an endochitinase(ChiA-HD73)from Bacillus thuringiensis subsp. kurstaki HD-73[J]. Molecular Biotechnology, 2008, 39(1):29-37.
[20]Ruiz-Sanchez A, Cruz-Camarillo R, Salcedo-Hernández R, et al. Molecular cloning andpurification of an endochitinase from Serratia marcescens(Nima)[J]. Molecular Biotechnology, 2005, 31:103-112.
[21]Chernin L, Ismailov Z, Haran S, et al. Chitinolytic enterobacter agglomerans antagonistic to fungal plant pathogens[J]. Appl Environ Microbiol, 1995, 61(5):1720-1726.
[22]蔡亚君, 袁志明, 胡晓敏, 等. 苏云金芽胞杆菌几丁质酶基因的克隆及诱导表达[J]. 湖北农业科学, 2011, 50(3):599-603.
[23]韩苗苗, 肖亮, 蔡峻, 等. 一株抑真菌、对甜菜夜蛾高效的苏云金芽胞杆菌菌株[J]. 微生物学通报, 2008, 35(11):1750-1754.
(责任编辑 马鑫)
Cloning,Expression and Enzymatic Activities of chiA73 Gene from Bacillus thuringiensis
Zhang Yuan Zhou Guowang Li Haitao Liu Rongmei Zhao Yikui Gao Jiguo
(College of Life Science,Northeast Agricultural University,Harbin150030)
In order to identify and detect chitinase activities from Bacillus thuringiensis strains, chitinase gene chiA73(GenBank accession number:KJ508093)from genomic DNA of Bt DLD171 producing high-yield chitinase was cloned by PCR. Gene of chitinase chiA73 was expressed and the weight of expression product was approximate 74 kD. The results measured by fluorogenic substrates showed that the expression product of chiA73 hydrolyzed 4-MU-(GlcNAc)3only, but not 4-MU-GlcNAc. In conclusion, the work indicated that ChiA73 was one of endochitinase, and had the highest activity at pH8 and 40℃.
Bacillus thuringiensis;chitinase;chiA73;fluorogenic substrates;enzymatic activity
10.13560/j.cnki.biotech.bull.1985.2015.08.021
2014-12-08
转基因生物新品种培育科技重大专项(2014ZX0800913B-002),国家基础科学人才培养基金资助项目(J1210069),国家高技术研究发展计划课题(2011AA10A203),国家自然科学基金项目(31401812),黑龙江省教育厅科学技术研究项目(12521021)
张圆,女,硕士,研究方向:生物防治微生物功能基因的发掘、研究和利用,E-mail:13009835138@126.com;周国旺为并列第一作者
高继国,男,博士生导师,研究方向:生物大分子的分离纯化,苏云金芽胞杆菌抗性机理、生物安全性;E-mail:gaojiguo1961@hotmail.com
