重组大肠杆菌共表达亮氨酸脱氢酶和甲酸脱氢酶发酵条件优化
2016-01-14刘维明,杨震炯,罗积杏等

重组大肠杆菌共表达亮氨酸脱氢酶和甲酸脱氢酶发酵条件优化
刘维明1,杨震炯2,罗积杏3,壮晓健3,沈文和3,胡燚1,黄和1
(1.南京工业大学生物与制药工程学院,江苏南京211800;2.浙江省永康市质量监督检测中心,
浙江永康321300;3.浙江九洲药业股份有限公司,浙江台州318000)
摘要:在摇瓶中对共表达亮氨酸脱氢酶(LeuDH)和甲酸脱氢酶(FDH)的重组大肠杆菌(E.coli)的发酵条件进行优化。首先考察基础培养基中碳、氮源种类和浓度及初始pH等因素对重组大肠杆菌生长和产酶的影响,实验结果表明甘油和酵母膏为最佳碳源和氮源,最适质量浓度均为10 g/L,培养基最适初始pH为8.0。然后对诱导条件进行优化,确定最适的诱导时机为菌体密度(OD600)达到0.6时,最适的诱导温度、诱导剂IPTG浓度和诱导时间分别为25 ℃、0.2 mmol/L和20 h。在优化后的培养条件下,菌体密度(OD600)可达8.6,LeuDH和FDH酶比酶活分别达1 543.3和2 572.4 U/L,是优化前的2.0和3.1倍。
关键词:重组大肠杆菌;亮氨酸脱氢酶;甲酸脱氢酶;诱导
doi:10.3969/j.issn.1672-3678.2015.04.005
收稿日期:2014-06-16
基金项目:国家自然科学基金杰出青年基金(21225626);国家高技术研究发展计划(863计划)(2011AA02A209);江苏高校优势学科建设工程
作者简介:刘维明(1987—),山东郯城人,博士研究生,研究方向:生物催化;黄和(联系人),教授,E-mail:biotech@njtech.edu.cn
中图分类号:Q554文献标志码:A
Optimization of fermentation conditions of recombinantE.coliforcoexpression of leucine dehydrogenase and formate dehydrogenase
LIU Weiming1,YANG Zhenjiong2,LUO Jixing3,ZHUANG Xiaojian3,SHEN Wenhe3,HU Yi1,HUANG He1
(1.College of Biotechnology and Pharmaceutical Engineering,Nanjing Tech University,Nanjing 211800,China;
2.Quality Supervision and Inspection Center of Yongkang,Yongkang 321300,China;
3.Zhejiang Jiuzhou Pharmaceutical Co.,Ltd.,Taizhou 318000,China)
Abstract:The fermentation conditions of recombinant E.coli for coexpression of leucine dehydrogenase and formate dehydrogenase were optimized in shake flasks. The effects of carbon and nitrogen source and their concentrations, as well as initial pH of medium on the cell growth and enzyme production were studied. The optimal carbon source was glycerol (10 g/L) and nitrogen source was yeast extract(10 g/L). The optimal initial pH of fermentation medium was 8.0. The induction conditions were further optimized as follows:induction occasion OD600 0.6,induction temperature 25 ℃,IPTG concentration 0.2 mmol/L and induction time 20 h. Under the optimized conditions,a high cell density(OD600)of 8.6 was obtained. The enzyme activity of LeuDH reached 1 543.3 U/L and that of FDH reached 2 572.4 U/L,which were 2.0-fold and 3.1-fold as that before optimization.
Keywords:recombinant E.coli; leucine dehydrogenase; formate dehydrogenase; induction
亮氨酸脱氢酶(leucine dehydrogenase,LeuDH,EC 1.4.1.9)是一种NAD+依赖型的氧化还原酶,在芽胞杆菌属(Bacillus)中具有较高的表达水平,首先于Bacilluscereus中被发现并纯化,此后Bacillusspec.、B.sphaerius、B.stearothermophlius、Clostridiumthermoaceticum等产LeuDH菌株相继被筛选出来[2-5]。LeuDH能够可逆地催化L-亮氨酸和支链L-氨基酸反应生成相应的α-酮酸及其类似物,可用于测定支链脂肪酸及其酮酸类似物,同时可以催化α-酮酸还原制备L-亮氨酸及L-叔亮氨酸等氨基酸[7-10]。
近年来,不同来源的LeuDH基因工程菌已成功构建[11-13],实现了LeuDH的高密度表达和规模化制备,并对其结构和功能进行了相关研究,为LeuDH的工业化应用奠定了基础。LeuDH的大规模应用需要添加NADH作为辅酶,而NADH价格昂贵,不适合工业上大量使用。因此,构建高效的辅酶再生系统是解决LeuDH规模化应用难题的关键。NAD+依赖型的甲酸脱氢酶(formate dehydrogenase,FDH,EC 1.2.1.2)属于D-2-羟基酸脱氢酶类,可以在将甲酸氧化为CO2的同时将NAD+还原为NADH,因此广泛应用于辅酶NADH的再生中[14-15]。FDH耦联的辅酶再生体系具有诸多优势,如反应不可逆且生成的副产物CO2易从反应体系中逃逸,甲酸或甲酸盐价格低廉且对酶无抑制作用,因此甲酸/FDH辅酶再生体系是目前最成功的辅酶再生系统[16],且已应用到手性化合物的工业化生产,如Degussa公司采用LeuDH催化三甲基丙酮酸不对称还原并与FDH催化的NAD+-NADH再生体系耦联,实现了L-叔亮氨酸的工业生产。
对于双酶耦联的生物催化反应体系,构建双酶共表达的基因工程菌不仅可以降低酶制备的成本,还可以提高生产效率,因此近年来相关研究报道也越来越多[9,17-19]。本实验室成员前期从Lysinibacillussphaericus基因组中扩增获得了编码LeuDH的基因leudh,并将其与来自Candidaboidinii的编码FDH的基因fdh共表达,构建了基因工程菌E.coliBL21-(LeuDH-FDH)。本文中,笔者在摇瓶中考察影响该重组菌生长和酶蛋白表达的因素,主要研究碳、氮源种类及其浓度、初始pH、诱导时机、诱导剂浓度、诱导温度和诱导时间等因素对重组E.coli菌体生长和产酶的影响,优化发酵诱导条件,以期为进一步发酵放大提供理论依据。
1材料与方法
1.1菌种
共表达LeuDH和FDH的基因工程菌E.coliBL21-(LeuDH-FDH)由笔者所在实验室构建并保藏。
1.2培养基
LB培养基(g/L):蛋白胨10、酵母提取物5,NaCl 10;pH 7.0。
发酵培养基(g/L):甘油10、酵母膏10、Na2HPO45.08、KH2PO43、K2SO42、柠檬酸三钠0.5、MgCl2·6H2O 0.4、CaCl20.011;pH 7.0。其中MgCl2·6H2O 和CaCl2单独灭菌,接种时加入至所需浓度。
当考察碳、氮源种类对发酵的影响时,将甘油和酵母膏替换为相应的营养组分即可。以上培养基灭菌均在121 ℃灭菌 20 min,接种时添加过滤除菌的氨苄青霉素(Amp)和卡那霉素(Kana)至终质量浓度50 mg/L。
1.3培养方法
种子培养:将甘油管保存的菌种按0.1%接种量接种至含Kana和Amp的LB培养基中,37 ℃、200 r/min摇床培养20 h。
发酵培养及诱导:将种子液按1%接种量接种至含Kana和Amp的发酵培养基,37 ℃、200 r/min培养至OD600达到0.6,加入诱导剂IPTG至终浓度0.2 mmol/L,降低培养温度至25 ℃,200 r/min继续培养16 h。发酵结束后,发酵液于4 ℃、12 000 r/min离心5 min,收集菌体,生理盐水(8.5%)洗涤2次,-20 ℃保存,备用。
种子培养和发酵培养在250 mL摇瓶中进行,装液量为50 mL。HYL-A型全温摇瓶柜(太仓市强乐实验设备有限公司),偏心距30 mm。
1.4分析方法
菌体密度测定:菌体密度以OD600表示,将发酵液稀释一定倍数后用紫外分光光度计于600 nm处测定吸光值。
菌体破碎液的制备:发酵所得菌体用0.1 mol/L、pH 8.5磷酸盐缓冲液悬浮,置于超声破碎仪中破碎。超声工作条件:200 W,工作5 s,间歇5 s,99个循环。破碎液于4 ℃、12 000 r/min离心10 min,取上清液用于酶活测定。
LeuDH酶活测定:NADH在340 nm处有最大吸光值,LeuDH活力通过检测反应过程中NADH在340 nm处吸光值的变化计算。于1.0 mL 磷酸盐缓冲液(100 mmol/L,pH 8.5)中加入2 mmol/L三甲基丙酮酸、0.1 mmol/L NADH和100 mmol/L NH4Cl,30 ℃保温3 min后加入10 μL酶液,迅速摇匀后记录2 min内吸光值的变化。酶活单位(U)的定义为在上述反应条件下每分钟催化1 μmol NADH氧化所需的酶量,其计算见式(1)。
(1)
式中:ΔOD为每分钟吸光值的变化,V为反应体积(L),6 220为NADH的摩尔消光系数(L/(mol·cm)),l为光程距离(cm)。
FDH酶活测定:测定原理同LeuDH酶活测定。于1.0 mL磷酸盐缓冲液(100 mmol/L,pH 8.5)中加入1.67 mmol/L NAD+和167 mmol/L甲酸铵,30 ℃保温3 min后加入10 μL 酶液,迅速摇匀后记录2 min内吸光值的变化。酶活单位(U)的定义为在上述反应条件下每分钟催化1 μmol NAD+还原所需的酶量,计算公式同上。
2结果与讨论
2.1碳源对重组E.coli生长和产酶的影响
2.1.1碳源种类对重组E.coli生长和产酶的影响
当采用野生菌发酵产LeuDH时,葡萄糖为最常用的碳源,如Schütte等[20]研究了在10 L发酵罐中Bacilluscereus产LeuDH的发酵工艺,当添加2%葡萄糖为碳源时,LeuDH比酶活可达1 400 U/L。但E.coli对不同碳源的利用能力不同,进而会影响重组菌的生长和产酶能力。Zhang等[21]研究了碳源种类对重组E.coli表达葡聚糖蔗糖酶的影响,结果发现当采用甘油为碳源时,葡聚糖蔗糖酶酶活力最高。笔者通过改变发酵培养基中碳源的种类(均为5 g/L),研究不同碳源对重组E.coli生长及表达LeuDH和FDH的影响,结果见表1。由表1可知:蔗糖作为碳源时不利于E.coli的生长和酶蛋白的表达;采用葡萄糖、甘露糖和甘油为碳源时可以促进菌体生长,其中以甘油为碳源时生长状况最好,LeuDH和FDH活力最高。因此,确定甘油为最适碳源。
2.1.2甘油质量浓度对重组E.coli生长和产酶的影响
确定甘油为最适碳源后,进一步考察甘油浓度对菌体生长和产酶的影响,结果如图1所示。由图1可知随着甘油浓度的升高,菌体密度先升高再降低。甘油质量浓度为10 g/L时菌体生长量最高;酶活力随甘油浓度的变化趋势与菌体密度相似。因此确定10 g/L的甘油为最适的碳源添加量。
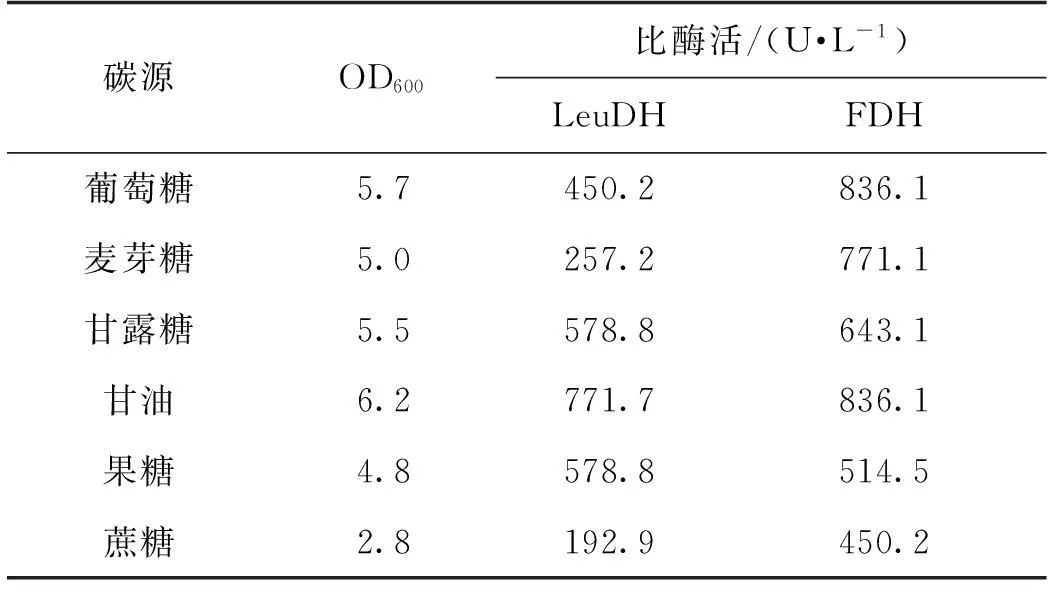
表1 碳源种类对菌体生长和产酶的影响
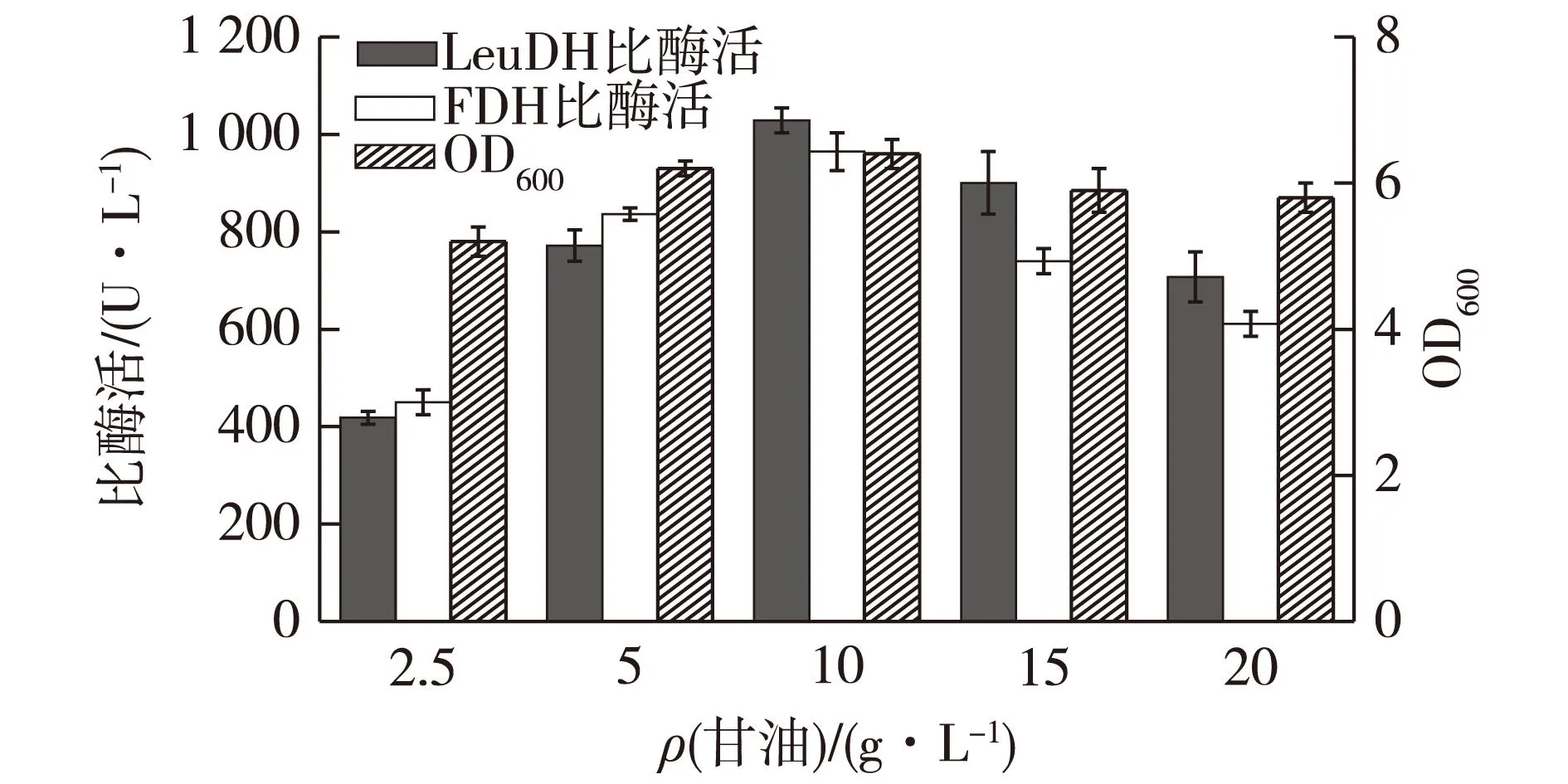
图1 甘油质量浓度对菌体生长和产酶的影响 Fig.1 Effects of glycerol concentration on cell growth and enzyme production
2.2氮源对重组E.coli生长和产酶的影响
2.2.1氮源种类对重组E.coli生长和产酶的影响
氮源是微生物合成细胞结构和含氮代谢产物的原料,因此对菌体生长和酶蛋白的合成具有明显的影响。Hummel等[22]考察不同氮源对Bacillussphaericus生长及产LeuDH的影响,结果发现有机氮源效果明显好于无机氮源,如采用酵母膏为氮源时,菌体OD600可达51,LeuDH比酶活达410 U/g。笔者考察不同氮源(均为10 g/L)对重组E.coli生长和产酶的影响,结果如表2所示。由表2可知:无机氮源不利于重组E.coli生长,而有机氮源可明显促进菌体生长和蛋白表达,这一结果与Hummel等[22]的研究结果一致,这可能是因为有机氮源中含有其他营养组分和生长促进剂[21]。由表2中数据可知,当采用酵母膏为氮源时,菌体密度和酶活力均明显高于采用其他氮源时,因此确定酵母膏为最适氮源。

表2 氮源种类对菌体生长和产酶的影响
2.2.2酵母膏质量浓度对重组E.coli生长和产酶的影响
进一步考察酵母膏用量对重组E.coli生长和产酶的影响,结果见图2。由图2可知:随着酵母膏浓度的提高,菌体密度逐渐升高,当酵母膏质量浓度达到10 g/L后,菌体生长量基本稳定。酶活方面,酵母膏质量浓度为10 g/L时,FDH酶活力最高,而LeuDH酶活在酵母膏浓度为15 g/L时达到最高。综合考虑菌体生长和产酶以及成本等因素,确定最佳的酵母膏质量浓度为10 g/L。

图2 酵母膏质量浓度对菌体生长和产酶的影响 Fig.2 Effects of yeast extract concentration on cell growth and enzyme production
2.3初始pH对重组E.coli生长和产酶的影响
培养基的pH对微生物的生长代谢和酶蛋白的表达都有很大的影响,因此考察不同培养基初始pH,对测定发酵后重组菌的菌体密度和酶活力的影响,结果见图3。由图3可知:随着pH的上升,生物量和酶活力均呈上升趋势,当pH达到 8.0时,生物量和酶活力均最高,说明培养基初始pH为8.0时最适合于重组菌的生长和酶表达。一般大肠杆菌在中性条件下生长情况最好,但因摇瓶发酵不能自动控制发酵液pH,随着发酵的进行,酸性代谢产物的积累会导致发酵液pH逐渐下降,因此初始pH略呈碱性时有利于重组菌的生长和产酶。
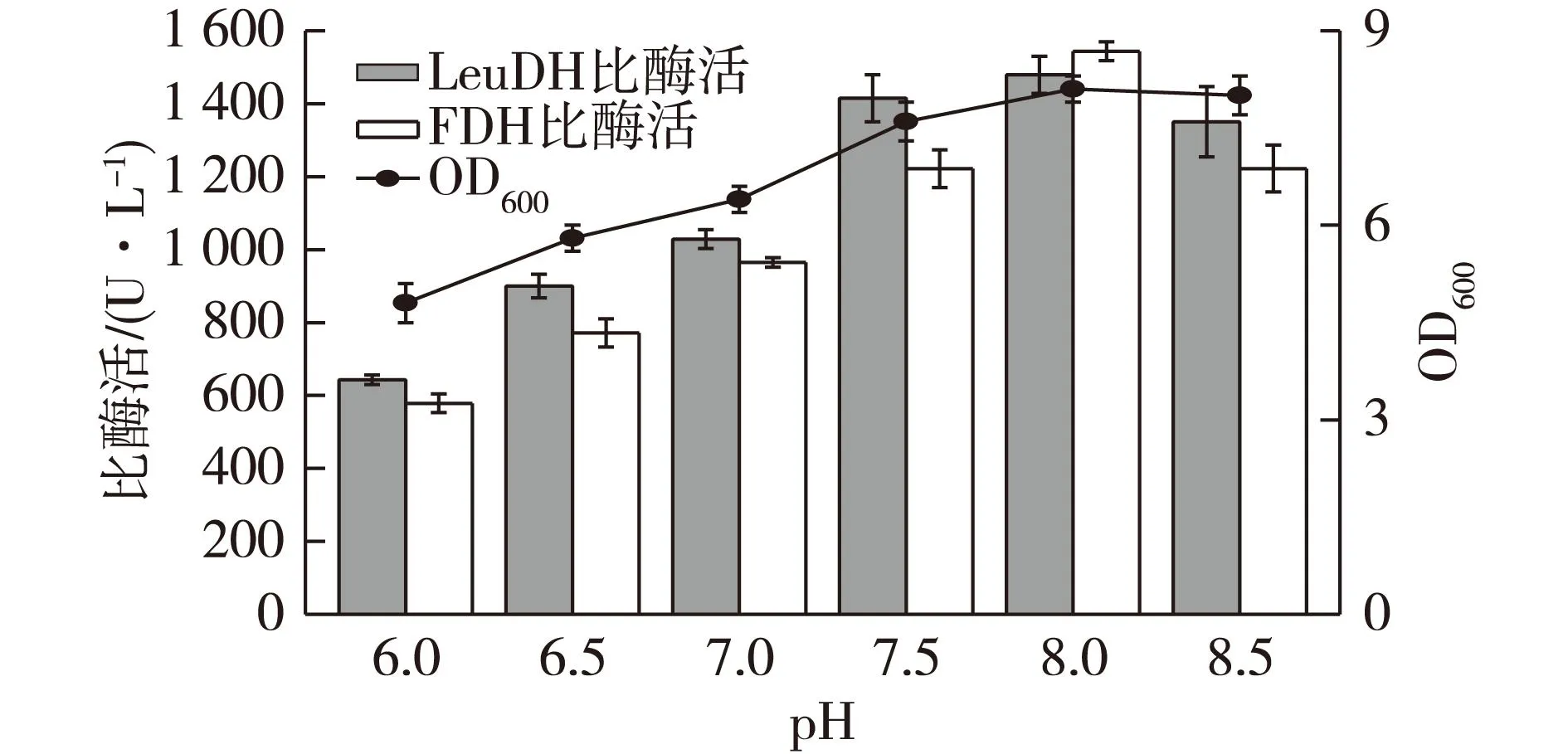
图3 培养基初始pH对菌体生长和产酶的影响 Fig.3 Effects of medium initial pH on cell growth and enzyme production
2.4最佳诱导时机的确定
2.4.1菌株生长曲线的测定
为确定诱导剂加入的最佳时机,首先测定不同时间下的菌液OD600,并绘制菌株生长曲线,结果见图4。由图4可知:在1%接种量下,重组菌在经过2 h的延滞期后即进入对数生长期,8 h后生长速率开始下降,10 h后进入稳定期。
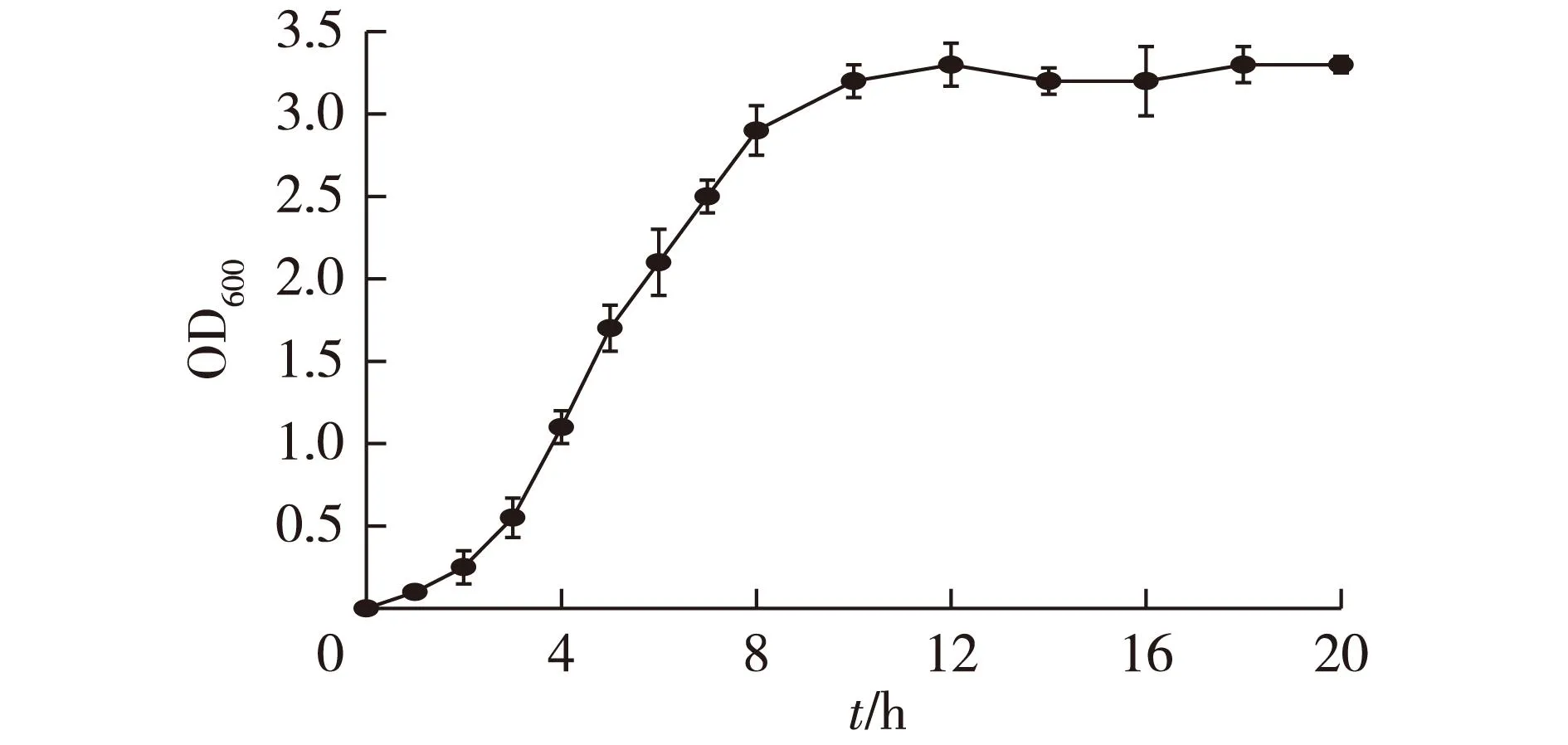
图4 重组大肠杆菌的生长曲线 Fig.4 Cell growth curve of recombinant E.coli coexpressing LeuDH and FDH
2.4.2诱导时机对重组E.coli生长和产酶的影响
考察诱导时机对菌体生长和产酶的影响,分别在接种后不同时间取菌液测定OD600,并加入IPTG开始诱导,诱导时间均为16 h,结果见图5。由图5可知:延迟期(OD600,0~0.25)加入诱导剂不利于菌体生长,发酵结束后菌体密度较低。这主要是因为IPTG对菌体生长有抑制作用,过早诱导不利于菌体的生长[23],虽然此时LeuDH酶活较高,但FDH酶活很低;在对数前期(OD600,0.4~0.8)进行诱导则有利于菌体的生长,其中当OD600达到0.6时加入诱导剂最利于菌体生长,发酵结束后菌体密度最高,且此时LeuDH和FDH酶活相当;而在对数中期(OD600,1.0~1.5)进行诱导虽有利于FDH酶活提高,但菌体密度和LeuDH酶活则有一定程度地下降。因此确定OD600达到0.6时为最佳的诱导时期,此时诱导最有利于菌体生长,同时LeuDH和FDH酶活相当。
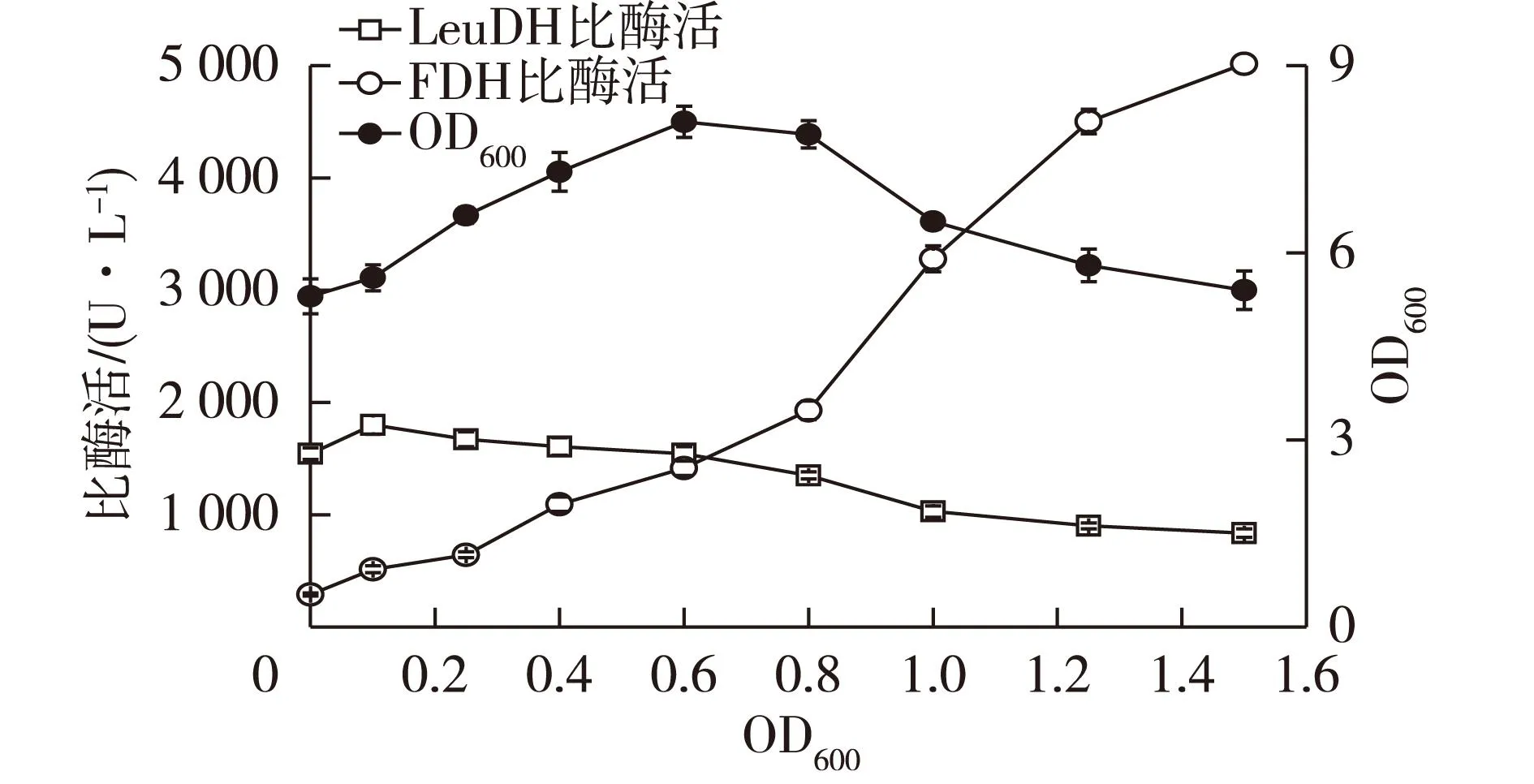
图5 诱导时机对菌体生长和产酶的影响 Fig.5 Effects of adding time of IPTG on cell growth and enzyme production
2.5诱导温度对重组E.coli生长和产酶的影响
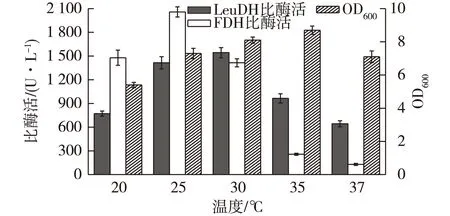
图6 诱导温度对菌体生长和产酶的影响 Fig.6 Effects of induction temperature on cell growth and enzyme production
温度对菌体生长、质粒稳定性和产物蛋白合成等都有重要影响。E.coli最适生长温度为37 ℃,但过高的诱导温度可能会导致蛋白质合成速率过快,进一步导致蛋白因无法正确折叠而形成无活性的包涵体[24],因此在进行重组菌诱导表达时常常控制诱导温度在35 ℃以下,以提高可溶性蛋白的表达。林日辉等[25]考察了诱导温度对重组菌表达FDH的影响,结果发现30 ℃时,FDH比酶活最高(170 U/L),酶活随温度升高呈下降趋势。接种后将重组E.coli在37 ℃培养至OD600为0.6,加入IPTG并控制至特定温度开始诱导,考察诱导温度对重组E.coli生长和产酶的影响,结果见图6。由图6可知:FDH酶活对高温敏感,当诱导温度高于30 ℃时,FDH酶活急剧下降。虽然35 ℃诱导有利于菌体生长,但此时LeuDH和FDH酶活均较低。综合实验结果,确定25 ℃为最佳的诱导温度。
2.6IPTG浓度对重组E.coli生长和产酶的影响
考察了IPTG浓度对重组E.coli生长和产酶的影响,结果见图7。由图7可知:对照组实验表明,不加IPTG进行诱导时,LeuDH和FDH基本不表达(数据未列出)。由图7可知,当加入0.05 mmol/L IPTG进行诱导时,FDH酶活最高,此后FDH酶活随IPTG浓度的升高而持续下降,说明高浓度IPTG不利于FDH的表达。菌体密度和LeuDH酶活则随IPTG浓度升高呈现先升高再下降的趋势,这是因为高密度的IPTG对重组菌的生长具有抑制作用,同时也抑制了目的蛋白的诱导合成。综合菌体生长和酶活力情况,确定最适的IPTG浓度为0.2 mmol/L。
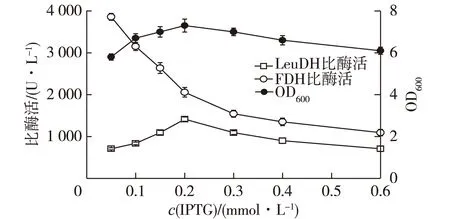
图7 IPTG浓度对菌体生长和产酶的影响 Fig.7 Effects of IPTG concentration on cell growth and enzyme production
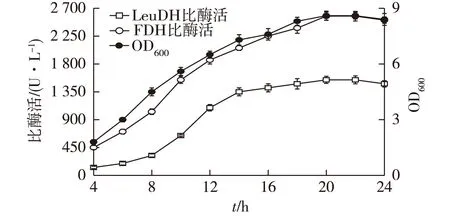
图8 诱导时间对菌体生长和产酶的影响 Fig.8 Effects of induction time on cell growth and enzyme production
2.7诱导时间对重组E.coli生长和产酶的影响
加入IPTG继续诱导,考察诱导时间对菌体密度和LeuDH及FDH酶活的影响。由图8可知,随着诱导时间的延长,菌体密度和酶活均逐渐升高,诱导14 h后,LeuDH酶活基本达到稳定。诱导20 h时,菌体密度和FDH酶活力达到最高,其后增长不明显。最终确定诱导时间为20 h,此时菌体密度(OD600)可达8.6, LeuDH和FDH比酶活分别可达1 543.3和2 572.4 U/L。
3结论
以共表达LeuDH和FDH的基因工程菌E.coliBL21-(LeuDH-FDH)为研究对象,研究了摇瓶中影响菌体生长和酶蛋白表达的因素,优化了发酵条件。实验结果表明,较佳的碳氮源及其质量浓度分别为甘油(10 g/L)和酵母膏(10 g/L),最适的培养基初始pH为8.0。在此条件下培养至菌体密度(OD600)为0.6时,加入终浓度为0.2 mmol/L的IPTG,25 ℃继续诱导20 h,菌体密度(OD600)可达8.6, LeuDH和FDH比酶活分别可达1 543.3和 2 572.4 U/L,是优化前的2.0和3.1倍。
参考文献:
[1]Sanwal B D,Zink M W.L-leucine dehydrogenase ofBacilluscereus.Arch Biochem Biophys,1961,94(3):430-435.
[2]Ohshima T,Wandrey C,Sugiura M et al.Screening of thermostable leucine and alanine dehydrogenenases in thermophilicBacillusstrains.Biotechnol Lett,1985,7(12):871-875.
[3]Ohshima T,Misono H,Soda K.Properties of crystalline leucine dehydrogenase fromBacillussphaericus.J Biol Chem,1978,253(16):5719-5725.
[4]Ohshima T,Nagata S,Soda K.Purification and characterization of thermostable leucine dehydrogenase fromBacillusstearothermophilus.Arch Microbiol,1985,141(4):407-411.
[5]Shimoi H,Nagata S,Esaki N et al.Leucine dehydrogenase of a thermophilic anaerobe,Clostridiumthermoaceticum:gene cloning,purification and characterization.Agric Biol Chem,1987,51(12):3375-3381.
[6]Ohshima T,Misono H,Soda K.Determination of branched-chain L-amino acids and their keto-analogs with leucine dehydrogenase.Agric Biol Chem,1978,42:1919-1922.
[7]Ohshima T,Wandrey C,Kula M R,et al.Improvement for L-leucine production in a continuously operated enzyme membrane reactor.Biotechnol Bioeng,1985,27(11):1616-1618.
[8]Bommarius A S,Schwarm M,Sting K,et al.Synthesis and use of enantiomerically puretert-leucine.Tetrahedron:Asymmetry,1995,6(12):2851-2888.
[9]Kragl U,Vasic-Racki D,Wandrey C.Continuous production of L-tert-leucine in series of two enzyme membrane reactors.Bioprocess Eng,1996,14(6):291-297.
[10]Menzel A,Werner H,Altenbuchner J,et al.From enzymes to "designer bugs" in reductive amination:a new process for the synthesis of L-tert-leucine using a whole cell-catalyst.Eng Life Sci,2004,4(6):573-576.
[11]Tanja S,Achim R,Kula M R.Cloning,sequencing and overexpression of the leucine dehydrogenase gene fromBacilluscereus.J Biotechnol,1997,54(1):77-80.
[12]Reina K,Shinji N,Haruo M.Cloning and sequencing of the leucine dehydrogenase fromBacillussphaericusIFO 3525 and importance of the C-terminal region for the enzyme activity.J Mol Catal B:Enzymatic,2003,23(2):239-247.
[13]Li H M,Zhu D M,Brooke A.Cloning,protein sequence clarification,and substrate specificity of a leucine dehydrogenase fromBacillussphaericusATCC 4525.Appl Biochem Biotechnol,2009,158(2):343-351.
[14]Jormakka M,Byme B,Lwata S.Formate dehydrogenase:a versatale enzyme in changing environments.Curr Opin Struc Biol,2003,13(4):418-423.
[15]Schirwitz K,Schmidt A,Lamzin A S.High-resolution structures of formate dehydrogenase fromCandidaboidinii.Protein Sci,2007,16(6):1146-1156.
[16]Popov V O,Lamzin V S.NAD+-dependent formate dehydrogenase.Biochem J,1994,301(3):625-643.
[17]Ernst M,Kaup B,Müller M,et al.Enantioselective reduction of carbonyl compounds by whole-cell biotransformation,combining a formate dehydrogenase and a(R)-specific alcohol dehydrogenase.App Microb Biotechnol,2005,66(6):629-634.
[18]Kratzer R,Pukl M,Egger S,et al.Whole-cell bioreduction of aromatic α-keto esters usingCandidatenuisxylose reductase andCandidaboidiniiformate dehydrogenase co-expressed inEscherichiacoli.Microb Cell Fact,2008,7:37-48.
[19]Bräutigam S,Dennewald D,Schürmann M,et al.Whole-cell biocatalysis:evaluation of new hydrophobic ionic liquids for efficient asymmetric reduction of prochiral ketones.Enzyme Microb Technol,2009,45(4):310-316.
[20]Schütte H,Hummel W,Tsai H,et al.L-Leucine dehydrogenase fromBacilluscereus:production,large-scale purification and protein characterization.Appl Microbiol Biotechnol,1985,22(5):306-317.
[21]Zhang H B,Mao X Q,Wang Y J,et al.Optimization of culture conditions for high-level expression of dextransucrase inEscherichiacoli.J Food Agric Environ,2009,7(3/4):75-78.
[22]Hummel W,Schütte H,Kula M R.Leucine dehydrogenase fromBacillussphaericus:optimized production conditions and an efficient method for its large-scale purification.Eur J Appl Microbiol Biotechnol,1981(1),12:22-27.
[23]叶逢春,陈银,邢新会.重组大肠杆菌生产可溶性MBP融合肝素酶的培养条件优化.生物加工过程,2006,4(3):28-32.
[24]Wang Y H,Jing C F,Yang B,et al.Production of a new sea anemone neurotoxin by recombinantEscherichiacoli:optimization of culture conditions using response surface methodology.Process Biochem,2005,40(8):2721-2728.
[25]林日辉,梁跃,农勉,等.重组NADP+依赖甲酸脱氢酶的表达及纯化.大众科技,2012,14(12):87-88.
(责任编辑管珺)
