海芋过氧化氢酶的分离纯化及其性质
2016-01-14李思莹,黄卓烈,郑华章等

海芋过氧化氢酶的分离纯化及其性质
李思莹,黄卓烈,郑华章,黄丹丹
(华南农业大学生命科学学院,广东广州510642)
摘要:为了探索海芋(Alocasia macrorrhiza)过氧化氢酶的分子结构和酶学性质,提取海芋新鲜叶片、叶柄和块茎的粗酶进行活力比较和同工酶分析。用Sephadex G 200凝胶过滤层析法将粗酶分离纯化,以PAGE电泳对酶纯度鉴定。结果表明:海芋过氧化氢酶较单一,没有同工酶。经层析法进行分离获得电泳纯的过氧化氢酶,其活力回收率为40.83%,纯化倍数为8.88倍。十二烷基硫酸钠-聚丙烯酰氨凝胶电泳(SDS-PAGE)分析结果发现:该酶由5条肽链组成,全酶相对分子质量为2.621 1×105。酶学性质研究结果表明:该酶最适反应温度40 ℃,最适pH为7.5。在25~45 ℃和pH 6.0~9.0下,该酶能保持较强的催化活力,稳定性较好。在最适条件下,该酶的Km值为16.43 mmol/L,对底物的亲和力较好。甲醇、乙醇和异丙醇对此酶活力有显著的抑制作用。
关键词:海芋过氧化氢酶;分离纯化;酶活力;酶学性质
doi:10.3969/j.issn.1672-3678.2015.04.010
收稿日期:2014-04-29
基金项目:国家自然科学基金(10074016)
作者简介:李思莹(1991—),女, 广东化州人,研究方向:酶学与酶工程;黄卓烈(联系人),教授,E-mail:zhuolieh@scau.edu.cn
中图分类号:Q55文献标志码:A
Isolation,purification and characterization ofAlocasiamacrorrhizacatalase
LI Siying,HUANG Zhuolie,ZHENG Huazhang,HUANG Dandan
(College of Life Science,South China Agricultural University,Guangdong 510642,China)
Abstract:In order to characterize catalase,crude enzyme was extracted from leaves,petioles,tuber of Alocasia macrorrhiza. The enzyme activities and isozymes were compared and analyzed among the organs. Sephadex G 200 gel chromatography was used to purify the enzyme. Polyacrylamide gel electrophoresis (PAGE) was used to identify the enzyme purity. There was no isozyme of catalase in Alocasia macrorrhiza. The activity recovery was 40.83% and the purification multiple was 8.88 folds. It was indicated by SDS-PAGE that the catalase in Alocasia macrorrhiza was composed of 5 polypeptides. The molecular weight of this catalase was 2.621 1×105. The optimal reaction temperature was 40 ℃ and the optimal pH was 7.5. Under the optimal conditions,the Km of this catalase was 16.43 mmol/L. The enzyme activity was inhibited by methanol,ethanol and isopropanol.
Keywords:Alocasia macrorrhiza catalase;isolation and purification enzyme activity;enzymology properties
海芋(Alocasiamacrorrhiza(L.) Schott)又名野芋、狼毒、尖尾和野芋头等,属天南星科海芋属植物,是一种民间中草药,具有重要的药用价值和经济价值。国内外在海芋的开发利用方面做了许多工作。隋亚光用海芋治疗慢性萎缩性鼻炎,结果表明不仅能减轻症状,且有治愈的可能。亦有报道以海芋为主治疗慢性支气管炎37例。海芋还可以抗肿瘤。国外报道海芋可用于治疗钩端螺旋体病、毒蛇咬伤和毒蜂蛰伤。此外,海芋叶资源丰富,易于种植,营养价值较高,1 kg叶粉干物质含粗蛋白质 244.1 g,赖氨酸11.9 g,蛋氨酸4.4 g,代谢能4.92 MJ,是一种新的饲料资源。过氧化氢酶(catalase,CAT)是一类广泛存在于动物、植物和微生物体内的末端氧化酶。此酶分子结构中含有铁卟啉环,1个分子酶蛋白中含有4个铁原子。典型的CAT又称单功能血红素CAT,几乎存在于所有真核生物和原核生物的呼吸组织中。过氧化氢酶是在生物演化过程中建立起来的生物防御系统的关键酶之一。
在生物体内有些生物化学反应会产生大量的H2O2。这种H2O2可以转变成为各种氧自由基。这些氧自由基能够破坏DNA、RNA、蛋白质和酶分子,使这些大分子断裂,从而失去生物活性。而过氧化氢酶的生物学功能是催化细胞内代谢过程形成的过氧化氢分解,防止氧自由基的形成,从而保护了生物大分子的结构与功能。现在,过氧化氢酶已经成为农业、乳制品业、造纸业和环保产业中有应用价值的酶之一。笔者对海芋各器官的过氧化氢酶进行分离和纯化,并对其分子结构、相对分子质量、催化动力学和酶学基本性质等进行探索,以便对其有较清楚的了解。
1材料与方法
1.1材料与试剂
材料:新鲜海芋的叶片、叶柄和块茎采摘于华南农业大学校园。
主要试剂:Sephadex G200、标准蛋白质样品和牛血清白蛋白,Sigma公司;Na2HPO4·12H2O、NaH2PO4·2H2O、甲叉双丙烯酰胺和H2O2等,国产分析纯试剂;考马斯亮蓝G-250和考马斯亮蓝R-250,Fluka公司。
1.2主要仪器与设备
5810R型冷冻离心机,德国Eppendorf公司;PB-10型酸度计,德国赛多利斯公司;磁力搅拌器、分光光度计、紫外检测仪、垂直板电泳槽和电泳仪等为国产仪器。
1.3方法
1.3.1粗酶液的提取
新鲜海芋材料用蒸馏水洗干净,擦干。分别称取一定质量的叶片、叶柄和块茎,剪碎置研钵中,加入适量4 ℃下预冷的 pH 7.5磷酸缓冲液和少量石英砂研磨成匀浆后,置于4 ℃冰箱中静置 10 min,用4层纱布过滤,取上清液在4 ℃下12 000 r/min离心15 min,上清液即为过氧化氢酶粗提液。4 ℃下保存备用。
1.3.2海芋各器官过氧化氢酶活力的比较
配制3 mL反应体系(粗酶液0.2 mL、0.1 mol/L H2O20.3 mL和磷酸缓冲溶液2.5 mL),在37 ℃、pH 7.5条件下,于波长240 nm处测定海芋各器官过氧化氢酶的活力。以每分钟吸光值变化0.01所需要的酶量定义为1单位(U)。
1.3.3聚丙烯酰胺凝胶电泳(PAGE) 分离过氧化氢酶同工酶
取粗酶液3 mL,浓缩至1 mL,加入等体积的40%(质量分数)蔗糖溶液混匀,并加入2滴0.5% (体积分数)溴酚蓝作为电泳指示剂。聚丙烯酰胺凝胶的浓缩胶质量分数5%,分离胶质量分数12%。上样量30 μL。样品在浓缩胶时用120 V 电泳1 h,当样品进入分离胶后用160 V 电泳3.5 h。电泳后脱胶,将凝胶用预冷的蒸馏水稍加冲洗,然后于体积分数0.03% H2O2中浸泡20 min。倾去该浸泡液,用预冷的蒸馏水稍加冲洗后,将凝胶置于2% FeCl3与2% K3Fe(CN)6体积比为1∶4 的混合液中浸泡,直至在凝胶上的暗绿色背景下出现黄白色区带[11]。
1.3.4Sephadex G-200凝胶过滤柱层析分离过氧化氢酶
用pH7.5磷酸缓冲液0.2 mol/L平衡Sephadex G200层析柱。取20 g叶片提取粗酶液,浓缩至10 mL,上样1 mL。用pH7.5磷酸缓冲液0.2 mol/L洗脱,每6 min收集1管,每管收集4 mL;测定各管过氧化氢酶的活力和蛋白含量;收集活力最高的一管酶液,4 ℃冰箱保存。
1.3.5PAGE电泳鉴定纯度
用PAGE电泳对该酶纯度进行鉴定,分离胶的质量分数为12%,每孔加样量为20 μL。电泳后用考马斯亮蓝R-250溶液染色。
1.3.6SDS-PAGE电泳测定酶的相对分子质量
用十二烷硫酸钠(SDS)-PAGE电泳测定该酶各肽链的相对分子质量,计算全酶的相对分子质量。分离胶质量分数为12%。
1.3.7蛋白质浓度测定
蛋白质浓度测定参照Bradford[12]的方法,以牛血清白蛋白为标准样品。
1.3.8过氧化氢酶的酶学性质研究
1)酶的反应动力学研究配制浓度10、20、25、50、80和100 mmol/L的过氧化氢底物,分别取1 mL底物配制成3 mL反应体系,在37 ℃、pH 7.5条件下测定CAT酶活力,采用Lineweaver-Burk的双倒数作图法[13]计算该酶的Km值和Vmax值。
2)酶的最适温度和温度稳定性分别测定该酶在20~75 ℃、pH 7.5条件下酶的活力变化,以探索酶的最适pH。另外将酶液分别放置在25~75 ℃下孵育1 h后测定酶活力,计算相对酶活力并确定该酶的温度稳定性。
3)酶的最适pH和pH稳定性分别测定pH 4.5~10.5、37 ℃条件下的酶活力变化,探索酶的最适pH。另外将酶液分别在pH 4.5~10.5的缓冲液中4 ℃下放置2 h,然后测定酶活力,研究其pH值稳定性。
4)一些有机溶剂对酶活力的影响分别将甲醇、乙醇、异丙醇与磷酸缓冲液和酶液混匀,混匀后有机溶剂的体积分数分别为0、10%、20%、30%、40%、50%和60%,在4 ℃下放置1 h,然后在37 ℃下测定该酶的活力,计算比活力。
2结果与讨论
2.1海芋各器官过氧化氢酶活力的比较
海芋各器官过氧化氢酶活力见表1。由表1可知:海芋叶片、叶柄和块茎均含有过氧化氢酶的活力,其中叶片的酶活力最高,其次是叶柄,块茎的酶活力最低。但从比活力来看,则是叶柄的比活力最高,块茎的比活力最低。
2.2海芋各器官的过氧化氢酶同工酶电泳分析结果
海芋各器官过氧化氢酶同工酶分离结果见图1。由图1可知:海芋叶片、叶柄和块茎均显示单一条带,它们的过氧化氢酶均没有同工酶。
2.3海芋叶片过氧化氢酶的分离纯化及纯度
图2为用Sephadex G 200分离海芋叶片过氧化氢酶的洗脱曲线。由图2可知:经过Sephadex G 200凝胶过滤层析后,在第30管之前的分部液中,蛋白质质量浓度曲线出现明显的2个峰。过氧化氢酶活力出现了1个明显的主峰,该主峰与蛋白质的第一个峰重合。

表1 海芋各器官的酶活力比较
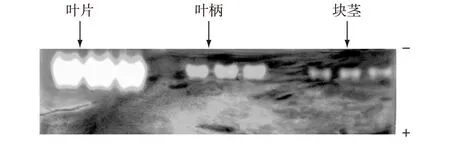
图1 海芋各器官过氧化氢酶同工酶PAGE图谱 Fig.1 PAGE analysis of isozymes of Alocasia macrorrhiza catalase
表2为海芋叶片过氧化氢酶分离纯化表。由表2可知:经Sephadex G 200分离后,回收率为40.83%,过氧化氢酶被纯化了8.88倍。

图2 海芋叶片过氧化氢酶Sephadex G 200凝胶过滤层析 Fig.2 Purification of Alocasia macrorrhiza blade catalase by Sephadex G 200 gel chromatography
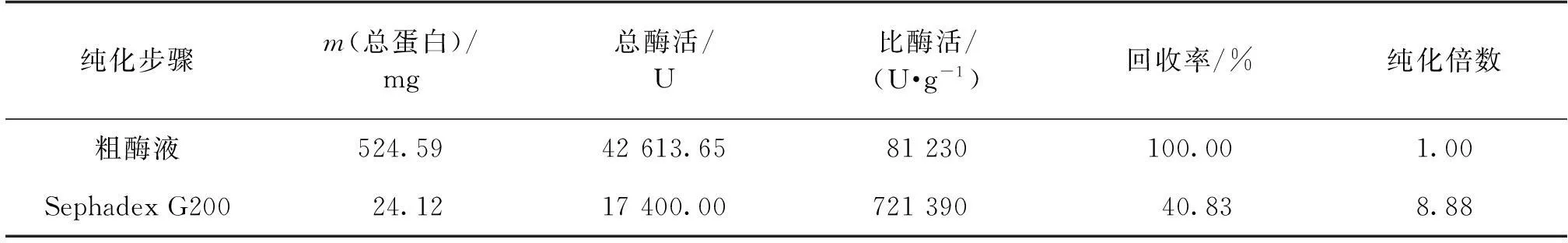
表2 海芋叶片过氧化氢酶的分离纯化表
取第一峰的第5支管的分部液进行浓缩后,作为样品进行PAGE电泳,用考马斯亮蓝R250溶液染色后,结果如图3所示。由图3可知:样品显示为单一条带,表明分离纯化后第5管的过氧化氢酶已达到电泳纯,后续的实验可用此样品进行。

图3 分离后的海芋叶片过氧化氢酶的PAGE电泳图谱 Fig.3 PAGE electrophoretogram of separated catalase of Alocasia macrorrhiza blade
2.4海芋叶片过氧化氢酶的相对分子质量
将达到电泳纯的过氧化氢酶样品进行SDS-PAGE电泳,测定其相对分子质量,电泳结果见图4。由图4可知:海芋过氧化氢酶由5条肽链组成。经过对5条肽链进行计算分析,每条肽链的相对分子质量分别为1.512×104、3.887×104、5.344×104、7.215×104和8.353×104,因此该酶分子的相对分子质量为26.211×104。

M—标准品;S:海芋过氧化氢酶:a~e: 5条肽链 图4 海芋叶片过氧化氢酶的SDS-PAGE电泳 Fig.4 SDS-PAGE electrophoretogram of Alocasia macrorrhiza catalase
2.5海芋叶片过氧化氢酶的酶学性质
2.5.1海芋叶片过氧化氢酶的催化动力学
图5为海芋叶片过氧化氢酶纯酶双倒数法的反应动力学图,根据图5可以求得该酶的最大反应速率(Vmax)为204.08 μmol/(mg ·min),表观米氏常数(Km)为16.43 mmol/L。
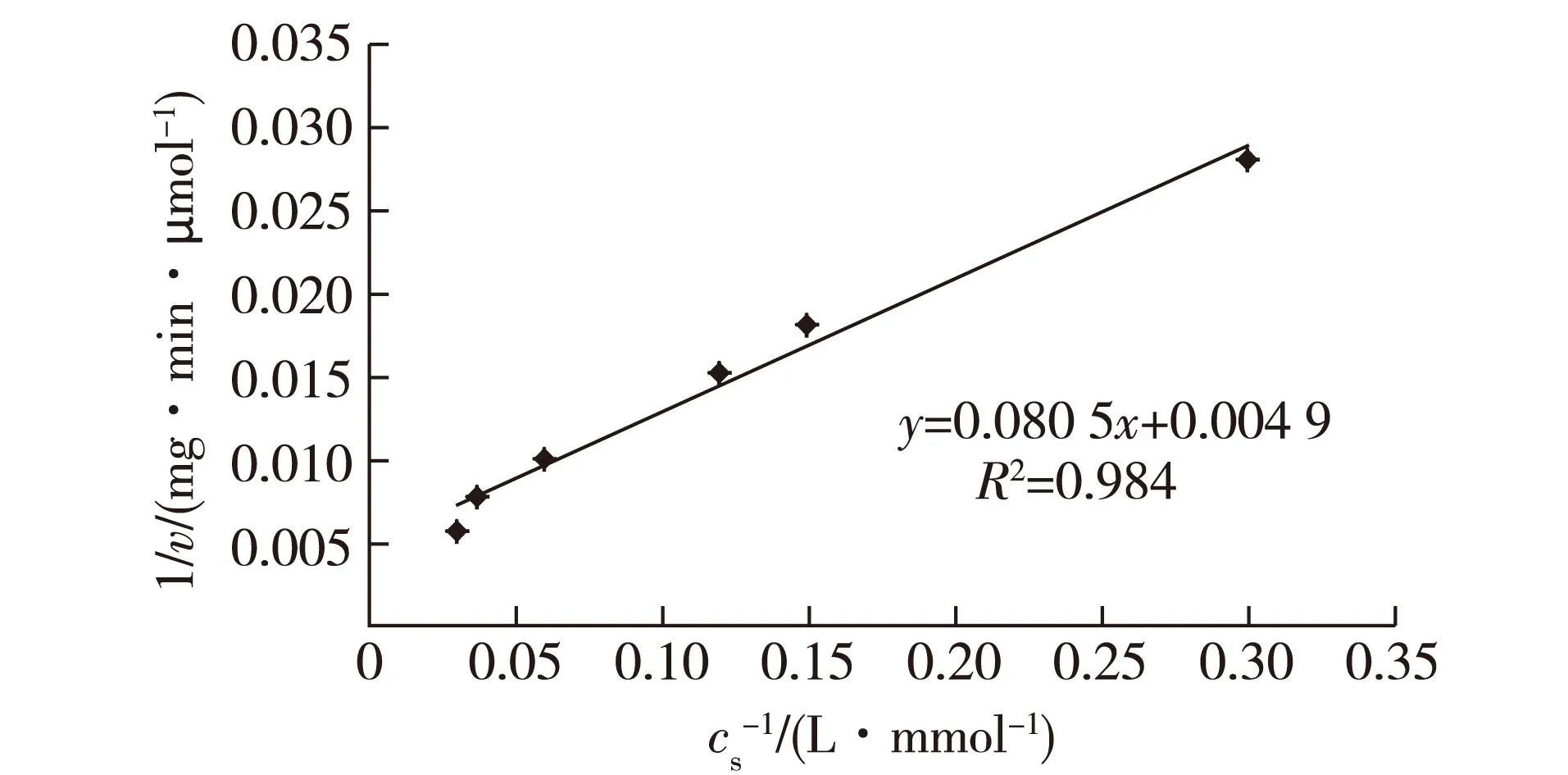
图5 双倒数作图法测定米氏常数 Fig.5 K m determination by double reciprocal method
2.5.2酶的最适温度与温度稳定性
图6为海芋叶片过氧化氢酶在不同温度下的反应活力。由图6可知:海芋叶片过氧化氢酶的最适反应温度为40 ℃;在30~55 ℃范围内,该酶的相对酶活力均保持在最适温度下反应活力的80%以上。

图6 温度对酶活力的影响 Fig.6 Effects of temperature on enzyme activity
图7为海芋叶片过氧化氢酶的热稳定性的曲线图。由图7可知:海芋叶片过氧化氢酶在25~45 ℃时的热稳定性较好,孵育1 h后,相对酶活力保持在75%以上;而60 ℃孵育1 h后,相对酶活力为10.71%,70 ℃孵育1 h后,该酶失去活力。
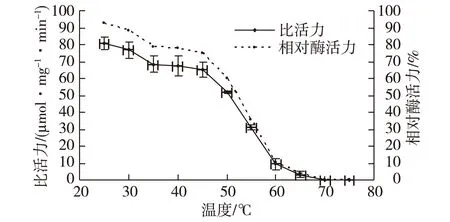
图7 海芋叶片过氧化氢酶的热稳定性 Fig.7 Thermal stability of the catalase of Alocasia macrorrhiza blade
2.5.3海芋叶片过氧化氢酶的最适pH与pH稳定性
图8为不同pH对海芋叶片过氧化氢酶催化活力的影响。由图8可知:海芋叶片过氧化氢酶的最适pH为7.5,在pH 6.0~8.5范围内,该酶的相对酶活力均保持在最适pH反应活力的80%以上。
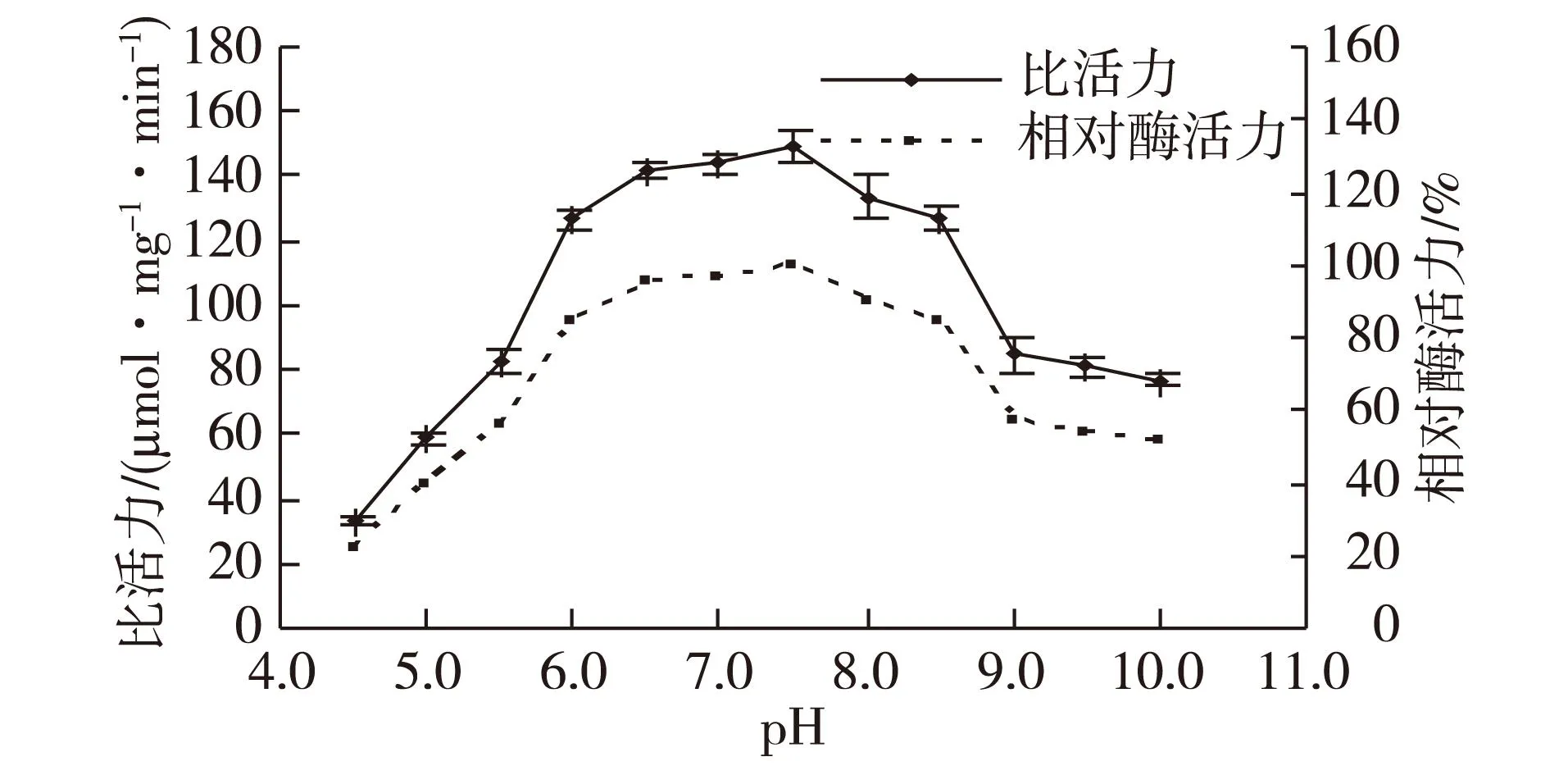
图8 pH对酶活力的影响 Fig.8 Effects of pH on enzyme activity
图9为海芋叶片过氧化氢酶的pH稳定性。由图9可知:海芋叶片过氧化氢酶在pH 6.0~9.0范围内,4 ℃条件下孵育2 h后,相对酶活力均保持在80%以上。在此范围之外,其相对酶活力变化趋势不大,均保持在50%以上,由此说明该酶的酸碱耐受性较好。
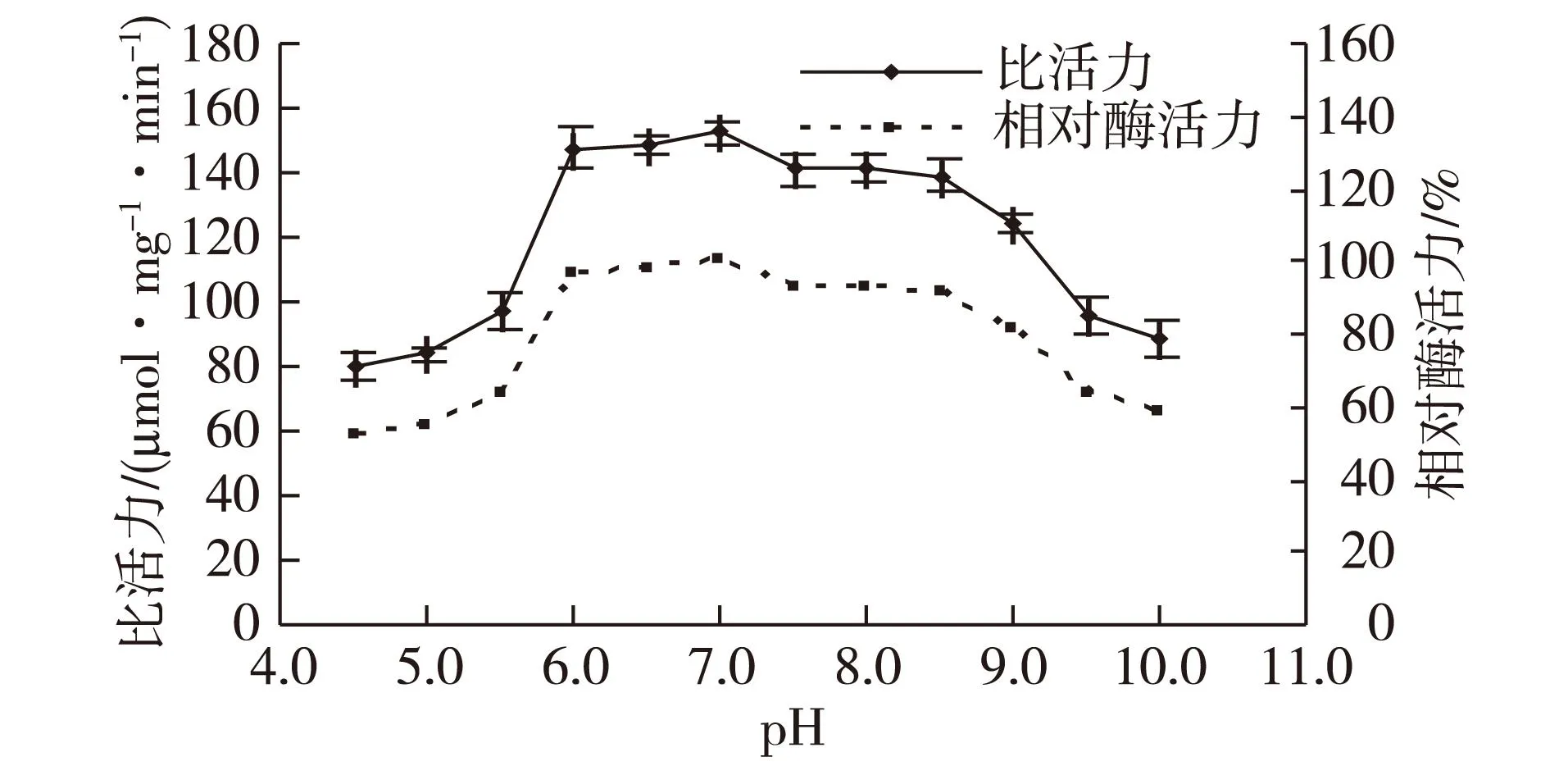
图9 海芋叶片过氧化氢酶的pH稳定性 Fig.9 The pH stability of catalase of Alocasia macrorrhiza blade
2.5.4一些有机溶剂对酶活力的影响
图10为不同浓度的甲醇、乙醇和异丙醇对海芋叶片过氧化氢酶活力的影响曲线。由图10可知:甲醇、乙醇和异丙醇对海芋叶片过氧化氢酶均有较强的抑制作用。其中,甲醇的抑制作用较乙醇、异丙醇的强,体积分数为50%时,酶活力完全丧失。
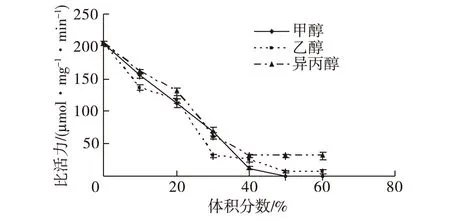
图10 有机溶剂对酶活力的影响 Fig.10 Effects of some organic solvents on the enzyme activity
有机溶剂导致酶催化活力减少的因素主要概括为5个方面:①扩散限制和立体障碍;②非水介质中酶的结构;③构象的可变性;④底物解析和过渡态中间物的稳定性;⑤pH状态。其他有机溶剂对此酶活力的作用效果还有待进一步的深入研究。
3结论
详细地研究了海芋的过氧化氢酶。该酶的活力回收率为40.83%、纯化倍数为8.88倍。该酶的相对分子质量为2.621 1×105。该酶最适作用温度为40 ℃,在25~45 ℃范围内孵育1 h后,相对酶活力保持在75%以上,热稳定性较低。最适作用pH为7.5,在pH 6.0~9.0范围内,4 ℃条件下孵育2 h后,相对酶活力均保持在80%以上。该酶的酸碱耐受性较好。最适条件下,Km值为16.43 mmol/L,说明海芋叶片的过氧化氢酶对过氧化氢的亲和力较好。
甲醇、乙醇、异丙醇对海芋叶片过氧化氢酶均有较显著的抑制作用,三者的体积分数为10%时,该酶的相对活力均降至80%以下。其中,甲醇的抑制作用较乙醇、异丙醇的强,体积分数为50%时,酶活力完全丧失。
参考文献:
[1]中国科学院中国植物志编辑委员会.中国植物志:十三卷第二分册.北京:科学出版社,1979.
[2]隋亚光.慢性支气管炎治疗.中华耳鼻喉科杂志,1957(2):116.
[3]解放军187医院慢性支气管炎防治队.慢性支气管炎治疗37例.广东医药资料,1977(12):7.
[4]可燕,周秀佳,柏巧明.海芋抗肿瘤作用研究.中药材,1999,22(5):252-253.
[5]Kariyone T.Annual index of the Reports on plant chemistry .New York:Academic Press,1972.
[6]温刘发,蒲英远,罗旭芳,等.海芋叶粉饲用价值的探讨.华南农业大学学报:自然科学报,1997,18(1):70-74.
[7]黄永洪,花慧,沈国强,等.猪肝过氧化氢酶提取条件的研究.生物技术通讯,2005,16(1):40-42.
[8]Marcel Zamocky,Franz Koller.Understanding the structure and function of catalase:clues from molecular evolution and in vitro mutagenesis .Progress in Biophysics and Molecular Biology,1999,72:19-66.
[9]张坤生,田荟琳.过氧化氢酶的功能及研究.食品科技,2007(1):8-10.
[10]刘昌玲,王国庆.细菌过氧化氢酶的分离、结晶及性质.生物化学与生物物理进展,1900,17(5):380-383.
[11]董泗建,刘昌玲.一种鉴定过氧化氢酶活性的铁染色法.生物化学与生物物理进展,1996,23(1):86-88.
[12]Bradford R M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding .Anal Biochem,1976,72:248-254.
[13]黄熙泰,于自然,李翠凤.现代生物化学.2版.北京:化学工业出版社,2005.
(责任编辑周晓薇)

