抗生素对雨生红球藻无菌化培养的影响
2016-01-14孙雯,黄和,林海龙等

抗生素对雨生红球藻无菌化培养的影响
孙雯1,黄和1,林海龙2,彭超2,苏会波2
(1.南京工业大学生物与制药工程学院,江苏南京211800;2.中粮营养健康研究院,北京102200)
摘要:采用8种常用抗生素对雨生红球藻进行无菌化处理,研究抗生素种类及浓度对雨生红球藻细胞生长的影响,以确定对雨生红球藻细胞无害并能抑制伴生杂菌生长的抗生素种类及使用浓度。结果表明:培养前期(0~8 d)添加灰黄霉素(0.05 mg/mL)的抑菌效果最好,且对雨生红球藻细胞的生长抑制最小;培养中后期(8 d后),添加青霉素(0.05 mg/mL)所起到的抑菌效果较明显。另外,当分阶段添加灰黄霉素(0.05 mg/mL)和青霉素(0.025 mg/mL)时,雨生红球藻细胞密度可达4.75×106个/mL(培养18 d),是空白对照实验组的1.8倍,且其抑菌效果明显优于使用单一抗生素。
关键词:雨生红球藻;抗生素;虾青素;无菌化培养
doi:10.3969/j.issn.1672-3678.2015.04.003
收稿日期:2014-05-06
基金项目:国家高技术研究发展计划(863计划)(2012AA023107)
作者简介:孙雯(1991—),女,江苏赣榆人,硕士研究生,研究方向:微藻生物技术;黄和(联系人),教授,E-mail:biotech@njtech.edu.cn
中图分类号:Q949.2文献标志码:A
Effects of antibiotics on axenic culture fromHaematococcuspluvialis
SUN Wen1,HUANG He1,LIN Hailong2,PENG Chao2,SU Huibo2
(1.College of Biotechnology and Pharmaceutical Engineering,Nanjing Tech University,Nanjing 211800,China;
2.Nutrition and Health Research Institute,COFCO,Beijing 102200,China)
Abstract:We studied eight common antibiotics adding to the culture broth to explore axenic cultivation of Haematococcus pluvialis. The optimal antibiotics and concentration were determined. At the earlier stage of the cultivation(0-8 d),relatively lower concentration of griseofulvin(0.05 mg/mL)was beneficial to microalgae cell growth and antibacterial effect than the others. In the middle and later stage of the cultivation(after 8 d),an obvious antibacterial effect was observed when penicillin(0.05 mg/mL)was used as bacteriostatic agent. Furthermore,the combination of griseofulvin (0.05 mg/mL) and penicillin(0.025 mg/mL) had better antibacterial effect than that with single use. After 18 days cultivation,the number of algal cells reached 4.75×106 mL-1, nearly 1.8-fold of the control.
Keywords:Haematococcus pluvialis; antibiotics; astaxanthin; axenic culture
微藻研究领域中,多采用伴有杂藻或杂菌的藻种,但是对于藻间或藻菌相互作用及兼养和异养等方面的研究均需要以无菌的藻种为实验材料,才能确保研究的可靠性。微藻的纯种培养和保存是其应用的基础和关键性环节,也是研究其生理生化特性、营养价值及药理学和毒理学等必不可少的步骤[2-3]。微藻的无菌化培养主要采用离心洗涤法、稀释过滤法、抗生素法、消毒法、毛细管显微镜分离法和利用特性法(趋向运动性、耐高盐性等)。相比较而言,抗生素法比较快速有效,因为抗生素在除菌、抑菌方面表现出了强大的作用[4-5]。目前,微藻培养无菌化研究中,抗生素的应用主要集中在绿藻、波吉卵囊藻、颤藻、节旋藻、螺旋藻、球等鞭金藻和紫球藻等方面[6-9]。王江涛等[10]联合使用链霉素和多粘菌素B作为中肋骨条藻(Skeletonemacostatum)的抑菌剂,取得了较好的抑菌效果。周文礼等[11]研究了氯霉素、遗传霉素(G418)及青霉素对小球藻、金藻和小新月菱形藻等海洋饵料微藻生长的影响,结果发现,低浓度的青霉素可以促进3种微藻细胞的生长。
雨生红球藻(Haematococcuspluvialis)是一种单细胞淡水微藻[11],当其受到胁迫(盐、光强度、温度或pH)后开始大量积累虾青素[12-13]。雨生红球藻培养时存在着特异性杂菌污染的问题,尤其在规模化培养中,杂菌污染会严重影响产品产量与品质,并在一定程度上制约其应用。此外,若收获的雨生红球藻细胞中大量的藻细胞被杂菌污染,将会导致藻细胞中天然虾青素的含量急剧下降,特别是采用大规模开放池培养时,一旦杂菌污染,不但会引起染菌爆发流行,而且会造成产品绝收。因此,迫切需要选择合适的抑菌剂对雨生红球藻进行无菌化处理,在抑制杂菌和杂藻生长的同时,又对雨生红球藻细胞的生长抑制效果控制到最低[14]。
笔者主要考察对雨生红球藻细胞生长抑制影响比较小,但能抑制或消灭伴生杂菌的抗生素[15],重点考察8种常用抗生素对雨生红球藻细胞生长的影响,以初步确定雨生红球藻培养过程中较理想的抗生素种类和使用方法,为进一步实现雨生红球藻的大规模开放式培养奠定基础。
1材料与方法
1.1藻种及抗生素来源
雨生红球藻原始藻种从中国科学院水生生物研究所淡水藻种库购买,藻种编号为FACHB-875,经过一系列分离、纯化等工作,获得了1株性状优良的藻种,藻种编号为NHRI A753.1。
氨苄青霉素(AMP)、硫酸链霉素(STR)、卡那霉素(KAN)、氯霉素(CHL)、青霉素(PEN)、灰黄霉素(GRI)、硫酸庆大霉素(GEN)、头孢他啶(CAZ)均购于国药集团化学试剂有限公司。
1.2培养基
雨生红球藻生长培养基(BBM培养基,g/L):NaNO3250、K2HPO475、NaCl 25、MgSO4·7H2O 75、CaCl2·2H2O 25、KH2PO4175、维生素B10.001、生物素 0.25×10-6、维生素B120.15×10-6、Na2EDTA 0.75、MnCl2·4H2O 0.041、ZnCl2·7H2O 0.005、Na2MoO4·2H2O 0.004、FeCl3·6H2O 0.097、CoCl2·6H2O 0.002。
1.3培养方法
1.3.1雨生红球藻培养方法
配制BBM培养液,分装至100 mL摇瓶中,装液量50 mL,121 ℃灭菌30 min,冷却后无菌条件接入1 mL处于对数生长期的雨生红球藻细胞,其中包括大部分游动细胞和少量不动细胞。置于光照培养箱中培养,光照强度2 000 lx,培养温度25 ℃,光暗比12 h∶12 h,每天按时摇瓶4次。
1.3.2抗生素母液的配制
8种常用抗生素用蒸馏水配制成母液(10 mg/mL),0.4 μm细菌滤膜处理后保存于4 ℃冰箱[16],备用。
1.3.3除菌抗生素对雨生红球藻生长的影响
1)灭菌培养基及未灭菌培养基中抗生素对藻细胞生长的影响向灭菌后的和未灭菌的BBM培养基加入抗生素溶液(终质量浓度0.1 mg/mL)[16-17],并将培养至对数期的藻液按2%接种量接入,按1.3.1节方法培养,定时取样测定藻细胞密度,记录藻细胞活性,以未加抗生素藻液为对照,每组设3个平行组。
2)抗生素浓度的优化已除菌的灰黄霉素、青霉素、氨苄霉素、头孢他啶和氯霉素各设4个质量浓度梯度0.05、0.1、0.2 和0.5 mg/mL,分别加入BBM培养液后,再将培养至对数期的藻液按2%的接种量接入其中,以未加抗生素藻液为对照,每组设3个平行组,培养10 d。
3)抗生素组合使用对雨生红球藻细胞生长的影响①向BBM培养基中分别加入灰黄霉素、氯霉素和头孢他啶(0.05 mg/mL)溶液,并将培养至对数期的藻液按2%的接种量接入,按1.3.1节方法培养,定时取样测定藻细胞密度,记录藻细胞活性,以未加抗生素藻液为对照,每组设3个平行组,培养18 d。②向BBM培养基中分别加入灰黄霉素、氯霉素和头孢他啶(0.05 mg/mL)溶液,并将培养至对数期的藻液按2%接种量接入,按1.3.1节方法培养,定时取样测定藻细胞密度,记录藻细胞活性,以未加抗生素藻液为对照,培养至第8天,各加入0.025 mg/mL,继续培养10 d,每组设3个平行组。
1.4分析检测方法
1.4.1藻细胞密度测定方法
红球藻细胞数量的测量方法采用传统的血球计数板方法[18]。吸取少量摇匀的藻液置于观察视野为40×10倍的光学显微镜下,记录藻细胞总数,同时记录游动细胞与不动细胞的比例。
1.4.2藻细胞活力的测定方法
在1.4.1节基础上计算细胞数目的增长速率,同时参考游动细胞与不动细胞的比例确定藻细胞的活力。
藻细胞生长速率计算见式(1)。
(1)
式中:x为培养第t天的藻细胞密度,t为培养时间。
2结果与讨论
2.1不同种类抗生素对雨生红球藻细胞生长的影响
为了同时考察添加抗生素对藻细胞生长的影响以及对杂菌、杂藻生长的抑制作用,分别考察在灭菌后的培养基中,添加一定量的抗生素对微藻培养所起到的作用,结果见图1。

图1 灭菌培养基中不同抗生素对雨生红球藻生长的影响 Fig.1 Effects of different antibiotics on growth of Haematococcus pluvialis in a sterilized culture
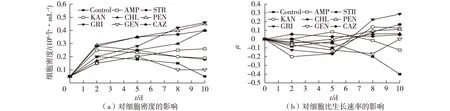
图2 未灭菌培养基中不同抗生素对雨生红球藻生长的影响 Fig.2 Effects of different antibiotics on growth of Haematococcus pluvialis in a unsterilized culture
由图1可知:添加灰黄霉素作为抑菌剂时,培养至第8天的藻细胞密度达到最大值(3.0×106个/mL)。当添加青霉素、氨苄青霉素2种抗生素作为抑菌剂时,藻细胞密度达到1.4×106个/mL,也高于对照组的值(1.25×106个/mL)。添加了灰黄霉素、青霉素及氨苄青霉素的实验组中,培养至第8~10天时,藻细胞的比生长速率(μ)分别为0.18、0.14和0.11,都高于对照组。说明这3种抗生素对藻细胞生长抑制的作用较小。另外,当添加头孢他啶作为抑菌剂时,培养至第8天时的细胞密度为1.0×106个/mL,低于实验对照组,而藻细胞的比生长速率(0.25)高于对照组;氯霉素实验组在第8天时细胞密度为0.8×106个/mL,此时μ为0.036,高于对照组,因此这2种抗生素仍可作为雨生红球藻无菌化处理的抑菌剂。综上所述,灰黄霉素、青霉素、氨苄霉素、头孢他啶和氯霉素这5种常用抗生素可考虑作为雨生红球藻无菌化处理的抑菌剂使用。
为了考察几种常用抗生素对杂菌或杂藻的抑制效果,笔者进一步考察了向未灭菌的培养基中添加抗生素对藻细胞培养的影响,结果见图2。由图2可知:随着培养过程的进行,各抗生素添加实验组的藻细胞密度和细胞活性均高于对照组。这可能是由于在培养初期,添加抗生素对藻细胞的生长产生了抑制作用,而随着培养过程的进行,对照组藻液中的杂菌不断滋生,而抗生素的添加抑制了杂菌的滋生,从而更利于藻细胞的生长。当添加氯霉素、灰黄霉素、头孢他啶和青霉素作为雨生红球藻细胞培养的抑菌剂时,在培养至第10 天时,藻细胞密度分别为0.4×106、0.46×106、0.4×106和0.45×106个/mL,明显高于对照组(0.05×106个/mL);此外,培养至第10 天时,上述4种抗生素实验组中藻细胞的比生长速率(μ)分别为0.125、0.043、0.037和0.056,也高于包括对照组在内的其他各组中藻细胞的比生长速率。因此,氯霉素、灰黄霉素、头孢他啶和青霉素在未灭菌培养基中对其他杂菌、杂藻抑菌效果最为理想。综合分析图1与图2的研究结果可知,在雨生红球藻培养过程中,对藻细胞生长抑制影响小,同时对杂菌或杂藻的抑制能力强的抗生素包括:氯霉素、灰黄霉素、头孢他啶和青霉素。
2.2不同浓度的抗生素对雨生红球藻细胞生长的影响
由上节的研究结果可知,灰黄霉素、氯霉素、青霉素以及头孢他啶这4种优选抗生素可以考虑作为无菌化处理的抑菌剂。因此,综合考虑4种抗生素对杂菌、杂藻的抑菌作用以及其对雨生红球藻细胞生长的抑制效果,考察分别添加灰黄霉素、氯霉素、青霉素以及头孢他啶这4种抗生素对雨生红球藻细胞生长的影响,结果分别如图3、图4、图5和图6所示。

图3 灰黄霉素浓度对雨生红球藻生长的影响 Fig.3 Effects of GRI concentration on growth of Haematococcus pluvialis
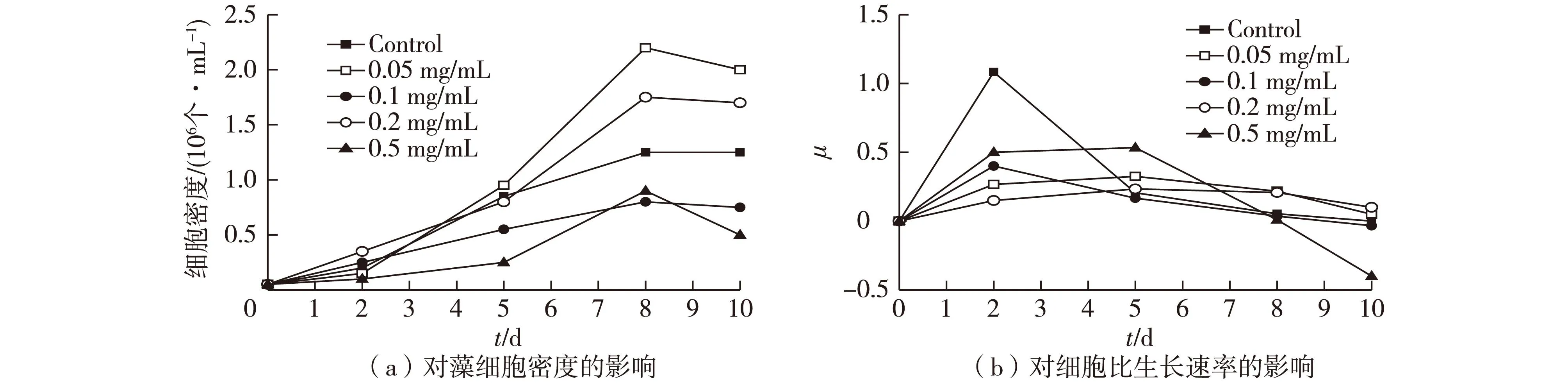
图4 氯霉素浓度对雨生红球藻生长的影响 Fig.4 Effects of CHL concentration on growth of Haematococcus pluvialis

图5 青霉素浓度对雨生红球藻生长的影响 Fig.5 Effects of PEN concentration on growth of Haematococcus pluvialis

图6 头孢他啶浓度对雨生红球藻生长的影响 Fig.6 Effects of CAZ concentration on growth of Haematococcus pluvialis
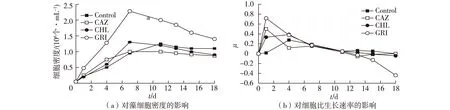
图7 灰黄霉素、氯霉素及头孢他啶单独使用对雨生红球藻生长的影响 Fig.7 Effects of single antibiotics on growth of Haematococcus pluvialis
综合图3~图6可知:在雨生红球藻培养前期(0~8 d),除青霉素表现出对藻细胞生长极大的抑制作用之外,其他3种抗生素的添加均对藻细胞的生长起到不同程度的促进作用。其中,当灰黄霉素添加质量浓度为0.05 mg/mL时,其抑菌效果最优,藻细胞数量高于对照组,且培养8 d时藻细胞密度达到最大值(4.25×106个/mL);0.05 mg/mL的氯霉素在雨生红球藻培养中后期(5~10 d)表现出很好的促进作用,并且此抗生素浓度下,培养8 d 后的细胞密度达(2.2×106个/mL);当头孢他啶添加质量浓度为0.05 mg/mL时,培养5~8 d,藻细胞数量和藻细胞比生长速率均明显优于对照组;然而,添加青霉素作为抑菌剂时,各浓度的青霉素在培养前期对藻细胞的生长都有较强的抑制作用。在培养后期(8 d之后),除青霉素添加实验组外,其他各抗生素实验组中,雨生红球藻细胞数量和比生长速率均显著下降。其中添加0.05 mg/mL的青霉素实验组中,藻细胞密度急剧增长,并且,细胞密度在培养结束时达到3.3×106个/mL。这可能是因为在培养前期,藻细胞对青霉素的敏感性较强,而在培养后期,随着藻细胞数目的增加,原始藻种内伴生的其他微生物大量繁殖,除青霉素外的各抗生素不能够继续起到很好的抑菌效果。
在微藻无菌化培养的研究中,抗生素作为抑菌剂使用的相关报道多集中于各抗生素的单一应用,其中Joo 等考察了多种抗生素对雨生红球藻生长的影响,结果发现抗生素的抑菌效果仅限于10 d以内;赵培等[16]研究了常用抗生素在海洋微藻无菌化培养中的应用,发现仅在培养9 d内各抗生素起到了不同程度的抑菌效果。综上所述,抗生素单独使用无法达到理想的抑菌效果,并且图3~图6的结果表明:在雨生红球藻的培养过程中,单一添加任何常用抗生素作为抑菌剂使用时的抑菌效果均不完善。因此,考虑将抗生素组合使用,在不同的培养阶段添加不同种类和不同浓度的抗生素作为抑菌剂,筛选得到最优的抑菌剂使用方法。
2.3抗生素的组合使用
基于2.1与2.2节实验结果,继续考察灰黄霉素、氯霉素及头孢他啶与青霉素组合使用对雨生红球藻细胞生长的影响,结果见图7和图8。
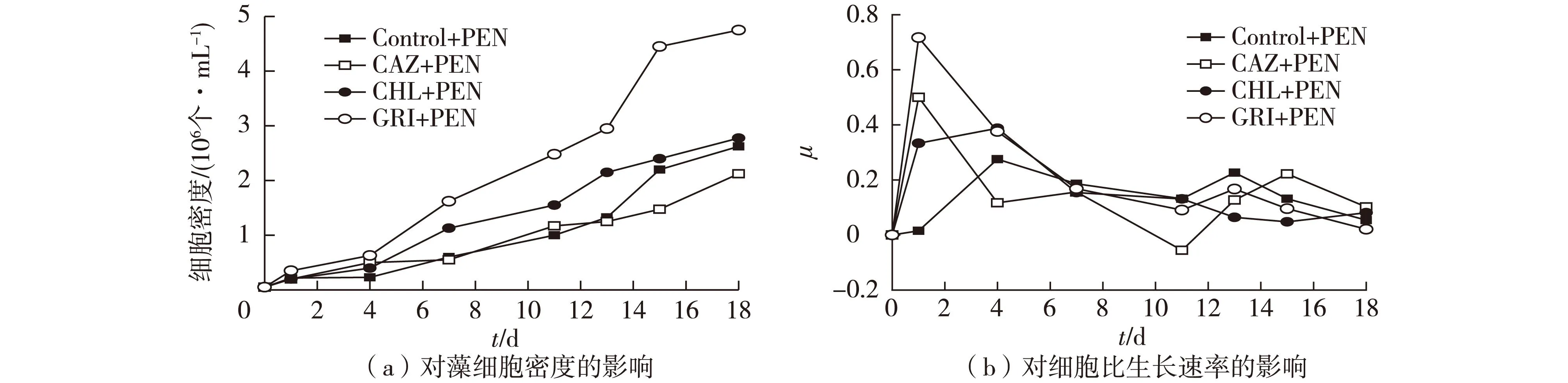
图8 灰黄霉素、氯霉素及头孢他啶与青霉素组合使用对雨生红球藻生长的影响 Fig.8 Effects of combination use of GRI,CHL,CAZ and PEN on growth of Haematococcus pluvialis
综合图7与图8发现,各抗生素与青霉素组合使用所起到的抑菌效果明显优于各抗生素单独使用。其中,由图7可知,在培养前期,加入抗生素的实验组对藻细胞起到很好的促进作用,而随着培养过程的继续,其他微生物的滋生导致培养中后期各组细胞密度骤降;而由图8发现,在培养至第8 天时添加青霉素后,包括对照组在内的各组细胞密度在整个实验进程内一直处于上升趋势,并且灰黄霉素与青霉素组合使用组中,细胞密度最高(4.75×106个/mL),氯霉素与青霉素组合使用效果次之(2.76×106个/mL)。
3结论
研究表明,氯霉素、灰黄霉素、头孢他啶和青霉素这4种常用抗生素均可作为雨生红球藻无菌化处理的抑菌剂。综合考虑抗生素对雨生红球藻细胞生长的杂藻、杂菌的抑制作用,优化得到最适于雨生红球藻的无菌化处理方法:培养初期(0~8 d),添加0.05 mg/mL灰黄霉素作为抑菌剂使用;培养中后期(8 d后),添加0.025 mg/mL的青霉素作为抑菌剂。通过分阶段添加2种不同抗生素作为抑菌剂,可以有效实现雨生红球藻的无菌化培养。
参考文献:
[1]林伟,陈騳,刘秀云.海洋微藻除菌及除菌与自然带菌微藻生长特点比较.海洋与湖沼,2000,31(6):647-652.
[2]Joo H,Lee C.Antibiotics addition as an alternative sterilization method for axenic cultures inHaematococcuspluvialis.J Ind Eng Chem,2007,13(1):110-115.
[3]徐金森,郑天凌,郭清华,等.两种海洋细菌对赤潮藻的细胞生物量的影响研究.海洋科学,2002,26(12):57-67.
[4]Jiménez C,Cossio B R,Niell F X.Relationship between physicochemical variables and productivity in open ponds for the production ofSpirulina:a predictive model of algal yield.Aquaculture,2003,221:331-345.
[5]Engelberg-Kulka H,Sat B,Reches M,et al.Bacterial programmed cell death systems as targets for antibiotics.Trends Microbiol,2004,12(2):66-71.
[6]淦志兵,李美芽,施春雷,等.原壳小球藻对6种常用抗生素的敏感性评价.中国食品学报,2012,12(7):171-177.
[7]麻晓霞,石勋祥,马丽萍,等.小球藻对3种常用抗生素的敏感性研究.安徽农业科学,2011,39(25):15199-15201.
[8]屈建航.5种绿藻对几种常用抗生素的敏感性.大连轻工业学院学报,2004,23(2):111-113.
[9]麻晓霞,马丽萍,石勋祥,等.微藻对常用抗生素敏感性的研究进展.微生物学免疫学进展,2012,40(1):83-86.
[10]王江涛,尹晓楠,宋茜.几种抗生素的抑菌效果及其对中肋骨条藻生长的影响.中国海洋大学学报,2008,38(3):468-472.
[11]周文礼,乔秀亭,肖慧,等.不同海洋饵料微藻对抗生素的敏感性差异分析.武汉大学学报:理学版,2007,53(2):249-254.
[12]Margalith P Z.Production of ketocarotenoids by microalgae.Appl Microbiol Biotechnol,1999,51(4):431-438.
[13]庄惠如,卢海声,陈必链,等.雨生红球藻营养细胞的虾青素累积.水生生物学报,2001,25(4):376-380.
[14]苏忠亮,程江峰,梁成伟,等.雨生红球藻对环境胁迫的分子防御机制.生物技术通报,2009(3):42-45.
[15]黄秀梨.微生物学.北京:高等教育出版社,1999.
[16]赵培,王雪青,朱潮峰,等.3种常用抗生素应用于海洋微藻无菌化培养的研究.天津师范大学学报:自然科学版,2007,27(2):27-30.
[17]周文俊,郑立,郑明刚,等.海洋微藻的无菌化处理及对其生长特性和生化组成的影响.海洋学报,2012,34(6):177-186.
[18]陈淑吟,吉红九,周亚文.青霉素应用于三种海洋微藻保存培养的研究.水产养殖,2004,25(3):31-33.
(责任编辑荀志金)
