桦树皮中白桦脂酸和白桦脂醇的提取与含量测定
2015-10-22陆静等
陆静等

【摘 要】目的:建立桦树皮中白桦脂酸和白桦脂醇的提取和含量测定方法。方法:对比了索氏提取和超声提取方法,采用HPLC-UV方法测定含量,固定相为COSMOSIL5 C18 柱(4.6ID*250mm),流动相为甲醇—0.1%甲酸(80:20),流速1.0(ml/min),柱温30℃,检测波长210nm。结果:采用索氏提取法所得的提取物中白桦脂酸和白桦脂醇含量比超声提取物更高,所建立的HPLC法快速准确,能用于桦树皮中白桦脂酸和白桦脂醇的含量测定。
【关键词】桦树皮;白桦脂酸;白桦脂醇
天然药物桦树皮为桦树科植物白桦(Betula platyphylla Suk)的柔软树皮,具有清热利湿,解毒之功效。白桦树皮在抗肿瘤、抗炎和抗氧化等方面表现出了巨大的潜能,并显示出与以往药物不同的作用机制。桦树皮中的主要活性成分白桦脂醇和白桦脂酸(结构式见图1)都是羽扇烷型三萜类化合物[1-2]。尤其是白桦脂酸,具有广谱的生物学以及药理学活性,在抗肿瘤方面有很大的潜力,能选择性杀死人类黑色素瘤细胞而不杀伤健康细胞[3-5]。据李薇等的文献报道,白桦树皮中提取得到的三萜类物质(TBP),包括白桦脂酸、白桦脂醇、白桦烯三醇、羽扇豆醇等,它们都具有良好的抗肿瘤作用。0.89g/kg和1.2g/kg的TBP对目标瘤株的抑瘤作用均达到30%以上,其中对黑色素瘤B16的抑瘤作用最强,1.2g/kg的TBP的抑瘤率达到50%以上[6]。
白桦脂醇也属羽扇烷型三萜类化合物,虽然也具有一定药理活性和应用价值,但生物活性不高。化学结构与白桦脂酸的差别在于C-28位取代基不同,而C-28取代基的类型对其抗肿瘤活性有较强的影响,这也是白桦脂醇抗肿瘤活性不及白桦脂酸的原因[7]。白桦脂醇无毒,具有抗肿瘤、消炎、抗过敏等功效,在食品、医药、日用化工领域有广泛的应用[8]。故以其为先导化合物,对其结构进行修饰,构建分子多样性的衍生物库,以获得高活性化合物具有重要的研究意义和价值。国外学者对桦木属植物在化学、药理及开发利用方面进行过较多研究,证实白桦脂酸才是桦树皮的重要生物活性成分[9,10]。
本研究对比索氏提取和超声提取两种方法分别提取桦树皮,并采用HPLC-UV方法测定其中白桦脂酸和白桦脂醇的含量。
1 仪器与试剂
1.1 仪器
ME104 /02型电子分析天平(瑞士METTLER TOLEDO公司);arilum pro DI超纯水系统(德国赛多利斯公司);VORTE-GENIE 2型旋涡混合器(美国Scientific Industries公司);Agilent 1260型高效液相色仪(安捷伦Agilent);SB-5200D超声波清洗器(宁波新芝生物技术股份有限公司);N-1100V-WD型旋转蒸发仪(上海爱朗仪器有限公司);四两装高速中药粉碎机(厦门旭朗机械设备有限公司);PL203电子分析天平(梅特勒—托利多仪器上海有限公司);OSB—2100油浴锅(上海爱朗仪器有限公司)
1.2 试剂
桦树皮药材购自大兴安岭,对照品白桦脂酸(批号130920,四川省维克奇生物科技有限公司)、对照品白桦脂醇(批号130914,四川省维克奇生物科技有限公司),甲酸、甲醇、DPPH、乙醇为分析纯,水为双蒸水,HP LC甲醇为色谱纯。
2 实验方法与结果
2.1 色谱条件与系统试用性试验
Agilent 1260型高效液相色仪;色谱柱:COSMOSIL5C18-MS-Ⅱ(4.6ID*250mm)Manf.No.K66428;流动相:甲醇—0.2%甲酸(85:15);流速:1.0(ml/min);柱温:30℃;进样量:20ul;检测波长:210nm。按上述色谱条件进样,白桦脂酸和白桦脂醇与相邻峰的分离度皆大于1.5,理论板数按白桦脂酸峰和白桦脂醇峰皆大于3000,符合测定要求。
2.2 供试品溶液配制
2.2.1 超声提取法供试品溶液的配制
精密称取干燥的桦树皮粗粉5g,于100ml甲醇中超声提取3次,每次20min。滤过,合并3次滤液于旋转蒸发器上旋转蒸发将其浓缩近干。将浓缩后样品转移至100ml容量瓶中用甲醇定容至刻度。
2.2.2 索氏提取法供试品溶液的配制
精密称取干燥的桦树皮粗粉5g,以甲醇为提取溶剂,于索氏提器中水浴恒温85℃提取3次,每次60min。滤过,合并3次滤液于旋转蒸发器上旋转蒸发将其浓缩近干。将浓缩后样品转移至100ml容量瓶中用甲醇定容至刻度。
2.3 对照品溶液配制
称取白桦脂酸对照品11.21mg和白桦脂醇对照品9.69mg,用甲醇溶解于50ml容量瓶中定容至刻度,得0.2242mg/ml白桦脂酸对照品,0.1938mg/ml白桦脂醇对照品。在相同操作下,精密配制浓度为3.681mg/ml白桦脂醇对照品溶液,1.136mg/ml白桦脂酸对照品溶液后混合,精密吸取混合对照品溶液5.00ml、2.50ml、1.25ml、0.63ml、0.31ml分别置于10ml量瓶中,加甲醇定容至刻度,得浓度为0.6-0.03mg/ml白桦脂酸和2.0-0.1mg/ml白桦脂醇的一系列对照品溶液,作线性范围考察。
2.4 线性范围考察
按2.3项下线性考察对照品配制方法,在2.1项下色谱条件,分别进样测定。以峰面积(Y)对进样量(X)进行线性回归,得回归方程:白桦脂酸Y=5618.3X+107.71,r=0.9992;白桦脂醇Y=6578.6X+77.11,r=0.9994。
2.5 精密度实验
取2.3项下0.2242mg/ml白桦脂酸对照品,0.1938mg/ml白桦脂醇对照品溶液,分别重复进样6次,记录色谱峰面积,计算 RSD,白桦脂酸、白桦脂醇RSD分别为:结果白桦脂酸、白桦脂醇RSD分别为0.41%和0.44%。
2.6 稳定性实验
取索氏提取的一个样品,分别于0,1,2,4,8,12,24h进样,考察稳定性,结果供试品在24h内稳定,白桦脂酸、白桦脂醇RSD分别为:1.6%、1.2%。
2.7 回收率实验
精密称取白桦脂酸和白桦脂醇对照品,加入甲醇配制成白桦脂酸0.18,0.36,0.54mg/ml,白桦脂醇0.14,0.28,0.42mg/ml,按2.2项下供试品溶液制备方法制得,取20μL进样测定,计算高中低三个浓度回收率。结果平均回收率为98.80%,RSD为1.5%
2.8 样品含量测定
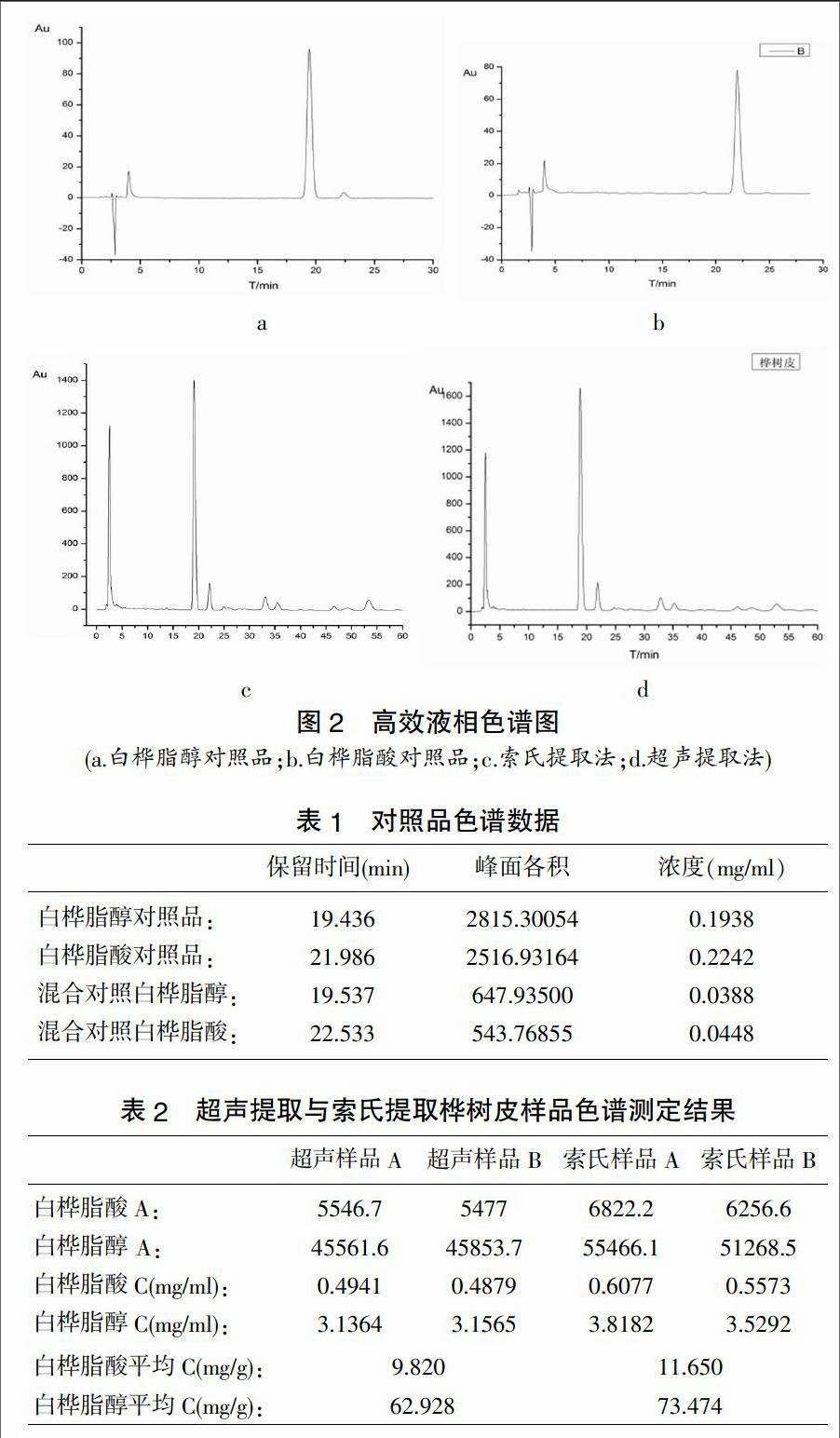
取2.2.1和2.2.2项下两份供试品溶液,按2.3项下色谱条件进样分析色谱图见图1,实验结果见表1。
3 讨论
由图1与表1,表2可知索氏提取的样品峰面积均大于超声提取的对应峰面积,超声提取白桦脂酸C(mg/ml)=0.4910,白桦脂醇C(mg/ml)=3.1464索氏提取白桦脂酸C(mg/ml)=0.5825,白桦脂醇C(mg/ml)=3.6737,所以索氏提取桦树皮中的白桦脂酸和白桦脂醇的效果优于超声提取法,故采用索氏提取法进行提取。
【参考文献】
[1]Hao Ren, Shigetoshi Omori. A simple preparation of betulinic acid from sycamore bark[J]. J Wood Sci, 2012(58):169-173.
[2]Thuc Dinh Ngoc, Nico Moons, Youngju Kim, Wim De Borggraeve, Anastassiya Mashentseva,Graciela Andrei, Robert Snoeck, Jan Balzarini, Wim Dehaen. Synthesis of triterpenoid triazine derivatives from allobetulone and betulonic acid with biological activities[J]. Bioorganic & Medicinal Chemistry, 2014(22):3292-3300.
[3]Spivak Anna Yu, Keiser Jennifer, Vargas Mireille, Gubaidullin Rinat R., Nedopekina Darya A., Shakurova Elvira R., Khalitova Rezeda R., Odinokov Victor N.. Synthesis and activity of new triphenylphosphonium derivatives of betulin and betulinic acid against Schistosoma mansoni in vitro and in vivo[J]. Bioorganic & Medicinal Chemistry, 2014(22):6297-6304.
[4]Fulda S. Betulinic acid for cancer treatment and prevention[J]. Int. J. Mol. Sci., 2008(9):1096-1107.
[5]Bori Ibrahim D., Hung Hsin-Yi, Qian Keduo, Chen Chin-Ho, Morris-Natschke, Susan L., Lee Kuo-Hsiung. Anti-AIDS agents 88. Anti-HIV conjugates of betulin and betulinic acid with AZT prepared via click chemistry[J]. Tetrahedron Letters,2012(53):1987-1989.
[6]李薇,李岩,金雄杰.白桦三萜类物质的抗肿瘤作用及其对免疫功能的增强效应[J].中国免疫学杂志,2000,9(16):485-486.
[7]Ding Weimin, Sun Miao, Luo Shaman, Xu Tao, Cao Yibo, Yan Xiufeng, Wang Yang. A 3D QSAR Study of Betulinic Acid Derivatives as Anti-Tumor Agents Using Topomer CoMFA: Model Building Studies and Experimental Verification[J]. Molecules, 2013,18,10228-10241.
[8]韩世岩,方桂珍,李珊珊,马艳丽.四氢吠喃-苯混合溶剂法分离纯化桦木醇[J].林产化学与工业,2005,25:129-132.
[9]Cichewicz R H, Kouzi S A. Chemistry,biological activity,and chemotherapeutic potential of betulinic acid for the prevention and treatment of cancer and HIV infection[J]. Med. Res. Rev. 2004,24:90-114.
[10]李丹,周金培,吴晓明.白桦酸及其衍生物的研究进展[J]. 药物化学,2004,28(3):120-125.
[责任编辑:汤静]
