西洛他唑对脂多糖诱导的人THP-1单核细胞分泌TNF-α的影响及机制探讨
2015-10-22陈添华颜程光王俊谊李志樑
陈添华,颜程光,王俊谊,李志樑
(1.井冈山大学临床医学院,江西,吉安 343000;2.井冈山大学附属医院,江西,吉安 343000;3.南方医科大学附属珠江医院,广东,广州 510280)
西洛他唑对脂多糖诱导的人THP-1单核细胞分泌TNF-α的影响及机制探讨
*陈添华1,颜程光1,王俊谊2,李志樑3
(1.井冈山大学临床医学院,江西,吉安343000;2.井冈山大学附属医院,江西,吉安343000;3.南方医科大学附属珠江医院,广东,广州510280)
目的 研究西洛他唑对脂多糖诱导的人THP-1单核细胞分泌TNF-α的影响,探讨西洛他唑对单核细胞的炎症调控作用。方法 体外培养人THP-1单核细胞,分为对照组(A组)、LPS组(B组)、西洛他唑组(C组)、西洛他唑+SQ22536组(D组),C组和D组加入LPS刺激24 h。应用ELISA法检测各组细胞培养上清TNF-α水平,并测定各组细胞内cAMP浓度。结果 西洛他唑能抑制LPS刺激的人THP-1单核细胞分泌TNF-α,同时升高细胞内cAMP浓度。结论 西洛他唑可抑制LPS刺激的人THP-1单核细胞分泌TNF-α,这种作用可能与升高细胞内cAMP浓度有关。
西洛他唑;脂多糖;人THP-1单核细胞;肿瘤坏死因子α
动脉粥样硬化(atherosclerosis,AS)是一种慢性炎症和免疫性疾病,其发生发展始终伴随炎症和免疫反应[1-2]。单核/巨噬细胞浸润是AS过程中的重要特征之一。单核细胞迁移并聚集在血管内膜下发挥重要的生物学效应。近年研究表明,西洛他唑除具有抗血小板作用外,还有抗炎及抗动脉粥样硬化作用[3]。本实验研究西洛他唑对脂多糖(lipopolysacchar, LPS)诱导的人THP-1单核细胞分泌TNF-α的影响,以期为临床冠心病合理用药提供基础研究依据。
1 材料与方法
1.1主要试剂
RPMI 1640培养液(Hyclone公司),胎牛血清(美国Gibco公司),脂多糖(LPS 美国Sigma公司),人TNF-α ELISA试剂盒(美国Genzyme公司),西洛他唑(浙江大冢制药有限公司),cAMP ELISA检测试剂盒(美国R&D公司)。
1.2 人THP-1单核细胞培养
THP-1细胞株购自中国典型培养物保藏中心。细胞接种于含10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素、2 mM 谷氨酰胺的RPMI 1640培养基中,在37 ℃、含5% CO2的恒温培养箱中培养。待细胞生长良好,行台盼蓝拒染试验显示活细胞 > 95%,根据实验目的调整细胞密度进行实验,本实验在南方医科大学中医症候实验室完成。
1.3实验分组
实验分为四组,空白对照组(A组),LPS组(B组),西洛他唑组(C组:LPS100 μg/L + 西洛他唑20 μmol/L),西洛他唑 + SQ22536组(D组:LPS100 μg/L + SQ22536 10 μmol/L + 西洛他唑20 μmol/L),每组设三个复孔,于六孔培养板以1×106/孔进行接种。A组直接加入RMPI1640 培养基2 mL,B组培养液中含终浓度为100 μg/L的LPS。C组细胞先加入西洛他唑干预12 h,再给予终浓度为100 μg/L的LPS作用24 h,D组细胞先加入SQ22536培养0.5 h,然后加入入西洛他唑干预12 h,再给予终浓度为100 μg/L的LPS作用24 h。各组均在37 ℃、5% CO2培养箱内孵育。
1.4酶联免疫吸附试验(ELISA)
细胞培育后分别收集上清液,按试剂盒说明书测定浓度。简要步骤如下:将TNF-α标准品 (倍比稀释法:1000、500、250、125、62.5、31.25、15.6、0 ng/L)和待测样品加入酶标孔,每孔100 μL,孵育120 min,洗板5次。加酶结合物工作液100 μL/孔。封住板孔,室温孵育30 min,洗板5次。加入底物显色剂避光室温30 min。加终止液。ELISA 酶标仪在450 nm波长下读取各孔吸光度值(A值)。以浓度值为横坐标,所测各标准品A值为纵坐标绘制标准曲线。从标准曲线上查得相应的浓度值,以ng/L表示。每个等测值均做五个样本。
1.5细胞内cAMP测定
细胞培育后收集各组细胞,使用细胞裂解缓冲液裂解细胞,按试剂盒说明书测定细胞内cAMP浓度。简要步骤如下:加入主要抗体溶液到除非特异性结合孔(NSB)的所有孔。室温下在旋涡混合器500 rpm孵育1 h后用洗涤液清洗,洗板四次。再加入标准品、对照品或样品到各孔。后加入50 μL辣根过氧化物酶标记的cAMP到所有孔。室温下在旋涡混合器孵育2 h。吸去孔内液体并加入洗涤液清洗,洗板4次。最后一次清洗后,加入底物溶液到所有孔。室温下避光孵育30 min后每孔加入中止液。30 min内用酶标仪在450 nm测定OD值。
1.6统计学分析
采用SPSSl3.0统计软件进行统计学分析,用方差分析判断均数差异的显著性。计量资料以±s表示。P < 0.05为差异有统计学意义。
2 结果
2.1 各组细胞培养上清液TNF-α浓度
与对照组比较,LPS100 μg/L刺激后,THP-1单核细胞合成TNF-α明显增加,西洛他唑能抑制LPS诱导人THP-1单核细胞合成TNF-α,加入SQ22536后,西洛他唑抑制LPS诱导人THP-1单核细胞合成TNF-α的作用减弱,差异均有显著性(P<0.05),结果见表1。
2.2各组细胞内cAMP测定
与对照组比较,LPS组细胞内cAMP浓度无明显差异,西洛他唑组细胞内cAMP浓度明显升高,差异有显著性(P<0.05)。西洛他唑组和西洛他唑+ SQ22536组细胞内cAMP浓度比较差异无显著性,结果见表1。
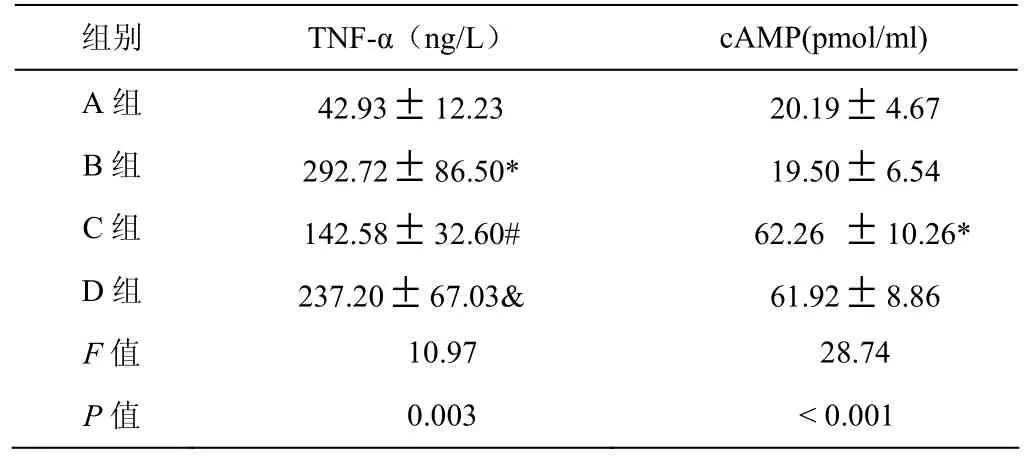
表1 各组TNF-α与cAMP比较Table 1 The comparison of TNF-αand cAMP in groups
3 讨论
冠心病是多种危险因子作用于不同环节所致的慢性疾病,其中AS是冠心病的病理生理基础,炎症和免疫反应是动脉粥样硬化(AS)发生发展的关键[1-2,4]。随着医学研究的进一步深入,发现AS不仅是血管局部炎症病变,还是多种免疫细胞异常导致的全身免疫紊乱[5]。单核-巨噬细胞是重要的免疫细胞,也是AS斑块的重要组成部分。初始的血管炎症损伤产生的炎症细胞因子可吸引单核细胞到达损伤局部并进入动脉内膜下间隙,激活并分化成巨噬细胞并最终成为泡沫细胞。单核-巨噬细胞将外源性抗原递呈给T 淋巴细胞,激活获得性免疫系统,从而加重血管炎性病变[6]。
单核细胞可分泌TNF-α等多种细胞因子,作为体内重要的致炎因子,TNF-α能参与T淋巴细胞的增生以及对炎症免疫反应有调节功能,同时能诱导淋巴细胞的黏附和趋化以及血小板的黏附等致炎症作用,TNF-α还与斑块中的T淋巴细胞浸润、斑块的不稳定以及血栓形成高度相关[7-8[。As 斑块中的单核-巨噬细胞分泌多种炎性细胞因子,如TNF-α、单核细胞趋化蛋白1( MCP-1) 和IL-6,可以进一步加剧单核细胞聚集、巨噬细胞的增殖以及平滑肌细胞的迁移、增殖,从而促使As 斑块不断进展[9-10]。
西洛他唑是一种抗血小板药物,通过抑制血小板及血管平滑肌内磷酸二酯酶活性,从而增加血小板及平滑肌内cAMP浓度、发挥抗血小板作用及血管扩张作用。研究表明,西洛他唑还有抗炎、免疫调节及抗AS作用。Lee等研究发现[11],西洛他唑能减小低密度脂蛋白受体缺陷小鼠AS的面积,能减少TNF-a的合成,同时在斑块局部巨噬细胞聚集减少和MCP-1下降。西洛他唑还能抑制LPS诱导的巨噬细胞IL-1β、IL-6及TNF-α的合成[12]。另一项研究发现[13],西洛他唑在体外能抑制T细胞的增殖及炎症因子IL-17、TNF-a、以及IFN-γ的产生;同时,西洛他唑可抑制Th-1及Th-17的分化,增加调节性T细胞(CD4+ CD25+ FoxP3+T cells,Treg cells)的数量。在我们既往的研究中也发现,西洛他唑能抑制LPS诱导的DC2.4细胞IL-6及TNF-α的合成[14]。
在实验中我们用西洛他唑对人THP-1单核细胞进行预干预,然后用LPS诱导激活THP-1单核细胞。结果发现,西洛他唑预干预能抑制LPS诱导的THP-1人单核细胞合成TNF-α,同时细胞内cAMP浓度明显升高,采用SQ22536(一种不可逆的cAMP拮抗剂)对西洛他唑进行干预,能够减弱西洛他唑抑制LPS诱导人THP-1单核细胞合成TNF-α的作用。因此,我们推测:西洛他唑抑制LPS诱导的THP-1人单核细胞合成TNF-α,这种作用至少部分是通过升高细胞内cAMP浓度实现的,而更进一步的机制将在后续的实验中进一步探讨。
总之,本实验结果表明,西洛他唑能抑制LPS诱导的人THP-1单核细胞TNF-α的合成,这种作用可能是至少部分是通过升高细胞内cAMP浓度实现的。本实验证明西洛他唑能抑制单核细胞的炎症因子TNF-α的释放,进而可能产生抗炎及抗AS作用,为临床西洛他唑治疗冠心病提供理论依据。
[1] Ross R.Atherosclerosis—an inflammatory disease[J].New England journal of medicine,1999, 340(2): 115-126.
[2] Wick G, Xu Q.Atherosclerosis—An autoimmune disease![J].Experimental gerontology,1999,34(4):559- 566.
[3] Takase H, Hashimoto A, Okutsu R, et al.Antiatherosclerotic effect of cilostazol in apolipoprotein- E knockout mice[J].Arzneimittelforschung, 2007, 57(4): 185-191.
(参考文献[4]- [14][4] 周玉梅, 袁春凤, 刘莲凤,等.社区护理干预对冠心病患者的效果评价[J].井冈山大学学报:自然科学版,2010,31(1):116-117.
[5] Hansson G K.Atherosclerosis—an immune disease: the Anitschkov Lecture 2007[J].Atherosclerosis, 2009,202(1): 2-10.
[6] Schmitz G,Grandl M.Role of redox regulation and lipid rafts in macrophages during Ox-LDL mediated foam cell formation [J].Antioxid & Redox Signal,2007,9(9): 1499-1518.
[7] Fu R H, Hran H J, Chu C L, et al.Lipopolysaccharidestimulated activation of murine DC2.4 cells is attenuated by n-butylidenephthalide through suppression of the NF-κB pathway[J].Biotechnology letters, 2011, 33(5): 903-910.
[8] 牟永成,侯秀丽.炎症因子与动脉粥样硬化[J].新缰医学,2013,43(2):82-86.
[9] Koenig W,Khuseyinova N.Biomarkers of atherosclerotic plaque instability and rupture[J].Arterioscler Thomb Vasc Biol,2007,27( 1):15-26.
[10] Singh U,Dasu M R,Yancey P G, et al.Human C-reactive protein promotes oxidized low density lipoprotein uptake and matrix metalloproteinase-9 release in Wistar rats[J].Journal of Lipid Research,2008,49( 5):1015-1023.
[11] Lee J H, Oh G T, Park S Y, et al.Cilostazol reduces atherosclerosis by inhibition of superoxide and tumor necrosis factor-alpha formation in low-density lipoprotein receptor-null mice fed high cholesterol[J].Journal of Pharmacology and Experimental Therapeutics, 2005,313(2): 502-509.
[12] Park W S, Jung W K, Lee D Y, et al.Cilostazol protects mice against endotoxin shock and attenuates LPS-induced cytokine expression in RAW 264.7 macrophages via MAPK inhibition and NF-kappa B inactivation: not involved in cAMP mechanisms[J].International Immunopharmacology, 2010,10(9): 1077-1085.
[13] Wang S L, Yan C H, Xu H, et al.Suppression of encephalitogenic T-cell responses by cilostazol is associated with upregulation of regulatory T cells [J].Neuroreport, 2010, 21(9): 629-635.
[14] Chen T H, Li Z L, Fu Q, et al.Cilostazol suppresses LPS-stimulated maturation of DC2.4 cells through inhibition of NF-κB pathway[J].Journal of Applied Biomedicine, 2012, 10(4):177-186.
INFLUENCE AND MECHANISM OF CILOATAZOL ON LPS INDUCED TNF-Α SECRETION OF HUMAN THP-1 MONONUCLEAR CELLS
*CHEN Tian-hua1, YAN Cheng-guang1, WANG Jun-ying2, LI ZHi-liang3
(1.School of clinical Medicine,Jinggangshan University,Ji’an,Jiangxi 343000,China;
2.The Affiliated Hospital of Jinggangshan University, Ji’an,Jiangxi 343000,China;
3.The Affiliated Zhujiang Hospital of Southern Medical University,Guangzhou, Guangdong 510280, China)
Objective: To study the mechanism and influence of ciloatazol on LPS induced TNF-α secretion of Human THP-1 mononuclear cells and explore the inflammation regulating function of cilostazol on monocytes.Methods: The human THP-1 mononuclear cells were cultured in vitro and divided into 4 groups as control group(A group), LPS group (B group), cilostazol group (C group), cilostazol plus SQ22536 group (D group).C and D group were stimulated with LPS for 24 h.The TNF-α in supernatant and intracellular cAMP in human THP-1 mononuclear cells on each group was measured by ELISA method.Results: Cilostazol could suppress the LPS induced TNF-α secretion of human THP-1 mononuclear cells and simultaneously increase the intracellular cAMP concentration.Conclusion: Cilostazol could suppress the LPS induced TNF-α secretion of human THP-1 mononuclear cells which might be related to the increasment of the intracellular cAMP concentration.
cilostazol; lipopolysacchar; human THP-1 mononuclear cell; TNF-α
R541.4
ADOI:10.3969/j.issn.1674-8085.2015.02.018
1674-8085(2015)02-0078-03
2015-01-12;修改日期:2015-02-12
*陈添华(1976-),男,江西永新人,副主任医师,博士,主要从事冠心病免疫机制研究(E-mail:386345973@qq.com);
颜程光(1967-),男,江西永新人,副教授,主要从事冠心病心律失常研究(E-mail:1250418623@qq.com);
王俊谊(1971-),男,江西吉安人,副主任医师,主要从事冠心病早期发病机制研究(E-mail:2746700690@qq.com);
李志樑(1958-),男,福建龙岩人,主任医师、教授,博士生导师,主要从事冠心病早期发病机制研究(E-mail:lizhiliang58@163.com).
