86例新生儿重度急性呼吸窘迫综合征回顾分析
2015-10-21李文斌常立文刘伟容志惠蔡保欢
李文斌 常立文 刘伟 容志惠 蔡保欢
DOI:10.3760/cma.j.issn.1671-0282.2015.03.006
基金项目:国家自然科学基金(81370099);2011国家临床重点专科建设项目;“十五”国家科技攻关计划资助项目(2004BA720A11);湖北省自然科学基金资助项目(2013CFB087);华中科技大学自主创新研究基金(国际科技合作专项2014XJGH008)
作者单位:430030 武汉,华中科技大学同济医学院附属同济医院儿科
通信作者:常立文,Email:lwchang@tjh.tjmu.edu.cn
【摘要】目的 参照柏林会议标准探讨新生儿重度急性呼吸窘迫综合征(ARDS)的诊断、治疗及预后。 方法 回顾性分析华中科技大学同济医学院附属同济医院2005年1月至2013年12月收治的86例新生儿重度ARDS患儿的诊断、治疗、胸部X线特点、病死率、并发症发生情况及使用呼吸机参数等临床资料。结果 (1)86例患儿治愈55例,死亡31例,病死率36.0%(31/86);(2)入院胸部X线片示双肺透亮度降低呈毛玻璃状,肺纹理粗乱或可见小点片状或斑片状阴影者36例;双肺弥漫性浸润影且有大片融合实变,可见“支气管充气征”者26例;心影、膈面不清,甚至呈“白肺”改变者24例;(3)合并持续肺动脉高压(PPHN)者68例,发生率79.1%(68/86);(4)將86例患儿分为存活组和死亡组,结果显示,与存活组比较,死亡组上呼吸机前所需FiO2更高、PaO2及PaO2/FiO2更低(P<0.01),且上呼吸机后所需吸气峰压(PIP)初调值更高(P<0.01)。结论 新生儿ARDS病情危重,病死率高;目前尚缺乏统一的诊断标准;对其治疗,应是在给予相应呼吸支持治疗基础上的综合治疗。
【关键词】急性呼吸窘迫综合征;诊断;治疗;新生儿;回顾性分析
A retrospective analysis of 86 newborns with severe acute respiratory distress syndrome
Li Wenbin, Chang Liwen,Liu Wei, Rong Zhihui, Cai Baohuan. Department of Pediatrics, Tongji Hospital Affiliated to Tongji Medical College, Huazhong University of Science and Technology, Wuhan 430030, China
Corresponding author: Chang Liwen, Email: lwchang@tjh.tjmu.edu.cn
【Abstract】Objective To investigate the diagnosis, treatment and prognosis of neonates with severe acute respiratory distress syndrome (ARDS) according to Berlin definition. Methods A retrospective study was carried to analyze the clinical features about diagnosis, treatment, chest X-ray findings, mortality, complications and ventilator parameters in 86 neonates with severe ARDS admitted in the NICU from January 2005 to December 2013. Results (1) Among the 86 cases, 55 were cured, and 31 died with 36.0% mortality. (2) Chest X-ray showed there was decreased lucency of bilateral lungs with ground-glass appearance, lung texture with thick chaos or dot flakes or patchy shadows in 36 neonates; diffuse infiltrates and extensive confluent consolidation shadows in bilateral lungs along with peripheral air brornchograms in 26 cases; heart shadow and diaphragmatic surface disappeared like a “white lung” change in 24 cases. (3) Persistent pulmonary hypertension of newborn as a complication occurred in 68 cases with 79.1% incidence. (4) Eighty-six cases were categorized into survival group and death group. The results showed compared with the survival group, the neonates in death group required higher FiO2, and PaO2,and lower PaO2/FiO2before mechanical ventilation (P<0.01), but needed higher initial PIP of mechanical ventilation (P<0.01). Conclusions Neonatal ARDS is still a kind of critical condition with high mortality and lack of evidence-based diagnostic criteria so far. The therapeutic strategy for neonatal ARDS should be a comprehensive measures in addition to appropriate respiratory support.
【Key words】Acute respiratory distress syndrome; Diagnosis; Treatment; Neonate; Retrospective analysis
急性肺损伤(acute lung injury,ALI)/ 急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS) 是由多种原因引起的肺部弥漫性损害,以顽固性低氧血症、呼吸窘迫、肺顺应性下降和弥漫性渗出为主要特征,ARDS是ALI的严重形式。有报道,ARDS病死率高达50%[1-2]。导致ALI / ARDS的高危因素分为直接性和间接性因素两类。与成人和年长儿不同,围生期窒息、败血症是导致新生儿间接肺损伤的最常见高危因素,而胎粪吸入综合征(MAS)、肺炎则是导致新生儿直接肺损伤的最常见高危因素。此外,高浓度供氧、呼吸机相关性肺损伤亦是新生儿期肺损伤的重要原因[3]。
然而ALI / ARDS的诊断标准一直以来备受争议。2011 年在德国柏林, 由欧洲危重症协会发起, 联合美国胸科学会、美国危重症学会,共同修订了 ARDS 诊断标准, 提出了 ARDS 的新定义[4-5]。该标准的重要特征是取消 ALI 诊断, 将 ARDS 分为轻、中、重度进行诊断。然而迄今尚无统一的儿童ARDS的诊断标准,更无新生儿的诊断标准[6-7]。目前普遍引用的新生儿ARDS诊断标准为Demirakca等[8]参照1994 年欧美联席会议(AECC)的ALI/ARDS诊断标准所制订。本研究结合新的柏林会议精神和Demirakca提出的新生儿ARDS诊断标准,回顾性分析了华中科技大学同济医学院附属同济医院2005年1月至2013年12月收治的86例新生儿重度ARDS患儿的临床资料,现报道如下。
1 资料与方法
1.1 一般资料
2005年1月至2013年12月华中科技大学同济医学院附属同济医院儿科收治的新生儿重度ARDS患儿86例,其中,男52例, 女34例;出生胎龄34+3至41+1周,(37.6±1.2)周;出生体质量2430~ 3580 g,(2950±356)g;入院日龄10 min至3 d。剖宫产58例,顺产28例;母孕期异常病史(糖尿病、妊娠高血压综合征、子痫、先兆子痫前期、感染性疾病)18例;羊水清32例,Ⅰ度污染15例,Ⅱ度污染13例,Ⅲ度污染26例;脐带异常(绕颈、打结、受压、细小、单脐动脉)14例;胎盘异常(前置、早剥、帆状)11例;有明确宫内窘迫史 12例,出生后重度窒息史23例;胎膜早破21例;新生儿肺炎28例,新生儿败血症5例。
1.2 诊断标准及排除标准
所有患儿均符合:(1)胎龄大于34 周;(2)急性起病,发病时间均在出生后3 d内;(3)有严重原发病,如窒息、感染、胎粪吸入等病史,在原发病开始或恶化后数小时至1~3 d内,即出现进行性呼吸困难、青紫;(4)动脉血氧分压( PaO2) / 吸入氧体积分数(FiO2)<100 mmHg(1 mmHg=0.133 kPa)且呼气末正压(PEEP)或持续气道正压(CPAP)≥5 cmH2O(1 cmH2O=0.098 kPa);(5)胸片顯示双肺浸润影伴肺水肿改变;(6)超声心动图检查无左房高压表现;(7)除外因气胸、先天性呼吸系统发育畸形、颅内出血及感染、遗传代谢性疾病以及先天性心脏病等所致的呼吸窘迫。
1.3 治疗方法
(1)所有患儿均予以呼吸机(德国Christina或Stephanie常频/高频婴儿呼吸机)辅助通气治疗。首选呼吸机模式为SIMV模式,预调参数: FiO2为40%~ 100%,吸气峰压(PIP) 为20~35 cmH2O,PEEP为5~6 cmH2O,呼吸频率(RR)为35~45 次/ min。PaO2稳定在60~90 mmHg,动脉血氧饱和度(SaO2) 在90% ~ 95%,动脉二氧化碳分压(PaCO2)在35~ 50 mmHg;若SIMV模式下, SaO2仍不能稳定在 85% ~ 95%者,改用 HFOV 治疗, HFOV初调参数: FiO2为0.60~ 1.0,振荡频率(f) 10~ 15 Hz,振幅(Paw) 40~50 cmH2O,平均气道压(Pmean)比常频高 2~3 cmH2O或与常频相等,偏置气流(bias flow) 6 L/min,并在使用HFOV模式治疗后2 h内行X线胸片检查,使膈肌平第8~9后肋水平。(2)限制液体量60~80 mL/(kg·d),并适当使用利尿剂速尿0.5~1.0 mg/(kg·次)。(3)血管活性药物的使用,给予多巴胺及多巴酚丁胺,起始量均为5 μg/(kg·min),并视患儿血压及病情予以调整。(4)小剂量肺表面活性物质(pulmonary surfactant,PS)应用,尽早使用猪PS(固尔苏,凯西制药公司,意大利)100 mg/(kg·次)或牛PS(珂立苏,北京双鹤现代医药技术有限责任公司,中国)40~70 mg/(kg·次),并视情况重复使用2~4次。(5)视有否合并持续肺动脉高压(persistent pulmonary hypertension of newborn, PPHN),予以西地那非(万艾可,辉瑞制药有限公司,美国)0.5~1.0 mg/kg,q6~8 h。(6)纠酸并适当碱化血液,使血pH值维持在7.40~7.50。(7)控制感染,予以相应抗生素治疗。(8)其他对症支持治疗,包括维持血糖稳定、护肝、护心、护脑等治疗。
1.4 观察指标
观察并记录患儿生命体征,早期床旁动态监测患儿血气、肝肾功能及电解质,行胸片及心脏彩超检查。行头颅B超检查,并在患儿病情允许情况下,尽早行头颅MRI检查。
1.5 统计学方法
所有数据采用SPSS 16.0 软件进行分析。正态分布的计量资料采用均数±标准差(x±s)表示,两样本均数比较采用两独立样本t检验,计数资料采用率表示,组间差异比较采用χ2检验。非正态分布的计量资料采用中位数(M)和四分位数表示,组间差异比较采用Wilcoxon秩和检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 合并症及转归
86例患儿中,合并1个脏器受损31例, 2个脏器受损17例,3个及以上脏器受损9例;合并肺出血13例,颅内出血11例;合并气胸4例,气腹1例。治愈55例,死亡(包括放弃后死亡)31例,病死率36.0%(31/86)。
2.2 胸部X线
入院胸片结果示双肺透亮度降低呈毛玻璃状,肺纹理粗乱或可见小点片状或斑片状阴影者36例;双肺弥漫性浸润影且有大片融合实变,可见“支气管充气征”者26例;心影、膈面不清,甚至呈“白肺”改变者24例。
2.3 心脏彩超
均无左房高压表现。合并PPHN者68例,发生率79.1%(68/86)。
2.4 呼吸机使用情况
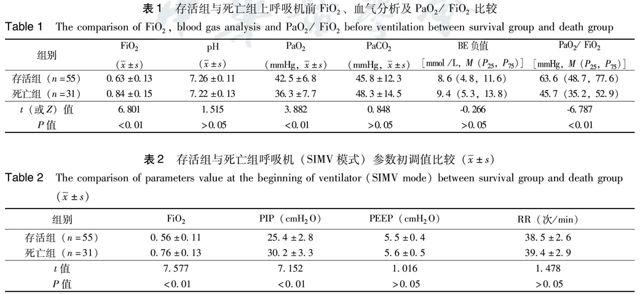
将86例患儿分为2组:存活组和死亡组,并将2组患儿使用呼吸机前FiO2、血气分析、PaO2/FiO2比值以及呼吸机初调值、使用呼吸机模式等情况进行比较,结果显示:(1)上呼吸机前,与存活组比较,死亡组FiO2明显增高,而PaO2及PaO2/FiO2明显降低,差异具有统计学意义(P<0.01)(表1);(2)上呼吸机后,与存活组比较,死亡组FiO2及PIP初调值明显增高,差异具有统计学意义(P<0.01)(表2);(3)存活组与死亡组分别有9例和23例改用HFOV模式进行治疗,差异具有统计学意义(χ2=28.378,P<0.01)。
3 讨论
与新生儿呼吸窘迫综合征(即肺透明膜病,多发生于早产儿,主要是由于原发性PS缺乏所致)不同,新生儿ARDS多继发于围生期窒息、败血症、MAS、肺炎等。统计资料表明,新生儿ARDS约占所有需要机械通气新生儿的1%~2%,病死率与成人和儿童相似,约为50%~60%;总体上,约20%~40%具有高危因素患者可发展为ARDS,且同一个体具有高危因素越多,发生ARDS可能性越大[3]。
有关ARDS的诊断标准一直以来存在争议。2011年ARDS的柏林诊断标准是在1994年AECC诊断标准基础上的进一步完善。该标准去除了ALI的诊断,并依据患者氧合状态提出了3 个相对独立的 ARDS 诊断分度: 在 CPAP/PEEP≥5 cmH2O 时,200 mmHg2/FiO2≤300 mmHg 为轻度;100 mmHg2/FiO2≤200 mmHg 为中度;Pa O2/FiO2≤100 mmHg 为重度。同时,该标准还强调了起病时间、肺水肿原因和胸部 X 线改变。应用新标准对4个多中心4 188 例患者和3 个单中心269 例患者的数据进行分析显示,ARDS患者病死率中位数轻度为27% (95%CI:24%~30%) , 中度为 32% ( 95%CI:9%~34%) , 重度为45%( 95%CI:42%~48%) ,与 AECC 标准进行统计学分析发现,新标准对于预测 ARDS 病死率具有更高的准确性,故获得了欧美危重病学界的一致认可[4]。但是,儿童并不是缩小版的成人,儿童ARDS不能简单套用成人标准,尤其是新生儿[9]。2013年欧洲儿科新生儿重症监护学会(the European Society for Pediatric Neonatal Intensive Care, ESPNIC)呼吸学组开展了一项回顾性研究来评估柏林标准应用于婴幼儿的可行性,藉此希望能达成共识[10]。该研究纳入了欧洲7个PICU中心,共计221例中位数年龄为6月龄(2~13个月龄),既往诊断为ALI或ARDS的患儿,应用新标准对上述病例进行系统分析发现, ARDS 病死率中位数分别为轻度13.9 %、中度11.3 %、重度28.4 %,三者比较差异具有统计学意义(P<0.01)。因此,对于判断患儿预后,柏林标准同样适用于儿童。那么,柏林标准是否适合新生儿?目前仍缺乏相关研究予以支持。鉴于迄今为止仍无统一的新生儿ARDS诊断标准,为了排除一些疑似病例和混杂因素的干扰,本研究结合柏林标准和Demirakca提出的新生儿ARDS诊断标准,仅将本院9年来收治的86例新生儿重度ARDS患儿的临床资料进行了回顾性分析,结果显示,重度ARDS病死率为36.0%(31/86),低于上述成人中位数病死率45%,但高于婴幼儿中位数病死率28.4 %。新生儿ARDS的实际病死率尚有待于多中心大样本的临床流行病学调查确认。
在治疗上,尽管对于轻症ARDS患儿可考虑使用鼻塞持续气道正压(nCPAP)进行呼吸支持治疗,但对于重度ARDS患儿来说,呼吸机辅助通气仍是其治疗基础[11-12]。另外,在通气模式的选择上,常频或高频通气孰优孰劣目前仍无定论[12]。本研究结果显示,与存活组比较,死亡组上呼吸机前所需FiO2更高、PaO2及PaO2/FiO2更低(P<0.01),且上呼吸機后所需PIP初调值更高(P<0.01),故这些参数在疾病初期对患儿预后的判断具有一定价值。
ARDS患儿存在广泛严重的肺泡损害和间质性肺水肿,肺泡腔有大量炎性渗出,可产生继发性PS不足和灭活增加,因此,适当补充PS有助于改善ARDS患儿的氧合、降低呼吸机参数,但对其预后及降低其病死率无明显影响[2, 9, 13-14]。必要时可考虑适当重复使用。
由于新生儿循环系统的特点,当缺氧、酸中毒时可导致卵圆孔和动脉导管的再次开放,因此RDS患儿易合并PPHN [15-17]。本研究结果证实,79.1%(68/86)的重度ARDS患儿合并PPHN。对于PPHN的治疗,最为有效的方式应是吸入一氧化氮(iNO),iNO能高度选择性扩张肺血管床,降低肺动脉压力,有条件单位还可考虑使用;另外磷酸二酯酶-5抑制剂(如西地那非)对于降低肺动脉压力也有帮助,可选用;其他治疗还包括限制液体量(甚至利尿剂使用)以利于肺水肿消退、碱化血液以利于动脉导管关闭,使用血管活性药物适当提高体循环压力相对降低肺循环压力以利于改善氧合以及PS的重复使用等 [3]。另外,ARDS患儿往往还合并有其他脏器功能受损,治疗上还应考虑对这些脏器加以保护。
总之,新生儿ARDS病情危重,病死率高,目前尚缺乏统一的诊断标准,对其治疗,应是在给予相应呼吸支持治疗基础上的综合治疗。
参考文献
[1]Villar J, Blanco J, A ón JM, et al. ALIEN Network: The ALIEN study: incidence and outcome of acute respiratory distress syndrome in the era of lung protective ventilation [J]. Intensive Care Med, 2011, 37(12):1932-1941.
[2] Dushianthan A, Cusack R, Goss V, et al. Clinical review: Exogenous surfactant therapy for acute lung injury/acute respiratory distress syndrome--where do we go from here? [J] Crit Care, 2012, 16(6):238.
[3] 常立文,李文斌 . 新生兒急性肺损伤/急性呼吸窘迫综合征[J]. 实用儿科临床杂志,2007,22 (2) : 84-86.
[4] The ARDS Definition Task Force. Acute respiratory distress syndrome,the Berlin definition [J].JAMA, 2012, 307(23) : E1-E8.
[5] 张劲松. ARDS临床诊治的又一里程碑:ARDS柏林标准问世[J]. 中华急诊医学杂志, 2012, 21(9):937-938.
[6] Santschi M,Jouvet P,Leclerc F,et al. Acute lung injury in children: Therapeutic practice and feasibility of international clinical trials [J].Pediatr Crit Care Med, 2010, 11(6) : 681-689.
[7] Thomas NJ, Shaffer ML, Willson DF, et al. Defining acute lung disease in children with the oxygenation saturation index [J]. Pediatr Cri Care Med, 2010, 11(1) : 12-17.
[8] Demiraka S, Dtsch J, Knothe C, et al. Inhaled nitric oxide in neonatal and pediatric acute respiratory distress syndrome: dose response, prolonged inhalation, and weaning [J]. Crit Care Med, 1996, 24(11):1913-1919.
[9] Cheifetz IM. Management of acute lung injury: sharing data between adults and children [J]. Respir Care, 2011,56(9):1258-1268.
[10]De Luca D, Piastra M, Chidini G, et al; Respiratory Section of the European Society for Pediatric Neonatal Intensive Care (ESPNIC). The use of the Berlin definition for acute respiratory distress syndrome during infancy and early childhood: multicenter evaluation and expert consensus [J]. Intensive Care Med, 2013, 39(12):2083-2091.
[11] Resnick S, Sokol J. Impact of introducing binasal continuous positive airway pressure for acute respiratory distress in newborns during retrieval: Experience from Western Australia [J]. J Paediatr Child Health, 2010, 46(12):754-759.
[12] Cheifetz IM. Management of acute lung injury: sharing data between adults and children [J]. Respir Care, 2011, 56(9):1258-1272.
[13] Polin RA, Carlo WA; Committee on Fetus and Newborn; American Academy of Pediatrics.Surfactant replacement therapy for preterm and term neonates with respiratory distress [J]. Pediatrics, 2014, 133(1):156-163.
[14] Speer CP. Neonatal respiratory distress syndrome: an inflammatory disease? [J]. Neonatology, 2011, 99(4):316-319.
[15] Swarnam K, Soraisham AS, Sivanandan S. Advances in the management of meconium aspiration syndrome [J]. Int J Pediatr, 2012, 2012:359571.
[16] Lai P, Mita C, Thompson B. What is the clinical significance of pulmonary hypertension in acute respiratory distress syndrome? A review[J]. Minerva Anestesiol,2014,80(5):574-585.
[17] Sürmeli-Onay O, Korkmaz A, Yigit S, et al. Surfactant therapy in late preterm infants: respiratory distress syndrome and beyond[J]. Turk J Pediatr, 2012, 54(3):239-246.
(收稿日期:2014-08-11)
(本文編辑:郑辛甜)
P258-262
