急性肺损伤小鼠脾脏树突状细胞动态变化研究
2015-10-21刘军张朋书徐静媛杨毅邱海波
刘军 张朋书 徐静媛 杨毅 邱海波


DOI:10.3760/cma.j.issn.1671-0282.2015.03.003
基金項目:国家自然科学基金(81070049,81170057);江苏省“科教兴卫工程”医学重点学科项目 (889-KJXW11.3);卫生公益性行业科研专项经费项目 (201202011);国家临床重点专科建设项目(2100299);中国博士后科学基金资助项目(2013M542578);江苏省博士后科研资助项目(1301005A);江苏省高校科研创新计划 (CX09B-066Z);江苏省自然科学基金(BK20141175);江苏省卫生厅科技项目(Z201414);苏州市科技计划项目 (SYS201251);南京医科大学哲学社会科学发展专项(2013NJZS50)
作者单位:215001 苏州,南京医科大学附属苏州市立医院东区重症医学科 (刘军);东南大学附属中大医院重症医学科 (张朋书、徐静媛、杨毅、邱海波)
通信作者:邱海波,Email:haiboq2000@gmail.com
【摘要】目的 研究脂多糖 (LPS) 诱导急性肺损伤 (ALI) 小鼠脾脏树突状细胞 (DC) 数量改变和成熟状态,探讨ALI小鼠脾DC变化规律。方法 C57BL/6小鼠36只,随机(随机数字法)分为2组。①对照组 (Con):小鼠气管内注射PBS 30 μL;②ALI组 (ALI):气管内注射脂多糖 (LPS) 2 mg/kg复制ALI模型。后又按注射LPS或PBS 后6、12、24 h 三个时间点各分成三组,每组6只小鼠。光镜观察肺组织病理改变,测定肺损伤评分,计算肺湿质量/体质量比 (LW/BW),酶联免疫吸附法 (ELISA) 检测肺组织匀浆中白细胞介素-6 (IL-6) 的含量,以反映肺组织炎症损伤程度。流式细胞仪 (FCM) 检测脾单细胞悬液中DC比例及表达CD80、MHC Ⅱ水平。结果 ALI组小鼠6、12、24 h时点的肺LW/BW均明显高于对照组 (P<0.05)。病理检测示ALI组小鼠肺泡间隔增宽、充血、出血及大量炎性细胞浸润等急性肺损伤病理改变。ALI组肺损伤评分及肺组织IL-6水平均显著高于对照组 (P<0.05)。FCM检测显示,与对照组相比,ALI组小鼠脾脏DC呈一过性升高,ALI组12 h时点脾脏DC升高至 (1.92±0.25)%,显著高于对照组(P<0.01),24 h时点降至基线水平 (0.96±0.21)%。与对照组相比,ALI组脾脏DC表达CD80显著增加 (P<0.01);与ALI组6 h相比,ALI组12 h和24 h脾脏DC表达CD80显著升高 (P<0.05)。ALI组与对照组及ALI组各时间点脾脏DC表达MHC Ⅱ的差异无统计学意义 (P>0.05)。 结论 ALI早期脾脏DC存在一过性升高,伴功能呈成熟状态,脾脏DC可能参与ALI炎症损伤的发生发展。
【关键词】急性肺损伤;急性呼吸窘迫综合征;树突状细胞;脾脏;炎症
Dynamic alteration of spleen dendritic cells in acute lung injury mice
Liu Jun, Zhang Pengshu, Xu Jingyuan, Yang Yi, Qiu Haibo.
Department of Critical Care Medicine, Suzhou Hospital, Nanjing Medical University, Suzhou 215001, China
Corresponding author: Qiu Haibo, Email: haiboq2000@gmail.com
【Abstract】Objective To investigate the kinetics and phenotype of spleen dendritic cells (DC) in lipopolysaccharide (LPS) -induced acute lung injury (ALI) mice. Methods Thirty-six C57BL/6 mice were randomly(random number) divided into two groups: control group and ALI group. Spleens were harvested at the following intervals of 6, 12, and 24 h after LPS or PBS administration. Lung wet weight /body weight ratio (LW/BW) was recorded to assess lung injury. Meanwhile, pathological changes were examined under optical microscope. The IL-6 level in the lung was measured by using ELISA (enzyme-linked immuno sorbent assay). The DC in the spleen was measured by flow cytometry (FCM). Results (1) LPS-ALI resulted in a significant increase in LW/BW ratio. (2) Histologically, extensive alveolar wall thickening resulted from edema, severe hemorrhage in the interstitium and alveolus, and marked and diffuse interstitial infiltration with inflammatory cells were observed in the ALI group. (3) Meanwhile, the levels of IL-6 in lung tissue were significantly increased in the LPS-induced ALI mice. (4) LPS-induced ALI led to divergent kinetics of spleen DC in ALI mice. In ALI mice, spleen DC only showed a transient increase at 12 h. (5) All DC within spleens had a modest maturation in ALI mice. Conclusions LPS-induced ALI provokes a transient increase as well as modest maturation of spleen DC.
【Key words】Acute lung injury; Acuet respiratory distress syndrome; Dendritic cells; Spleen; Inflammation
急性肺损伤 (acute lung injury, ALI) 及其严重形式急性呼吸窘迫综合征 (acute respiratory distress syndrome, ARDS) 是严重感染、创伤、休克等导致的急性难治性呼吸衰竭。全身性感染(sepsis)是ALI最常见的原因,占ALI病因50%以上[1]。近年来,尽管呼吸支持治疗取得长足进步,但是ALI病死率依然高达40%[2]。目前认为失控的肺部炎症反应是ALI发生发展的根本机制[3]。树突状细胞 (dendritic cell, DC) 是机体功能最为强大的抗原提呈细胞,具有独特的激发初次免疫应答的能力[4]。研究显示,肺常规DC在介导ALI肺炎症反应中发挥重要的作用[5]。DC在组织中接受抗原刺激后迁移至局部免疫器官如脾脏、淋巴结的T细胞区,启动免疫应答[6]。脾脏作为机体最大的外周免疫器官,有大量研究证实脾脏DC参与全身性感染的炎症激活和后期的免疫抑制[7-11]。然而,对于ALI时脾脏DC变化尚不清楚。本实验通过复制LPS-ALI小鼠模型,應用流式细胞术观察脾脏DC数量和功能状态,探讨ALI小鼠早期脾脏DC变化规律,为深入了解ALI的炎症反应机制奠定基础。
1 材料与方法
1.1 实验动物、试剂及实验分组
1.1.1 实验动物 SPF级C57BL/6小鼠36只,雄性,6~8周龄,体质量18~22 g,由南京军区总医院实验动物中心提供。常规食水喂养并维持正常昼夜节律,稳定72 h后开始实验。本研究动物实验方案符合美国实验动物管理与使用指南的要求。
1.1.2 主要试剂和仪器 LPS和胶原酶V购自Sigma-Aldrich公司。小鼠CD11c、CD11b、MHC Ⅱ、CD80及同型对照单克隆抗体购自eBioscience公司。小鼠IL-6 ELISA kit由上海依科赛生物有限公司提供。流式细胞仪为美国BD公司产品(BD FACSCaliburTM)。
1.1.3 实验分组 C57BL/6小鼠称质量后,将36只C57BL/6小鼠随机(随机数字法)分为2组。① 对照组 (Con):气管内滴入与LPS等体积的PBS;(2) ALI组 (ALI):气管内滴入LPS 2 mg/kg复制LPS-ALI模型。后又按注射LPS或PBS 6、12、24 h三个时间点各分成3组,每组6只小鼠,至观察6、12、24 h后处死小鼠,留取脾待检。
1.2 ALI模型制备
小鼠称质量,戊巴比妥钠 (50 mg/kg) 腹腔注射麻醉,仰卧固定于实验台,颈部皮肤消毒,切开皮肤,逐层分离皮下组织,暴露气管。气管内注入LPS 2 mg/kg (溶于30 μL PBS中,对照组注入等体积的PBS),缝合切口。手术完毕后迅速将动物直立、旋转,使液体在肺内分布均匀。动物清醒后常规饲养。小鼠LPS-ALI模型建立成功标准:肺间质充血、水肿,肺泡间隔明显増宽,肺间质和肺泡腔内有大量炎细胞浸润、出血,大量肺泡萎陷[12]。
1.3 脾单细胞悬液制备
小鼠处死,无菌打开腹腔,应用机械法并裂解红细胞将脾脏制成单细胞悬液[13]。
1.4 检测指标及方法
1.4.1 肺湿质量/体质量 (LW/BW) 测定 处死小鼠后,留取肺组织。用吸水纸将肺组织表面水分吸尽并清除血渍后,称质量并计算肺组织LW/BW。
1.4.2 肺组织HE染色及肺损伤评分 肺组织固定、石蜡包埋、HE染色,光镜下观察肺组织损伤程度,采用Smith法进行肺损伤半定量评分[14]。
1.4.3 ELISA检测肺组织IL-6质量浓度 取右下肺组织制备肺组织匀浆,ELISA检测IL-6质量浓度严格按试剂盒说明书进行操作。
1.4.4 流式细胞仪检测脾DC数量及功能状态 脾单细胞悬液在显微镜下行细胞计数,调整细胞数为1×106/mL,分别加入单克隆抗体FITC-CD11c,Percp-Cy5.5-CD11b,PE-MHC Ⅱ及APC-CD80,室温下避光孵育30 min,PBS洗涤后以1%多聚甲醛固定,4 ℃避光保存,24 h内上机检测。各样本均设相应的同型对照管作为阴性对照。样本应用流式细胞仪FACSCaliburTM(BD公司) 检测,用Cellquest软件(美国BD公司)分析数据。
参照文献[15-16]以CD11c+CD11b+细胞占脾单细胞数量百分比反映脾DC数量。分析表面表达CD80、MHC Ⅱ的DC比例,反映DC功能状态和成熟程度。
1.5 统计学方法
采用SPSS 16.0软件进行统计分析。计量资料以均数±标准差(x±s)表示。两组间比较采用成组t检验,多组间比较采用单因素方差(LSD-t法)分析,方差不齐时采用Mann-Whitney U及Dunnetts T3检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 ALI小鼠肺炎症损伤变化
肺LW/BW反映肺炎症损伤程度[17]。ALI组小鼠6、12、24 h LW/BW均明显高于对照组相应时间点LW/BW (P<0.05),但ALI组各时间点差异无统计学意义 (P>0.05),见表1。病理学检查显示对照组小鼠肺泡间隔均一,肺泡腔内未见明显渗出液及炎性细胞浸润;ALI组小鼠肺组织病理检查见肺泡间隔明显增宽、出血并有大量炎性细胞浸润,见图1。Smith肺损伤评分可半定量评估ALI肺炎症损伤程度[14]。ALI组6、12、24 h肺组织病理损伤评分均明显高于对照组相应时间点的肺损伤评分 (P<0.05),但ALI组各时间点差异无统计学意义 (P>0.05),见表1。ALI组6、12、24 h肺组织IL-6含量均明显高于对照组相应时间点肺组织IL-6水平 (P<0.01);与ALI组6 h和24 h相比,ALI组12 h肺IL-6水平显著升高 (P<0.01)。见表2。
2.2 ALI小鼠脾DC数量动态改变
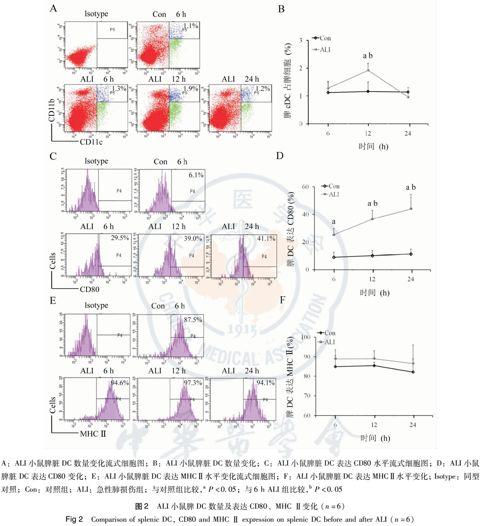
对照组小鼠6、12、24 h脾DC分别为(1.12±0.37)%、(1.16±0.34)%和(1.14±0.15)%。ALI小鼠6 h脾DC为(1.28±0.25)%,與对照组差异无统计学意义 (P>0.05);ALI 组12 h脾脏DC显著升高至 (1.92±0.25)%,明显高于对照组 (P<0.01);ALI小鼠24 h脾DC降至 (0.96±0.21)%,与对照组差异无统计学意义 (P>0.05)。与ALI组6 h和24 h相比,ALI组12 h脾DC数量显著升高 (P<0.01)。见表3和图2A、B。
2.3 ALI小鼠脾脏DC表达CD80水平
对照组6、12、24 h 脾DC表达CD80分别为(9.0±3.6)%、(10.1±3.6)%和(11.3±3.5)%。ALI组相应时间点脾DC表达CD80分别为 (25.2±4.7)%、(36.6±6.2)%和(43.9±10.5)%,明显高于对照组 (P<0.01)。与ALI组6 h相比,ALI组12 h和24 h脾脏DC表达CD80显著升高 (P<0.05);但ALI组12 h和24 h脾脏DC表达CD80水平差异无统计学意义 (P>0.05)。见表4和图2C、2D。
2.4 ALI小鼠脾脏DC表达MHC Ⅱ变化
对照组6 h、12 h和24 h脾DC表达MHC Ⅱ分别为 (84.9±8.6)%、(85.4±1.8)%和(82.2±6.6)%;ALI组小鼠相应时间点脾DC表达MHC Ⅱ 分别为 (88.9±1.5)%、(89.0±4.0)%和(86.5±9.5)%,与对照组差异无统计学意义 (P>0.05);ALI组各时间点脾DC表达MHC Ⅱ水平亦差异无统计学意义 (P>0.05)。见表4和图2E、F。
3 讨论
ALI是感染、创伤和休克等导致的急性难治性呼吸衰竭,病死率高[1]。目前认为失控的炎症反应是其发生的根本原因[3]。DC是功能最强大的专职抗原提呈细胞,广泛分布于机体各组织,在启动和调节免疫应答反应中发挥关键性作用[4]。小鼠DC通过诱导T、B、NK等调控免疫应答,并通过释放细胞因子调节免疫反应的强度和时程[18]。近
期研究证实,肺DC在介导ALI肺炎症反应中发挥重要的作用[5]。而脾脏作为机体最大的外周免疫器官,是发挥免疫应答效应的重要场所,其细胞组成、免疫调理因子的变化对机体整体免疫状态起重要的调节作用[16]。研究ALI脾DC状态有助于阐明ALI致病机制。
本研究利用气管内注射LPS (2 mg/kg) 复制小鼠ALI模型,模拟肺部感染导致ALI的临床过程。结果显示,LPS注射后,小鼠肺组织LW/BW显著升高,肺组织病理可见肺泡间隔增宽和肺泡间质内血管充血、出血及大量炎细胞渗出等ALI病理变化,Smith评分也显示小鼠肺损伤评分显著高于对照组,肺组织IL-6显著升高,证实小鼠ALI模型复制成功。
本实验应用流式细胞仪检测脾单细胞悬液,结果发现从正常小鼠的脾脏分离出来的DC占1%左右,与既往研究结果基本一致[16]。本研究结果显示,ALI小鼠脾脏DC呈一过性升高,12 h达高峰,24 h恢复基线水平。有研究显示,小鼠静脉注射LPS后,淋巴结中DC的数量在6 h内明显升高,12~24 h达高峰,峰值较正常升高8~15倍,随后DC大量凋亡而降至低于正常水平[19]。另有实验利用全身性感染小鼠模型,发现脾脏DC数量明显增加,36 h达高峰,然而48 h脾脏DC数量明显减少,推测是免疫系统自身“负反馈”[20]。本实验结果提示ALI小鼠脾脏DC与全身性感染小鼠变化趋势基本一致,在12~36 h呈现峰值,随后降至正常或更低水平。略有不同的是,本研究观察到ALI 小鼠脾脏DC在12 h达峰值,似略早于全身性感染小鼠 (12~36 h),原因尚不清楚,可能与不同模型选择、免疫反应方式不全相同等因素有关。
DC成熟状态也决定机体发生免疫反应的类型和程度。未成熟DC诱导免疫激活的能力很弱,成熟的DC具有诱导免疫激活T细胞的功能,改变DC的表型和功能将影响机体的免疫应答反应。笔者通过检测DC表达CD80水平反映DC功能状态和成熟程度,检测DC表达MHC Ⅱ反映DCs抗原提呈功能和成熟状态[21]。
本研究发现尽管ALI小鼠脾脏DC数量仅一过性升高,但在各观察时间点脾脏表达CD80的DC均明显升高,且随观察时间延长进一步升高,表明成熟的DC增多,且呈时间依赖性,与全身性感染小鼠早期脾脏DC功能变化基本一致,该变化也与ALI早期机体炎症反应亢进过程相吻合[10-11]。然而,ALI时表达MHC Ⅱ的脾脏DC差异无统计学意义,均近90%左右,表示在静息状态和炎症状态下脾脏DC均有较强的抗原提呈能力,ALI小鼠脾脏DC表达MHC Ⅱ差异无统计学意义,不排除可能与DC高表达MHC Ⅱ有关。
总之,本研究发现ALI小鼠脾脏DC呈一过性增加,伴功能呈成熟状态。脾脏DC可能参与ALI发生发展,而以脾脏DC为靶点调控ALI病程可能具有新的防治前景。
参考文献
[1]Matthay MA, Ware LB, Zimmerman GA. The acute respiratory distress syndrome [J]. J Clin Invest, 2012,122(8):2731-2740.
[2]Ferguson ND, Cook DJ, Guyatt GH, et al. High-frequency oscillation in early acute respiratory distress syndrome [J]. N Engl J Med, 2013,368(9):795-805.
[3]邱海波, 黄英姿. 急性呼吸窘迫综合征治疗的进步[J]. 中华急诊医学杂志, 2011,20(2):117-119.
[4]Steinman RM. Decisions about dendritic cells: past, present, and future[J]. Annu Rev Immunol, 2012, 30:1-22.
[5] 董亮, 贺宏丽, 刘军, 等. 急性肺损伤早期肺常规树突状细胞的动态变化[J]. 中华急诊医学杂志, 2012,21(6):607-611.
[6]Randolph GJ, Ochando J, Partida-Sanchez S. Migration of dendritic cell subsets and their precursors[J]. Annu Rev Immunol, 2008,26:293-316.
[7]Efron P, Moldawer LL. Sepsis and the dendritic cell[J]. Shock, 2003,20(5):386-401.
[8]Ding Y, Chung CS, Newton S, et al. Polymicrobial sepsis induces divergent effects on splenic and peritoneal dendritic cell function in mice[J]. Shock, 2004,22(2):137-144.
[9]Grimaldi D, Louis S, Pene F, et al. Profound and persistent decrease of circulating dendritic cells is associated with ICU-acquired infection in patients with septic shock[J]. Intensive Care Med, 2011,37(9):1438-1446.
[10]刘军, 邱海波. 树突状细胞介导的免疫功能紊乱在全身性感染中的作用[J]. 中华急诊医学杂志, 2010,19(9):1004-1006.
[11]张朋书, 刘军, 邱海波. 脾脏树突状细胞在全身性感染中的变化及治疗意义[J]. 国际麻醉学与复苏杂志, 2011,32(2):244-246.
[12]Matute-Bello G, Frevert CW, Martin TR. Animal models of acute lung injury[J]. Am J Physiol Lung Cell Mol Physiol, 2008,295(3):L379-399.
[13]Gautier EL, Huby T, Saint-Charles F, et al. Enhanced dendritic cell survival attenuates lipopolysaccharide-induced immuno-suppression and increases resistance to lethal endotoxic shock[J]. J Immunol, 2008,180(10):6941-6946.
[14]Liu J, Zhang PS, Yu Q, et al. Losartan inhibits conventional dendritic cell maturation and Th1 and Th17 polarization responses: Novel mechanisms of preventive effects on lipopolysaccharide-induced acute lung injury [J]. Int J Mol Med, 2012,29(2):269-276.
[15]van RLS, Prins JB, Leenen PJ, et al. Allergen-induced accumulation of airway dendritic cells is supported by an increase in CD31hiLy-6Cneg bone marrow precursors in a mouse model of asthma[J]. Blood, 2002,100(10):3663-3671.
[16]Naik SH, Metcalf D, van NA, et al. Intrasplenic steady-state dendritic cell precursors that are distinct from monocytes[J]. Nat Immunol, 2006,7(6):663-671.
[17]Hashimoto N, Kawabe T, Imaizumi K, et al. CD40 plays a crucial role in lipopolysaccharide-induced acute lung injury[J]. Am J Respir Cell Mol Biol, 2004,30(6):808-815.
[18]Naik SH, Sathe P, Park HY, et al. Development of plasmacytoid and conventional dendritic cell subtypes from single precursor cells derived in vitro and in vivo[J]. Nat Immunol, 2007,8(11):1217-1226.
[19]MacPherson GG, Jenkins CD, Stein MJ, et al. Endotoxin-mediated dendritic cell release from the intestine. Characterization of released dendritic cells and TNF dependence[J]. J Immunol, 1995,154(3):1317-1322.
[20]De Smedt T, Pajak B, Muraille E, et al. Regulation of dendritic cell numbers and maturation by lipopolysaccharide in vivo[J]. J Exp Med, 1996,184(4):1413-1424.
[21]Iwasaki A. Mucosal dendritic cells[J]. Annu Rev Immunol, 2007,25:381-418.
(收稿日期:2014-08-04)
(本文編辑:郑辛甜)
P241-246
