混合碱溶液滴定实验中指示剂的改进
2015-10-21崔敏吕仁庆李汝奕刘春英曹作刚
崔敏 吕仁庆 李汝奕 刘春英 曹作刚

摘 要:大一无机及分析化学实验中的混合碱溶液滴定实验常采用双指示剂法,由于终点变化不敏锐,导致有较大的误差。采用混合指示剂来指示滴定终点,测定结果与标准溶液真值进行比较,判断测定方法准确度高低。实验证明,多组混合指示剂颜色变化明显,滴定终点容易判断,滴定结果准确,优于常规的双指示剂法。
关 键 词:混合碱;滴定;指示剂;改进
中图分类号:O 655.21 文献标识码: A 文章编号: 1671-0460(2015)07-1618-03
Improvement of Indicator for Determination of Mixed Base
CUI Min, LV Ren-qin, LI Ru-yi, LIU Chun-ying, CAO Zuo-gang
(College of Science, China University of Petroleum (East China), Shandong Qingdao 266580, China)
Abstract: The common analysis method of mixed alkali in experiment of inorganic and analytical chemistry is the double indicator method. Because the change of the first measurement point and the second measurement point is not sensitive, the determination result has large error. In this paper, mixed indicator was used to indicate the endpoint. The result shows that end point of mixed indicator titration is easy to judge; the determination result is accurate, better than that of the double-indicator method.
Key words: Mixed alkali; Titration; Indicators; Modification
化学是一门实验性自然科学,在培养具有创新意识和创新能力的素质教育中,实验更占有相当重要的地位。无机及分析化学实验是高校应用化学、材料化学和化学专业学生必修的第一门基础实验课。其中混合堿溶液的滴定是一个具有代表性的定量分析实验。目前在这个实验中主要采用的是双指示剂法[1,2]。所谓双指示剂就是分别以酚酞和甲基橙为指示剂,在同一份溶液中用盐酸标准溶液作滴定剂进行连续滴定,根据两个终点所消耗的盐酸标准溶液的体积,计算混合碱中各组分的含量[3]。该方法步骤简单快捷,测定结果较为准确[4],是一般高校和科研机构经常采用的方法。但是该方法存在一定缺陷,例如以酚酞作指示剂确定第一计量点时,从红色滴定到无色,较难判断终点;以甲基橙作指示剂指示滴定的第二计量点时,由黄色滴定到橙色为终点,不敏锐[5,6]。对于大一的学生来说,由于他们的实验技能还不够成熟,在对化学计量点的判断上不够准确,常使滴定结果存在较大误差,因此,需要对该实验的指示剂进行改进,选用混合指示剂法。在实验室现有指示剂的条件下,本着颜色变化明显、符合溶液等量点的pH变化范围、提高灵敏度的原则,配制了多组混合指示剂,反复实验确定了一组较好的配比,并做了判断终点的准确性实验及混合碱回收实验,得到了较满意的结果。
1 实验原理
混合碱是Na2CO3与NaOH或Na2CO3与NaHCO3的混合物。用HCl标准溶液进行滴定。第一计量点时,产物为NaHCO3,pH=8.31。反应方程式如下:
NaOH + HCl →NaCl + H2O
Na2CO3+ HCl→ NaHCO3+ NaCl
设滴定体积V1,继续用HCl标准溶液滴定到第二计量点时,NaHCO3被中和成H2CO3,pH=3.88 反应方程式如下:
NaHCO3+ HCl→ NaCl + H2O + CO2
设此时消耗HCl标准溶液的体积为V2,根据V1和V2可以判断出混合碱的组成。
当V1>V2时,溶液为Na2CO3与NaOH 的混合物。
当V1 双指示剂法中通常采用酚酞作为第一计量点的指示剂,颜色由紫红色渐变至粉红色,浅粉红色,无色。以浅粉色为终点。但浅粉色的深浅难以掌握,从而使滴定终点产生较大的误差。因此根据色彩的调配原理,选择4种指示剂按一定体积比混合,使混合指示剂在第一计量点时呈绿色,易于终点的判断。 2 实验方法 2.1 仪器与试剂 试剂:盐酸、无水碳酸钠、氢氧化钠、碳酸氢钠、酚酞、甲基橙、百里酚蓝、溴百里酚蓝、无水乙醇。 仪器:酸式滴定管、碱式滴定管、电子天平、pH计、吸耳球、量筒、锥形瓶若干。 2.2 酸碱指示剂的配制及混合指示剂的配制 95%的乙醇溶液配制浓度为1%的酚酞 50%的乙醇溶液配制浓度为0.04%的百里酚蓝 20%的乙醇溶液配制浓度为0.02%的甲基橙 95%的乙醇溶液配制浓度为0.07%的溴百里酚蓝 以上指示剂按体积比例混合:酚酞:百里酚蓝:甲基橙:溴百里酚蓝=1.5∶1∶10∶5 3 结果与讨论
3.1 指示剂指示终点准确性实验
取已知浓度的Na2CO3溶液10.00mL(浓度为0.115 1 mol/L),加入三滴混合指示剂,溶液呈紫红色,用已知浓度的标准HCl溶液(浓度为0.108 1 mol/L)滴定至浅绿色时达到第一计量点,记录下消耗的HCl体积V1,然后补加两滴甲基橙,继续滴定至颜色由黄色变为橙色,记录消耗的HCl体积V2。理论上V1=V2,实际测定的数据见表1。
采用相同滴定过程,用双指示剂法作对比实验,测定数据见表1。
表1 指示剂指示终点的准确性实验
Table 1 Accuracy of indicator
盐酸体积
V1 /mL 盐酸体积
V2 /mL V1/V2 V1/V2
平均值 相对
误差 标准
偏差
双
指
示
剂
法 10.35 10.68 0.969 1 1.005 2 -0.52% 0.028 4
10.80 10.68 1.011 2
10.39 10.56 0.983 9
10.62 10.38 1.023 1
10.80 10.40 1.038 5
混
合
指
示
剂
法 10.65 10.62 1.002 8 1.002 3 -0.23% 0.005 4
10.65 10.65 1.000 0
10.65 10.65 1.000 0
10.62 10.65 0.997 2
10.72 10.60 1.011 3
3.2 碳酸钠和碳酸氢钠不同比例混合的回收实验
配制Na2CO3与NaHCO3混合溶液,体积比分别是1∶1,3∶2,分别用两种方法进行标定,滴定过程同3.1,对比其准确性。测定数据见表2,表3。
表2 Na2CO3:NaHCO3=1∶1(体积比)混合液的回收实验Table 2 Recovery of Na2CO3 and NaHCO3 mixture liquid
(the ratio of the volume is Na2CO3:NaHCO3=1:1)
Na2CO3浓度/(mol·L-1) NaHCO3浓度/(mol·L-1) Na2CO3与NaHCO3浓度平均值/(mol·L-1)
雙
指
示
剂
法 实际值 0.115 1 0.099 8 0.214 9
测量值 0.119 2 0.083 8 0.203 0
0.121 7 0.076 8 0.198 5
0.126 6 0.070 0 0.196 6
0.123 4 0.075 5 0.198 9
0.121 9 0.078 5 0.200 4
平均值 0.122 6 0.076 9 0.199 5
标准偏差 0.002 7 0.005 0 0.002 4
回收率 106.48% 77.07% 92.82%
混
合
指
示
剂
法 实际值 0.115 1 0.099 8 0.214 9
测量值 0.111 3 0.100 7 0.212 0
0.110 7 0.100 0 0.210 7
0.110 9 0.098 5 0.209 4
0.109 2 0.101 7 0.210 9
0.110 7 0.100 4 0.211 1
平均值 0.110 6 0.100 3 0.210 8
标准偏差 0.000 8 0.001 2 0.000 9
回收率 96.06% 100.46% 98.10%
表3 Na2CO3:NaHCO3=3∶2(体积比)混合液的回收实验Table 3 Recovery of Na2CO3 and NaHCO3 mixture liquid
(the ratio of the volume is Na2CO3:NaHCO3=3:2)
Na2CO3浓度/(mol·L-1) NaHCO3浓度/(mol·L-1) Na2CO3与NaHCO3
浓度平均值/(mol·L-1)
双
指
示
剂
法 实际值 0.115 1 0.099 8 0.214 9
测量值 0.117 0 0.085 1 0.202 1
0.120 6 0.073 2 0.193 8
0.117 6 0.082 2 0.199 8
0.115 4 0.085 4 0.200 8
0.121 1 0.071 6 0.192 7
平均值 0.118 3 0.079 5 0.197 8
标准偏差 0.002 4 0.006 6 0.004 3
回收率 102.81% 79.66% 92.06%
混
合
指
示
剂
法 实际值 0.115 1 0.099 8 0.214 9
测量值 0.114 4 0.100 0 0.214 4
0.113 7 0.100 8 0.214 5
0.113 3 0.100 0 0.213 3
0.112 6 0.100 3 0.212 9
0.115 6 0.097 6 0.213 2
平均值 0.113 9 0.099 7 0.213 7
标准偏差 0.001 1 0.001 2 0.000 7
回收率 98.97% 99.94% 99.42%
3.3 碳酸钠和氢氧化钠不同比例混合的回收实验
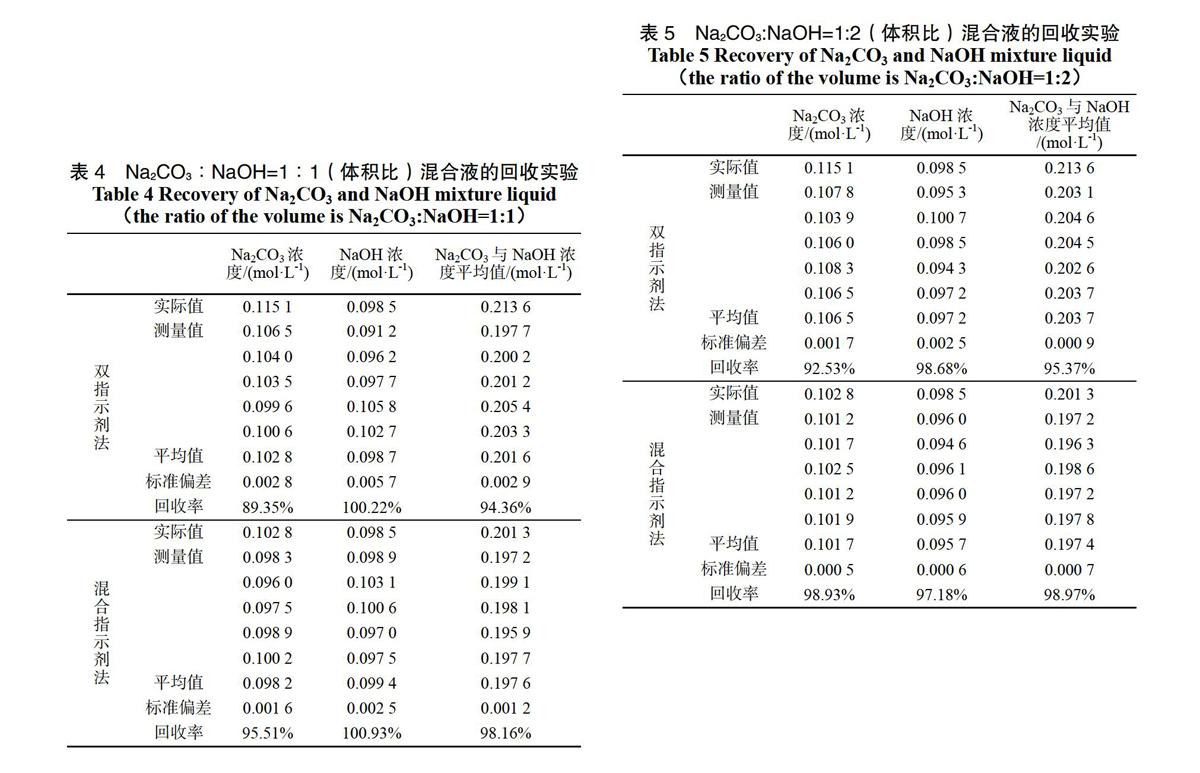
配制Na2CO3与NaOH混合溶液,體积比分别是1∶1,1∶2,分别用两种方法进行标定,滴定过程同3.1,对比其准确性。测定数据见表4,表5。
3.4 实验过程中的注意事项
(1)实验中盐酸的标定要注意终点时生成的是H2CO3饱和溶液,pH为3.89,为了防止终点提前,必须尽可能驱除CO2,接近终点时要剧烈振荡溶液,或者加热;本实验采用的是加热溶液。
(2)碱测定在第一终点时生成NaHCO3应尽可能保证CO2不丢失,滴定速度一定不能过快,否则会造成HCl局部过浓,引起CO2的丢失,摇动应该缓慢不要剧烈振动。
(3)在确定混合指示剂的配比时,为了保证溶液在颜色突变时的pH值在第一、二计量点附近,需使用pH酸度计进行测定。
(4)在称重样品时,为避免纯碱样品的吸湿,应迅速盖好称量瓶盖,快速完成称量操作,以得到准确的重量。
表4 Na2CO3∶NaOH=1∶1(体积比)混合液的回收实验
Table 4 Recovery of Na2CO3 and NaOH mixture liquid
(the ratio of the volume is Na2CO3:NaOH=1:1)
Na2CO3浓
度/(mol·L-1) NaOH浓
度/(mol·L-1) Na2CO3与NaOH浓
度平均值/(mol·L-1)
双
指
示
剂
法 实际值 0.115 1 0.098 5 0.213 6
测量值 0.106 5 0.091 2 0.197 7
0.104 0 0.096 2 0.200 2
0.103 5 0.097 7 0.201 2
0.099 6 0.105 8 0.205 4
0.100 6 0.102 7 0.203 3
平均值 0.102 8 0.098 7 0.201 6
标准偏差 0.002 8 0.005 7 0.002 9
回收率 89.35% 100.22% 94.36%
混
合
指
示
剂
法 实际值 0.102 8 0.098 5 0.201 3
测量值 0.098 3 0.098 9 0.197 2
0.096 0 0.103 1 0.199 1
0.097 5 0.100 6 0.198 1
0.098 9 0.097 0 0.195 9
0.100 2 0.097 5 0.197 7
平均值 0.098 2 0.099 4 0.197 6
标准偏差 0.001 6 0.002 5 0.001 2
回收率 95.51% 100.93% 98.16%
4 结 论
从表1可以看出,通过对指示剂的改进,可以使双指示剂法测定结果的相对误差由原来的-0.52%减至-0.23%,标准偏差也由0.028 4减为0.005 4,测定的精密度有较大提高。因此混合指示剂法相对于双指示剂法在指示终点的准确性方面更为准确。从表2,表3,表4和表5可以看出,对于不同体积比例和不同种类的混合碱来说,其回收率都有一定提高,都能达到98%以上。说明混合指示剂法在混合碱回收率方面明显优于双指示剂法。由此可看出,混合指示剂法无论是从准确性还是操作性方面来说,都比现在使用的双指示剂法效果好,对于大一学生的无机及分析实验而言,是一种可行的值得推广的标定新方法。
表5 Na2CO3:NaOH=1:2(体积比)混合液的回收实验
Table 5 Recovery of Na2CO3 and NaOH mixture liquid
(the ratio of the volume is Na2CO3:NaOH=1:2)
Na2CO3浓
度/(mol·L-1) NaOH浓
度/(mol·L-1) Na2CO3与NaOH浓度平均值
/(mol·L-1)
双
指
示
剂
法 实际值 0.115 1 0.098 5 0.213 6
测量值 0.107 8 0.095 3 0.203 1
0.103 9 0.100 7 0.204 6
0.106 0 0.098 5 0.204 5
0.108 3 0.094 3 0.202 6
0.106 5 0.097 2 0.203 7
平均值 0.106 5 0.097 2 0.203 7
标准偏差 0.001 7 0.002 5 0.000 9
回收率 92.53% 98.68% 95.37%
混
合
指
示
剂
法 实际值 0.102 8 0.098 5 0.201 3
测量值 0.101 2 0.096 0 0.197 2
0.101 7 0.094 6 0.196 3
0.102 5 0.096 1 0.198 6
0.101 2 0.096 0 0.197 2
0.101 9 0.095 9 0.197 8
平均值 0.101 7 0.095 7 0.197 4
标准偏差 0.000 5 0.000 6 0.000 7
回收率 98.93% 97.18% 98.97%
参考文献:
[1]刘晓辉,于文清.混合碱滴定实验[J].承德民族师专学报, 2009,29:5-8.
[2]李楚芝.分析化学实验[M].北京:化学工艺出版社,1995:78.
[3]杜金.双指示剂法测定混合碱样的含量[J].辽宁化工,2010,39(8):888-890.
[4]D.L.Perry,S.L.Phillips. Handbook of Inorganic Compounds [M]. Beijing: World Pu-blishing Corporation,1998:342.
[5]张建丽,魏媛,曹毅.甲基橙合成实验的改进[J].化学与黏合学报,2009,31:13-15.
[6]J.A.Dean. Analytical Chemistry Handbook[M]. Beijing: World Publishing Corporati-on,1998:45.
