实时荧光定量PCR检测血清/血浆microRNAs临床应用前的准备
2015-10-21邓开凤戴盛明
邓开凤 戴盛明★
·综述·
实时荧光定量PCR检测血清/血浆microRNAs临床应用前的准备
邓开凤 戴盛明★
现已证明血清/血浆microRNAs(miRNAs)表达谱的变化与多种疾病的发生、发展相关。血清/血浆miRNAs分子稳定,不易降解,且标本采集创伤小、便捷,非常适合应用于临床实验室检测。因此miRNAs极有可能成为未来疾病诊断和预后评估的分子标志物乃至治疗靶标。实时荧光定量PCR检测法(real-time quantitative polymerase chain reaction,RT-qPCR)操作简便,需要的RNA量较少,灵敏度极高,能在短时间内获得结果,并可同时检测多种miRNAs表达,有良好的应用前景。本文将详细探讨现阶段用于血清/血浆miRNAs定量检测的RT-qPCR方法,以及总结血清/血浆miRNAs定量检测应用于临床检验应注意的问题。
MicroRNAs;血清/血浆;实时荧光定量PCR
miRNAs发现始于1993年,Lee等研究人员在秀丽新小杆线虫(caenorhabditis elegans,C. elegans)中意外发现控制着线虫时序性发育的双链小RNA分子lin-4[1]。直至2000年,Reinhart[2]等发现第二个具有转录后调节功能的RNA小分子let-7,miRNAs才逐渐进入人们的视野成为一个崭新的研究领域。越来越多的研究人员相继发现了这类具有调控调控作用的小RNA分子。目前人们普遍的共识是:miRNAs是一类高度保守,长度在19~24个核苷酸(nucleotide,nt)左右的内源性非编码小分子RNA。而外周血循环miRNAs是组织细胞分泌产生[3],成熟的miRNAs在细胞内被脂质或脂蛋白包被成外切酶体(exosome),分泌至胞外并进入血液,外切酶体通过内吞作用进入受体细胞,释放出miRNAs发挥生物学功能[4]。生物信息学预测发现,哺乳动物miRNAs能调控超过60%的基因,在细胞发育、凋亡、分化、增殖等重要的生理病理过程中均发挥重要作用[5]。疾病时期,血清/血浆中相关miRNAs表达谱以及含量的改变提示人们miRNAs或可成为一种新的有助于疾病预测、诊断和预后的标志物[6]。血清/血浆miRNAs的稳定使其定量检测成为可能。由于miRNAs分子量小,表达水平极低,因而需要极为灵敏的定量分析方法,实时荧光定量PCR检测法(real-time quantitative polymerase chain reaction,RT-qPCR)被认为是miRNAs定量的金标准[7],本文将详细探讨现阶段用于血清/血浆miRNAs定量检测的RT-qPCR技术及存在的问题。
1 血清/血浆miRNAs实时荧光定量PCR检测
RT-qPCR是指在PCR指数扩增期间通过连续监测荧光信号强弱的变化来即时测定特异性产物的量,并据此推断目的基因的初始量。其能在短时间内获得结果,可同时检测多个miRNAs表达,需要的miRNAs量较少(1~10 ng总RNA),因而特别适合于miRNAs含量极低的血清/血浆检测[8]。miRNAs是极有吸引力的候选生物标志物,而RT-qPCR检测血清/血浆miRNAs如要应用于临床,在实验的每个阶段都必须有统一的质量控制标准,才能获得准确、可重复的结果,包括分析前的质量控制,如标本的选择,采集与运送保存;分析中miRNAs提取操作流程,cDNA的合成策略,RT-qPCR中引物设计,校参选择,扩增产物检测,以及后续的数据分析,都应具备最可靠的溯源。
1.1分析前
标本的选择,采集与运送保存:尽管miRNAs[9-11]在其他体液如乳汁、尿液甚至是唾液中也存在(含量更微),但血液检测最方便、可信,因此血液检测仍然是目前临床上最常用的检测标本。已有实验证明[12],血浆与血清miRNAs含量无明显差异,且具有很强的相关性,均适合作为疾病的标志物检测样本。实验室定量实验前应根据前期目的miRNAs筛选样本,或者通过比较实验选取最佳的样本类型,如是血浆还需注意抗凝剂对PCR扩增效率的影响[13]。标本细胞残留、溶血、脂血、黄疸对检查都有影响:某些目的miRNAs在血细胞中亦有表达[14-15],则须在血清/血浆收集时优化离心力的大小、离心次数,以尽可能的消除残余细胞污染;溶血可干扰PCR反应过程[16],则应避免造成血球破裂的动作,如用太细的针头抽血、或病人本身因疾病或治疗造成的败血或溶血现象等可能影响结果的因素都必须列入评估;脂血、黄疸等异常标本也应通过实验验证对检测结果产生何种影响。
miRNAs在血清/血浆中存在较稳定[17],耐RNA酶降解,煮沸、反复冻融、酸碱环境等各种处理方法均不会造成miRNAs损失[4,18],但随着保存时间的延长,依然能观察到血清/血浆miRNAs会发生不同程度的降解[19]。因此需要制定统一规范的标本采集、运送与分装保存流程,以期尽可能减少miRNAs的降解,保证检测结果的重复性与准确性,以及不同病程时期结果的可比性。
1.2分析中
1.2.1miRNAs提取
目的miRNAs提取量的多少直接决定后续检测结果。血清/血浆miRNAs分子量小,且含量极低,如何从样本中分离出全面、且浓度高的RNA组分是miRNAs检测的前提。目前实验室常用的RNA提取纯化方法,如有机溶剂抽提加乙醇沉淀法,能较好地保留小分子RNA,然而后续的脱盐和沉淀步骤容易导致miRNAs流失、盐类和有机溶剂残留,影响定量实验操作反应[20];而硅胶膜离心柱法只能富集较大分子的RNA(>200 nt),小分子RNA往往被漏掉,因而不适用于小分子RNA的分离纯化。这两种方法都存在标本需要多、人为误差大、提取效率有差异、获得的miRNAs种类及数量差异大等缺点[21],因此无法保证miRNAs检测结果的重复性与准确性。商品化的试剂盒因其优化的实验设计和统一的操作流程,能有效快速地纯化miRNAs,实现样本处理的标准化,因此选择最优的miRNAs提取试剂盒是保证结果稳定准确的另一前提。
1.2.2cDNA合成
成熟的miRNAs只有19~24 nt,无Poly A尾,使得miRNAs的逆转录较mRNA更为复杂。目前,miRNAs逆转录的方法主要有特异性茎环引物法和miRNAs加尾法。茎环引物法[22](见图1)针对目的miRNAs设计一段特殊的茎环状引物,该引物中除含有一段与被检miRNAs互补的特异序列外,还含有一段较长的本身有部分碱基互补配对并形成环状的共有序列。茎环状引物与被检miRNAs退火反转录后,能得到一段较长的cDNA,然后以此为模板,针对特异的miRNAs设计引物进行PCR扩增,一条miRNAs序列特异对应一个茎环状结构的RT引物;miRNAs加尾法则先利用Poly(A)聚合酶对总RNA进行加尾处理,使所有miRNAs的3′端加上一段Poly(A)尾,然后用带有特殊Poly(T)接头序列的引物进行反转录合成cDNA第1链,以此为模板,针对目的miRNAs设计引物进行PCR扩增。
与茎环状引物法相比,RNA加尾法的最大优点是能一次性对所有的miRNAs进行加尾反应,将所有的miRNAs反转录为相应cDNA,操作及引物设计简单,但是RNA在反转录前需要进行末端Poly(A)加尾,特异性稍低。因此,茎环法可特异针对成熟的目标miRNAs,是目前最常用的定量检测已知miRNAs方法。综合比较,设计特异的茎环状引物针对目的miRNAs是血清/血浆定量检测的较好选择,其优点在于可以不用对miRNAs进行加尾,防止引物与miRNAs前体及其他RNA结合,逆转录引物5′端的茎环结构形成的碱基堆积和空间限制能显著增强逆转录的特异性,同时茎环结构打开后可以增加miRNAs的长度,为PCR扩增提供合适的模板。primer5.0、DNAstar、dnaman以及miRprimer都可以设计miRNAs特异性茎环引物,选择其中最合适的引物进行后续的试验。
1.2.3qPCR引物设计
研究人员发现越来越多的miRNAs,其同一家族的miRNAs序列往往相似,有时只有一个碱基差异[8]。特异性茎环逆转录引物合成后,cDNA的qPCR特异性引物设计又是一大挑战。通常,上游引物是根据miRNAs自身序列设计,如GC含量太低,可以在上游引物5′端加入GCGCC等的保护碱基;下游引物则在RT引物的反向互补序列中找。也即上游引物是每个miRNAs所特有的,下游引物为通用引物。通常情况下,上游引物序列与待测miRNAs序列基本一致,并将原有的U替换成T,通过增加或减少碱基来调整Tm值与下游引物接近即可。
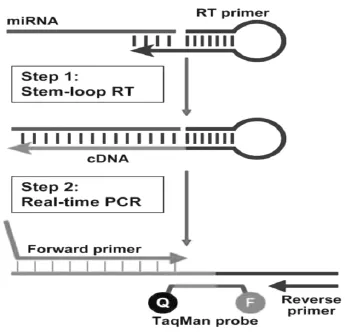
图1 颈环法real-time PCR原理图[22]Figure 1Schematic description of stem-loop RT real-time PCR[22]
1.2.4校参选择
qPCR结果需要进行标准化以消除非生物学变化对结果的影响,使用外源性小RNA或内源性基因是两种标准化的常用介质。早先研究人员使用外源性小RNA校正qPCR定量结果,如线虫的miR-39[23]、miR-238[24]等。但后来的研究发现,如果把纯化出的miRNAs加入到血清/血浆中时,会发生降解的现象[25]。因此,外源性小RNA不能很好的监测miRNAs的提取效率,更无法校正cDNA合成效率以及qPCR定量结果,而不具有参照作用。这一结果也提示研究人员在目的miRNAs提取后应采取措施避免靶核酸的降解,尽快进行后续的逆转录以及定量PCR反应。
内源性基因是目前使用最广泛的校参策略。理想的内参基因应该在所要研究的疾病体系或样品类型中都表达恒定。早前的内源性基因如miR-16,在后来的研究中发现,其在肿瘤的发生发展中也扮演着重要的角色[3],并且在癌症患者与正常对照之间表达有显著差异,溶血也会影响miR-16含量检测[26],说明其无法作为某一疾病的内参;而U6 snRNA(简称U6),在血清血浆中表达水平较低,并且在肝癌患者中表达下调,说明也无法胜任肝脏疾病的内参[27]。可见必须根据病种筛选适合试验体系的特异性稳定表达的内参基因[28]。采用多个内源性基因以组合的方式作为内参的研究,Chen[29]利用Illumina筛选检测以及RT-qPCR验证,发现血清中Let-7d、Let-7g和Let-7i的miRNAs组合模式优于前人用过的U6、RNU44、RNU48等,并可作为多种疾病定量的内参选择。专用于筛选稳定性内参基因的软件,如GeNorm、BestKeeper和NormFinder,在研究某一疾病miRNAs表达谱变化时,即可利用以上软件确定在疾病患者样本中稳定表达的内参基因[30-31]。Han利用NormFinder和BestKeeper程序软件发现U6与miR-192既可以单独也可以组合的模式用于胸腔积液合并肺脓肿与肺腺癌恶性肿瘤病人血清RT-qPCR的内参选择[32]。Fritz[33]则提出利用样本自身miRNAs(21/ 10b)定量比值作为肾透明细胞癌的一个血清标志物,直接简便,前提是通过大样本的标准化筛选实验证明该比值的敏感性与特异性达到临床诊断的要求。Albonico发现miR-17-5p/miR-155比值可作为犬脾淋巴癌的分子诊断工具[34]。
1.2.5RT-qPCR产物检测与数据分析
qPCR产物检测主要有SYBR-Green I和TaqMan探针2种方法,目前主流使用的是TaqMan探针。TaqMan探针与特异性产物结合的短序列,其5′端标记荧光报告基团,3′端含有淬灭基团,探针完好时淬灭基团吸收报告基团的荧光。当PCR反应进行时,Taq酶水解探针,荧光报告基团发出荧光信号,每合成一个双链就产生一个荧光信号被仪器捕捉。TaqMan探针不受miRNAs前体、引物二聚体和非特异性扩增产物的干扰,对于家族miRNAs的检测特异性高。
RT-qPCR数据分析存在许多种算法。其中最简单原始的方法是ΔCt法,此法仅分析Ct值,公式为:ΔCt=Ct(目的基因)-Ct(内参基因),不考虑扩增效率的影响,即认为目的miRNAs与内参基因的扩增效率都为100%,所以无法准确估计目的miRNAs的初始含量。2-ΔΔCT法则在ΔCt法的基础上,将每一组样本每一个目的基因的ΔCt减去对照组样本的ΔCt,并同时对所有结果取相反数(即加一个负运算,正数变为负数,负数变为正数),该步运算得到的结果即为-ΔΔCt。最后,对-ΔΔCt进行2的幂运算,即2-ΔΔCT得出倍数变化值(fold change)。fold change值具有放大效应,可体现两组样本的差异趋势,但容易出现目的miRNAs含量被高估的情况。美国应用生物系统公司(applied biosystems,ABI)提供的一个分析方法是计算log2R,即log2为底对R求对数,R就是2-ΔΔCT。综合以上分析,事实上,计算出-ΔΔCt这一步即可,得到的正值表示较对照组miRNAs上调,负值表示较对照组miRNAs下调,数据图非常直观,也没有放大效应,显著性分析较为准确。这种运算方法关键在于ΔΔCt取相反数,以及实验组和对照组划分清晰,才能得到正确的结果。当然,也可根据目的miRNAs(含量低)定量的目标,在实验设计严谨,将误差控制在最小范围的情况下,选择相应的计算方法,如可放大效应的2-ΔΔCT法。数据分析应该高度客观,不合理的分析会得到错误结果,因此需要通过对RT-qPCR的每一组分进行质量评价以达到最小化变异性和最大化可重复性,而且还需要沿用一个通用的数据分析方法以达到临床诊断需要的基因表达分析标准化。
1.3分析后
临床标本血清/血浆miRNAs在RT-qPCR检测后,通常涉及检验样本的保存,以备复查。未提取miRNAs的原始血清/血浆可根据临床的需要,如监测疾病的始末以及后续对疾病的研究等,通过分装保存于-80℃或液氮的方式长期保存。而提取得到的miRNAs,因其失去基团的保护而变得容易降解,保存条件极为苛刻,因此需要及时选择合适的方式保存。目前的方式有将miRNAs置于-70℃的无水乙醇里长期保存,使用时离心沉淀;或者是现今普遍为大家接受的,将miRNAs逆转录为cDNA后,再-20℃分装保存,其中要注意miRNAs水解酶的去除,如加入DEPC;另外,还有一个高成本的保存模式,即利用RNA稳定剂(RNA stable)[35-36]与提取得到的miRNAs混合,经过干燥后,可长期保存达12年之久。以上各保存方法用于临床时,仍然需要通过实验验证,以保证血清/血浆miRNAs在不同时间检测结果的重复性。
2 总结
miRNAs与疾病相关[37],现已利用RT-qPCR技术检测出非常多与疾病的诊断与治疗相关的miRNAs标志物。如miRNA-143在结直肠癌血浆样本中低表达,研究推测其可能与提高结直肠癌患者对奥沙利铂的敏感性以及阻止TLR2通路有关[38-39]。但是要将miRNAs RT-qPCR用于临床存在很多需要解决的问题。其一,血清/血浆中miRNAs含量极少,1 mL血的抽提总量可能只在ng或pg等级,这意味着在实施定量检测时,血清/血浆miRNAs须从标本采集开始标准化,拟定最佳的miRNAs提取方案以及最优的实验设计,包括最大化避免miRNAs降解,设计特异性茎环引物,以及扩增效率不被抑制的qPCR等;其二,需进行大规模的健康人群筛查,包括不同性别和年龄的血清/血浆表达谱信息,完善相关标志物的肿瘤特异性,以及肿瘤患者个体间的异质性,甚至是miRNAs表达的时空特异性;最后,标准化血清/血浆miRNAs RT-qPCR检测的每一个细节,使其成为疾病诊断与预后判断的有力工具。
[1]Lee RC,Feinbaum RL,Ambros V,et al.The C.Elegans heterochronic gene lin-4 encodes small RNAs with antisense com-plementarity to lin-14[J].Cell,1993,75(5):843-854.
[2]Raihart BJ,Slack FJ,Basson M,et al.The 21-nucleotide let-7 RNA regulates development timing in Caenorhabditis elegans[J].Nature,2000,403(6772):901-905.
[3]Mitchell PS,Parkin RK,Kroh EM,et al.Circulating microRNA sasstable blood-based markers for cancer detection[J].Proc Natl A cad Sci USA,2008,105(30):10513-10518.
[4]Ge Q,Zhou Y,Lu J,et al.miRNA in plasma exosome is stable under different storage conditions[J].Molecules,2014,19(2):1568-1575.
[5]Calin GA,Croce CM.microRNA signatures in human cancers[J].Nat Rev Cancer,2006,6(11):857-866.
[6]Cho WC.MicroRNAs:potential biomarkers for cancer diagnosis,prognosis and targets for therapy[J].Int J Biochem Cell Biol,2010,42(8):1273-1281.
[7]Roberts TC,Coenen-Stass AM,Wood MJ,et al.Assessment of RT-qPCR normalization strategies for accurate quantify cation of extracellular microRNAs in murine serum[J].Plos One,2014,9(2):e89237.
[8]Benes V,Castoldi M.Expression profiling of microRNA using real-time quantitative PCR,how to use it and what is available[J].Methods,2010,50(4):244-249.
[9]Park NJ,Zhou H,Elashoff D,et al.Salivary microRNA:discovery,characterization,and clinical utility for oral cancer detection[J].Clin Cancer Res,2009,15(17):5473-5477.
[10]Hanke M,Hoefig K,Merz H,et al.A robust methodology to study urine microRNA as tumor marker:microRNA-126 and microRNA-182 are related to urinary bladder cancer[J].Urol Oncol,2010,28(6):655-661.
[11]Kosaka N,Izumi H,Sekine K,et al.microRNA as a newimmune-regulatory agent in breast milk[J].Silence,2010,1(1):1-7.
[12]Roberts TC,Coenen-Stass AM,Betts CA,et al.Detection and quantification of extracellular microRNAs in murine biofluids[J].Biol Proced Online.2014,16(1):5.
[13]Kaudewitz D,Lee R,Willeit P,et al.Impact of intravenous heparin on quantification of circulating microRNAs in patients with coronary artery disease[J].Thromb Haemost,2013,110(3):609-615.
[14]Krischner MB,Kao SC,Edelman JJ,et al.Haemolysis during sample preparation alters microRNA content of plasma[J].Plos One,2011,6(9):e24145.
[15]Pritchard CC,Kroh E,Wood B,et al.Blood cell origin of circulating microRNAs:a cautionary note for cancer biomarker studies[J].Cancer Prev Res(Phila),2012,5(3):492-497.
[16]Kirschner MB,Edelman JJ,Kao SC,et al.The impact of hemolysis on cell-Free microRNA biomarkers[J]. Front Genet,2013,4:94.
[17]Cheng L,Sharples RA,Scicluna BJ,et al.Exosomes provide a protective and enriched source of miRNA for biomarker profiling compared to intracellular and cellfree blood[J].J Extracell Vesicles,2014,doi:10.3402/ jev.v3.23743.
[18]Wang Z,Luo H,Pan X,et al.A model for data analysis of microRNA expression in forensic body fluid identification[J].Forensic Sci Int Genet,2012,6(3):419-423.
[19]Duttagupta R,Jiang R,Gollub J,et al.Impact of cellular miRNAs on circulating miRNA biomarker signatures[J]. Plos One,2011,6(6):e20769.
[20]Kroh EM,Parkin RK,Mitchell PS,et al.Analysis of circulating microRNA biomarkers in plasma and serum using quantitative reverse transcription-PCR(qRT-PCR)[J].Methods,2010,50(4):298-301.
[21]Rekker K,Saare M,Roost AM,et al.Comparison of serum exosome isolation methods for microRNA profiling[J].Clin Biochem,2014,47(1-2):135-138.
[22]Chen C,Ridzon DA,Broomer AJ,et al.Real-time quantification of microRNAs by stem-loop RT-PCR[J]. Nucleic Acids Res,2005,33(20):e179.
[23]Ho AS,Huang X,Cao H,et al.Circulating miR-210 as a novel hypoxia marker in pancreatic cancer[J].Transl Oncol,2010,3(2):109-113.
[24]Brase JC,Johannes M,Schlomm T,et al.Circulating miRNAs are correlated with tumor progression in prostate cancer[J].Int J Cancer,2011,128(3):608-616.
[25]Arroyo JD,Chevillent JR,Kroh EM,et al.Argonaute2 complexes carry a population of circulating microRNAs independent of vesicles in human plasma[J].Proc Natl Acad Sci USA,2011,108(12):5003-5008.
[26]Huang Z,Huang D,Ni S,et al.Plasma microRNAs are promising novel biomarkers for early detection of colorec-tal cancer[J].Int J Cancer,2010,127(10):118-126.
[27]Ding X,Ding J,Ning J,et al.Circulating microRNA-122 as a potential biomarker for liver injury[J].Mol Med Rep,2012,5(6):1428-1432.
[28]Wang K,Yuan Y,Cho JH,et al.Comparing the microRNA spectrum between serum and plasma[J].Plos One,2012,7(7):e41561.
[29]Chen X,Liang H,Guan D,et al.A combination of let-7d,let-7g and let-7i serves as a stable reference for normalization of serum microRNAs[J].Plos One,2013,8(11):e79652.
[30]Lardizábal MN,Nocito AL,Daniele SM,et al.Reference genes for real-time PCR quantification of microRNAs and messenger RNAs in rat models of hepatotoxicity[J].Plos One,2012,7(5):e36323.
[31]Etheridge A,Lee I,Hood L,et al.Extracellular microRNA:a new source of biomarkers[J].Mutat Res,2011,717(1-2):85-90.
[32]Han HS,Jo YN,Lee JY,et al.Identification of suitable reference genes for the relative quantification of microRNAs in pleural effusion[J].Oncol Lett,2014,8(4):1889-1895.
[33]Fritz HK,Lindgren D,Ljungberg B,et al.The miR(21/ 10b)ratio as a prognostic marker in clear cell renal cell carcinoma[J].Eur J Cancer,2014,50(10):1758-1765.
[34]Albonico F,Mortarino M,Avallone G,et al.The expression ratio of miR-17-5p and miR-155 correlates with grading in canine splenic lymphoma[J].Vet Immunol Immunopathol,2013,155(1-2):117-123.
[35]Johnson BJ,Melde BJ,Dinderman MA,et al.Stabilization of RNA through absorption by functionalized mesoporous silicate nanospheres[J].Plos One,2012,7(11):e50356.
[36]Begolo S,Shen F,Ismagilov RF.A microfluidic device for dry sample preservation in remote settings[J].Lab Chip,2013,13(22):4331-4342.
[37]Blondal T,Jensby NS,Baker A,et al.Assessing sample and miRNA profile quality in serum and plasma or other biofluids[J].Methods,2013,59(1):S1-S6.
[38]Qian X,Yu J,Yin Y,et a1.MicroRNA-143 inhibits tumor gromh and angiogenesis and sensitizes chemosensitivity to oxaliplatin in colorectal cancers[J].Cell Cycle,2013,12(9):1385-1394.
[39]Piepoli A,Tavano F,Copetti M,et a1.Mima expression profiles identify drivers in colorectal and pancreatic cancels[J].Plos One,2012,7(3):e33663.
The preparation of real-time fluorescent quantitative PCR detection of serum/plasma microRNAs before clinical application
DENG Kaifeng,DAI Shengming★
(Liuzhou Key Laboratory of Tumor Diseases and Prevention,Clinical Laboratory,Fourth Affiliated Hospital of Guangxi Medical University,Liuzhou,Guangxi,China,545005)
It has been proved that the changes of serum/plasma microRNAs(miRNAs)expression relates to the occurrence and development of various diseases.The molecular of serum/plasma miRNAs are stable and hard to degrade.It is easy to obtain blood specimen from small wound and suitable to detect for clinical laboratory.Therefore,miRNAs are most likely to become a potential biomarker for disease diagnosis and prognosis evaluation,even the target spot of treatment.As is easy to operate with few RNA,and with high sensitivity to detect a variety of miRNAs expression in a short time,real time fluorescence quantitative PCR(RT-qPCR)detection method has a good application prospect.In this paper,a review on the detection methods of serum/plasma miRNAs with RT-qPCR at the present stage will be discussed,and the countermeasures on the clinical application of serum/plasma miRNAs quantitative detection will be summarized.
MicroRNAs;Serum/plasma;Real-time quantitative PCR
国家自然科学基金(81160269)
广西医科大学第四附属医院医学检验科,柳州市肿瘤疾病与防治重点实验室,广西,柳州545005
戴盛明,E-mail:daishm@sina.com
