黑小麦麸皮戊聚糖的酶法提取工艺条件优化与理化性质分析
2015-10-21孙元琳张陇清运城学院生命科学系山西运城044000山西大学生命科学学院山西太原00006山西省农科院棉花研究所山西运城044000
孙元琳,仪 鑫,王 锋,宋 昱,张陇清(.运城学院生命科学系,山西运城044000;.山西大学生命科学学院,山西太原00006;.山西省农科院棉花研究所,山西运城044000)
黑小麦麸皮戊聚糖的酶法提取工艺条件优化与理化性质分析
孙元琳1,仪鑫2,王锋1,宋昱3,张陇清1
(1.运城学院生命科学系,山西运城044000;2.山西大学生命科学学院,山西太原030006;3.山西省农科院棉花研究所,山西运城044000)
研究了黑小麦麸皮戊聚糖的酶法提取工艺条件,并对其单糖组成和相对分子质量等理化性质进行分析。运用单因素实验方法,分析了提取工艺中料液比、加酶量、提取温度、溶液pH、提取时间对戊聚糖提取率的影响,并通过正交实验对其工艺条件进行优化,确定了酶法提取戊聚糖的最佳工艺参数为:加酶量12mg/10g底物、提取温度60℃、提取时间90min、溶液pH6、料液比1∶10(g/mL)。在此条件下,戊聚糖的提取率为4.17%。通过气相色谱(GC)和高效液相色谱(HPLC)分析了黑小麦麸皮酶提戊聚糖EEP的理化性质。结果表明,EEP主要由阿拉伯糖(Ara)、木糖(Xyl)和葡萄糖(Glc)组成,并含有微量半乳糖(Gal),其摩尔比为Ara∶Xyl∶Glc=1.0∶1.55∶3.19,Ara/Xyl比值为0.64。EEP的相对分子质量为2.16×104。
黑小麦,戊聚糖,酶法提取,正交实验
黑小麦是禾本科一年生栽培谷物,其籽粒呈紫色、蓝色、紫黑色、深褐色或接近于黑色。黑小麦来源于小麦的远缘杂交后代,是通过属间远缘杂交技术培育而成的一种黑粒小麦新品种。它不仅具有普通小麦的一般特征,还具有独特的营养和保健功能,主要用于制作馒头、面包、麦片、挂面等传统食品,已成为一类重要的黑色食品资源[1]。
黑小麦麸皮富含膳食纤维,其中,戊聚糖含量丰富[2]。戊聚糖具有高粘度、高持水力、氧化交联等性质,是影响谷物加工过程及产品品质的重要功能性成分[3]。戊聚糖作为一种功能性多糖,还具有润肠通便、降血糖、降血脂、调节人体免疫力、预防结肠癌等多种生理功能[4]。因此,以黑小麦麸皮为原料制备戊聚糖,将其开发为天然的品质改良剂或天然保健食品功能因子,对预防慢性代谢性疾病、保障人体健康起着重要作用。

表1 酶法提取戊聚糖单因素实验Table 1 Single-factor experiments for enzymatic extraction of pentosan
黑小麦麸皮结构致密,戊聚糖、β-葡聚糖、纤维素和木质素等膳食纤维紧密缔合,构成致密的细胞壁网络结构[2,5]。因此,黑小麦麸皮的可溶性戊聚糖含量较低,而不溶性戊聚糖含量较高,从而限制了黑小麦戊聚糖在食品体系中的应用。特异性戊聚糖酶有助于解除细胞壁聚合物分子间的缔合作用,促进细胞壁降解、结构疏松,有利于戊聚糖的溶出,使一部分不溶性戊聚糖转变为可溶性戊聚糖,提高了戊聚糖的提取率[6]。本实验以黑小麦麦麸为原料,利用戊聚糖酶提取水不溶性戊聚糖,运用正交实验对其工艺条件进行优化,并对其单糖组成和相对分子质量等理化性质进行分析,进而为黑小麦特色谷物资源的有效增值和综合利用提供理论依据。
1 材料与方法
1.1材料与仪器
黑小麦产自山西省运城市,由山西省农科院棉花研究所提供;戊聚糖酶(E.C.3.2.1.8,2.5U/mg,from Thermomyces lanuginosus)Sigma公司;牛血清蛋白、三氟乙酸、苯酚、浓硫酸、95%乙醇、无水乙醇等均为分析纯。
GC-14A型气相色谱仪日本Shimadzu公司;Waters 2690型高效液相色谱仪美国Waters公司;722分光光度计上海精科分析仪器厂;RE52A型旋转蒸发仪上海亚荣生化仪器厂。
1.2实验方法
1.2.1原料预处理将黑小麦麸皮粉碎,过40目筛。用体积分数为80%的乙醇溶液于80℃热处理原料2次,抽滤,真空干燥。经乙醇预处理的黑小麦麦麸于100℃热水提取水溶性戊聚糖2次,离心(3000r/min,15min),所得残留物经95%乙醇反复洗涤,抽滤,然后在45℃条件下真空烘干,备用。
1.2.2酶法提取工艺预处理黑小麦麸皮10g在加入一定量戊聚糖酶(E.C.3.2.1.8,2.5U/mg)的50mmol/L醋酸缓冲液中提取2次;离心(3000r/min,15min),合并上清液;上清液真空浓缩,加入3倍95%乙醇,4℃静置过夜,离心,沉淀复溶,透析,冷冻干燥,得到黑小麦酶提戊聚糖EEP。
1.2.3含量测定方法多糖含量测定:苯酚-硫酸法[7]。戊聚糖含量测定:间苯三酚-冰醋酸法[8]。蛋白质含量测定:Lowry法[9]。
1.2.4戊聚糖提取率的计算

1.2.5单因素实验分别考察料液比、戊聚糖酶的添加量、提取温度、溶液pH、提取时间等主要因素对戊聚糖提取效果的影响,具体单因素实验设计见表1。
1.2.6正交实验设计在单因素实验的基础上,采用L9(34)正交实验,研究戊聚糖酶添加量、提取时间、提取温度、溶液pH的交互作用对戊聚糖提取率的影响,优化黑小麦麸皮戊聚糖酶法提取工艺,实验因素及水平见表2。
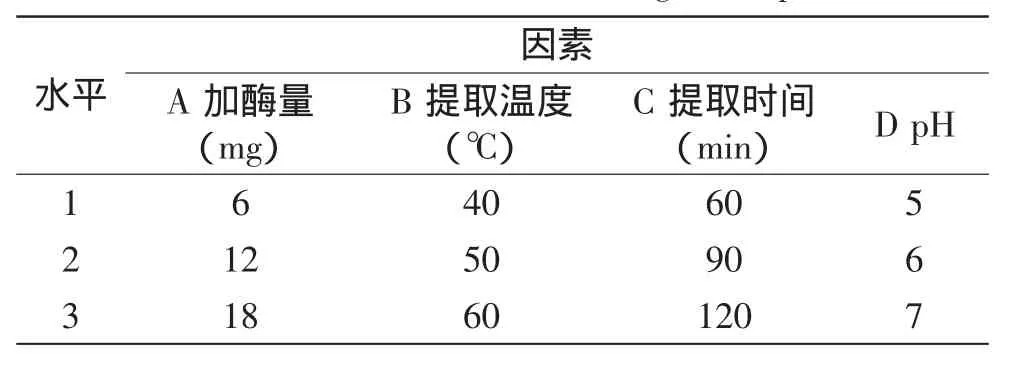
表2 正交实验因素和水平表Table 2 Factors and levers for orthogonal experiment
1.2.7单糖组成分析将戊聚糖样品5mg溶于2mol/L的三氟乙酸(TFA)溶液,于100℃水解4h。水解液除尽过量的TFA后,采用糖腈乙酸酯衍生化法衍生。反应产物直接进样作气相色谱分析,根据出峰时间判断单糖种类,根据峰面积的比值确定各单糖间的比例关系。采用DB-1701毛细管色谱柱(0.53mm×30m),载气为N2,流速1.5mL/min,FID氢焰检测器,汽化室温度260℃,检测器温度260℃。采用程序升温:起始温度120℃(2min)→195℃(10℃/min,1min)→240℃(3℃/min,10min)。进样量:0.8μL。
1.2.8相对分子质量测定采用色谱柱Waters UltrahydrogelTMLinear(7.8mm×300mm),检测器为Waters 2410示差折光检测器。以0.1mol/L NaNO3为流动相,流速0.9mL/min,柱温45℃。将相对分子质量分别为16500、26290、40000、84000、158000的标准Dextran相继进样,记录保留时间TR,以TR为横坐标,lgM为纵坐标绘制标准曲线,求得回归方程。待测样品溶于水,进样20μL,根据所得TR,通过回归方程计算多糖的相对分子质量。
2 结果与讨论
2.1单因素实验
2.1.1料液比对戊聚糖提取率的影响料液比对提取率的影响结果见图1。由于黑小麦麸皮戊聚糖酶法提取液粘度不高,料液比在1∶10~1∶14范围内,并没有随着料液比的提高而有明显变化,另外还加大了水的消耗,增加后续工艺处理的时间和费用。因此,确定提取过程料液比1∶10作为最佳料液比。
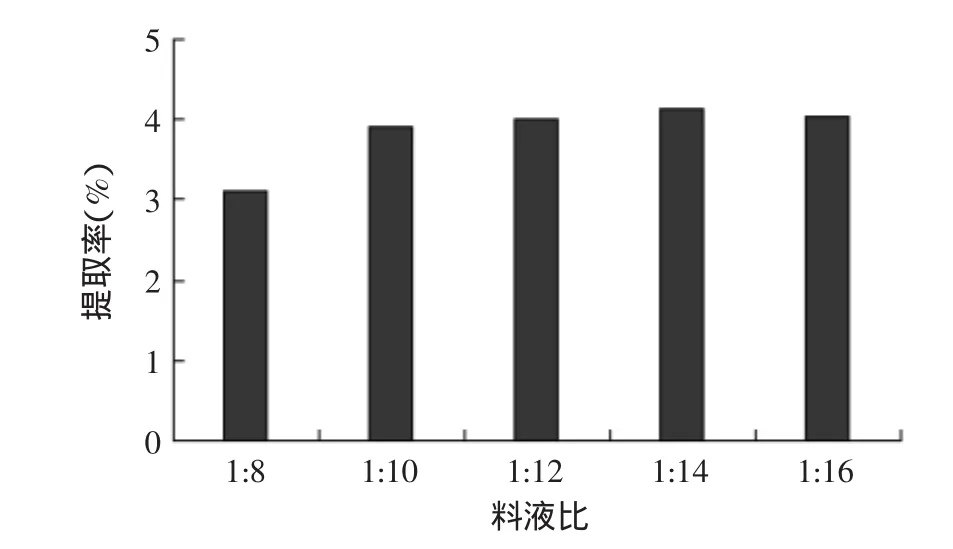
图1 料液比对提取率的影响Fig.1 Effect of ratio of powder and water on extraction rate
2.1.2戊聚糖酶添加量对戊聚糖提取率的影响酶添加量对戊聚糖提取率的影响结果见图2。图2显示,当戊聚糖酶添加量小于12mg时,戊聚糖的提取率随着戊聚糖酶添加量的增加而逐渐增加。当戊聚糖酶添加量超过12mg时,戊聚糖的提取率逐渐降低。这是由于,一方面戊聚糖酶作为一种细胞壁物质分解酶,可使黑小麦麸皮致密的细胞壁发生降解而变得松散,促进了戊聚糖的溶出,并使麸皮中的水不溶性戊聚糖(WIP)发生降解,相对分子质量降低,溶解度发生改变,一部分WIP变为水溶性戊聚糖(WSP),从而使WSP提取率增加。另一方面,随着戊聚糖酶添加量的继续增加,酶解程度加剧,将WSP进一步降解为较低分子量的低聚糖,反而使戊聚糖的提取率下降。因此,确定提取过程戊聚糖酶添加量的正交水平为6、12、18mg。

图2 酶添加量对提取率的影响Fig.2 Effect of enzyme quantity on extraction rate
2.1.3提取时间对戊聚糖提取率的影响从图3可以看出,在戊聚糖的酶法提取过程中,当提取时间小于90min时,随着提取时间的延长,戊聚糖的提取率逐渐增加;之后随着提取时间的增加,戊聚糖提取率的增加量变化趋于平缓。当提取时间超过于120min时,戊聚糖提取率有所下降。这是由于随着酶解时间的延长,溶出的戊聚糖分子发生部分降解,使得提取率随之下降。由此,确定戊聚糖酶法提取时间的正交水平为60、90、120min。

图3 提取时间对提取率的影响Fig.3 Effect of extraction duration on extraction rate
2.1.4pH对戊聚糖提取率的影响pH对戊聚糖提取率的影响结果见图4。图4结果显示,酶法提取黑小麦麸皮戊聚糖的最适pH为6左右。当pH<6时,戊聚糖提取率随着溶液pH的增大而逐渐增加;当pH>6时,戊聚糖的提取率随pH的增加而逐渐降低。这是由于溶液pH过大或过小都会偏离戊聚糖酶的最适pH,不同程度影响了戊聚糖酶的酶活力,从而降低了戊聚糖提取率。由此,确定戊聚糖酶法提取溶液pH的正交水平为pH5、6、7。
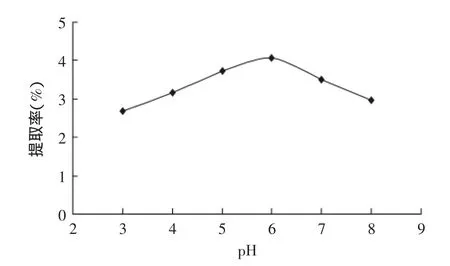
图4 溶液pH对提取率的影响Fig.4 Effect of pH on extraction rate
2.1.5提取温度对戊聚糖提取率的影响从图5可以看出,在戊聚糖的酶法提取过程中,最佳的提取温度范围在40~50℃之间。当提取温度低于40℃时,戊聚糖提取率随提取温度升高,增加明显;当提取温度高于40℃时,戊聚糖提取率逐渐降低。这是由于40~50℃为戊聚糖酶的最适温度,酶的活性在此温度下达到最大,所以戊聚糖提取率也最大,而温度过高或过低都会影响酶的活力,使戊聚糖的提取率下降。由此,确定戊聚糖酶法提取温度的正交水平为40、50、60℃。

图5 提取温度对提取率的影响Fig.5 Effect of temperature on extraction rate
2.2正交实验
以戊聚糖酶添加量、提取时间、提取温度、溶液pH作为正交实验因素,以戊聚糖提取率为响应值,采用L9(34)正交表进行实验,对黑小麦麸皮戊聚糖的酶法提取工艺参数进行优化,确定戊聚糖的最佳酶法提取工艺。实验结果如表3所示。

表3 正交实验结果与分析Table 3 Design and results of orthogonal experiment
由表3正交实验结果可以看出,影响戊聚糖提取率因素的主次顺序为:加酶量>提取温度>溶液pH>提取时间。黑小麦麸皮戊聚糖酶法提取的理想工艺条件为实验号6,即A2B3C1D2。在此条件下,戊聚糖的提取率最高,为4.12%。另一方面,极差分析结果表明,戊聚糖酶法提取的适宜工艺条件为A2B3C2D2。在此条件下,测得的戊聚糖提取率为4.17%,高于在A2B3C1D2条件下戊聚糖的提取率。因此,确定黑小麦麸皮戊聚糖酶法提取的最适工艺参数为A2B3C2D2,即加酶量12mg/10g底物、提取温度60℃、提取时间90min、溶液pH6。在此条件下,戊聚糖的提取率为4.17%。
2.3单糖组成分析
分析了优化工艺条件所得酶提戊聚糖EEP组分的化学组成和单糖组成,结果如表4所示。从表中可以看出,EEP的多糖含量和戊聚糖含量分别为70.44%和67.25%,且含有9.32%的蛋白。以上结果表明,戊聚糖样品还含有少量其他多糖组分以及非糖物质。表4显示,EEP主要由阿拉伯糖(Ara)、木糖(Xyl)和葡萄糖(Glc)组成,并含有微量半乳糖(Gal),其摩尔比为Ara∶Xyl∶Glc=1.0∶1.55∶3.19,且Ara/Xyl比值为0.64。单糖组成表明,酶法提取的戊聚糖样品除了戊聚糖外,还含有一定量葡聚糖。葡聚糖作为黑小麦麸皮膳食纤维的一部分,在酶法提取过程中,随着戊聚糖酶对细胞壁的降解被一同浸出。

表4 戊聚糖组分EEP的化学组成和单糖组成分析Table 4 Chemical and monosaccharide compositions of pentosan fraction EEP
2.4相对分子质量分布

图6 戊聚糖组分EEP的相对分子质量分布Fig.6 Mw distribution of pentosan fraction EEP
采用HPGPC凝胶色谱柱对EEP组分的相对分子质量分布进行测定。图6显示,EEP组分的凝胶柱洗脱曲线为单一峰,相对分子质量为2.16×104。从图6看出,单一峰还存在一小峰肩,结合单糖组成分析结果,推断所制备的戊聚糖样品还含有少量葡聚糖。与黑小麦麸皮碱提戊聚糖组分的相对分子质量比较(3.81×105)[2],酶提戊聚糖的相对分子质量较低。
3 结论
酶法提取黑小麦麸皮戊聚糖的最佳工艺条件为:加酶量12mg/10g底物、提取温度60℃、提取时间90min、溶液pH6、料液比1∶10(g/mL)。在此条件下,黑小麦麸皮戊聚糖的提取率为4.17%。
酶提戊聚糖EEP主要由阿拉伯糖(Ara)、木糖(Xyl)和葡萄糖(Glc)组成,并含有微量半乳糖(Gal),其摩尔比为Ara∶Xyl∶Glc=1.0∶1.55∶3.19,且Ara/Xyl比值为0.64。EEP的相对分子质量为2.16×104。
[1]孙善澄,刘少翔.黑粒高营养小麦种植与加工利用[M].北京:金盾出版社,2003:1-10.
[2]孙元琳,陕方,刘惠芳,等.黑小麦麦麸多糖的制备与分析[J].中国粮油学报,2010,25(6):94-97.
[3]Izydorczyk M S,Dexter J E.Barley β-glucans and arabinoxylans:molecular structure,physicochemical properties,andusesinfoodproducts—areview[J].FoodResearch International,2008,41:850-868.
[4]Muralikrishna G,Rao M Subba.Cereal non-cellulosic polysaccharides:structure and function relationship—an overview[J].Critical Reviews in Food Science and Nutrition,2007,47:599-610.
[5]Annica A M Andersson,Roger Andersson,Vieno Piironen,et al.Contents of dietary fibre components and their relation to associated bioactive components in whole grain wheat samples from the HEALTHGRAIN diversity screen[J].Food Chemistry,2013,136:1243-1248.
[6]Maes C,Delcour J A.Structural characterisation of waterextractable and water-unextractable arabinoxylans in wheat bran[J].Journal of Cereal Science,2007,35:315-326.
[7]张惟杰.糖复合物生化研究技术[M].第2版.杭州:浙江大学出版社,1998:121-131.
[8]王肇慈.粮油食品品质分析[M].北京:中国轻工业出版社,1994:92-96.
[9]Dougls S D.A rapid method for the determination of pentosans in wheat flour[J].Food Chemistry,1981(7):139-145.
Optimization of enzymatic extraction process and physicochemical properties of pentosans from black-grained wheat bran
SUN Yuan-lin1,YI Xin2,WANG Feng1,SONG Yu3,ZHANG Long-qing1
(1.Department of Life Sciences,Yuncheng University,Yuncheng 044000,China;2.College of Life Sciences,Shanxi University,Taiyuan 030006,China;3.Cotton Research Institute,Shanxi Academy of Agricultural Sciences,Yuncheng 044000,China)
To study the enzymatic extraction technique and the physicochemical properties of pentosans from black-grained wheat bran.The effect of xylanase quantity,extraction temperature,pH,time duration,ratio of material to liquid on the yield of pentosan were studied by single-factor experiments and the technology parameters were optimized by orthogonal experiment.The optimized parameters were:extracting for 90min at 60℃,pH6,with pentosanase quantity of 12mg/10g substrates and 1∶10 ratio of material to liquid.Under the optimum conditions,the yield of EEP was 4.17%.Physicochemical properties of EEP were analyzed using GC,and HPLC instruments.The results showed that EEP was composed mainly of arabinose,xylose,glucose,and trace amount of galactose,mole ratio of Ara∶Xyl∶Glc=1.0∶1.55∶3.19.The Ara/Xyl value was 0.64.It had a relative low Mw of 2.16×104.
black-grained wheat;pentosan;enzymatic extraction;orthogonal experiment
TS210.1
A
1002-0306(2015)02-0186-05
10.13386/j.issn1002-0306.2015.02.031
2014-03-11
孙元琳(1971-),女,博士,教授,研究方向:谷物资源综合利用与开发。
国家自然科学基金项目(31101244);山西省自然科学基金项目(2012011031-1);山西省高校优秀青年学术带头人支持计划;山西省高校大学生创新创业训练项目(2013340);运城学院院级产学研合作项目(CY-2012013)。
