响应面法优化水飞蓟茎中总黄酮的提取工艺
2015-10-21于金跃李新华齐晓军王海娜
于金跃,孙 晶,李新华,齐晓军,王海娜
(沈阳农业大学食品学院,辽宁沈阳110161)
响应面法优化水飞蓟茎中总黄酮的提取工艺
于金跃,孙晶,李新华*,齐晓军,王海娜
(沈阳农业大学食品学院,辽宁沈阳110161)
利用响应面法优化水飞蓟茎中黄酮类物质的提取工艺。分别研究提取时间、乙醇体积分数、料液比、提取温度四个单因素实验对水飞蓟茎中总黄酮提取量的影响。实验结果表明,最佳提取工艺为提取时间50min、提取温度61℃、乙醇体积分数40%、料液比1∶40。该条件下水飞蓟茎中总黄酮提取量为4.71mg/g,与多项式回归模型的结果一致。
水飞蓟茎,总黄酮,响应面法,提取工艺
黄酮类化合物是植物产生的一些次级代谢产物[1],广泛存在于高等植物的根、茎、叶、花、果实等中。黄酮类化合物具有高度的化学反应性,如能清除体内的自由基,具有抗氧化性作用[2];且黄酮类化合物拥有抑制酶的活性、抗病毒[3]、抗炎症[4]、抗癌[5]、抗糖尿病并发症[6]等功能,已被列为保健食品的一类功能因子[7]。
水飞蓟(Silybum marianum)是一种一年生或两年生植物,原产于南欧及北非[8],被称为具有抗癌活性的草药[9],同时有益于肝脏疾病[10]和免疫系统疾病的治疗[11]。目前,水飞蓟已成为世界公认的保肝植物。但目前大多是对水飞蓟种籽进行研究,而对水飞蓟茎叶的研究相对较少[12]。本研究以水飞蓟茎为原料,采用有机溶剂提取水飞蓟茎中黄酮类物质,以总黄酮提取量为指标,采用响应面法优化水飞蓟茎中黄酮类物质的提取工艺条件,为进一步开发利用水飞蓟茎叶提供理论依据。
1 材料与方法
1.1材料与仪器
水飞蓟茎采自辽宁盘锦,自然风干;芦丁标准品(>98%) 成都曼斯特有限公司;无水乙醇沈阳化学试剂厂。
GD200-2型电子天平北京赛多利斯仪器有限公司;KQ-250DB型数控超声波清洗器昆山市超声仪器有限公司;SHE-IIIB型循环水式多用真空泵上海博通经贸有限公司;7200型可见分光光度计尤尼柯(上海)有限公司。
1.2实验方法
1.2.1芦丁标准曲线的绘制精确称取芦丁标准品10mg,用60%的乙醇定容至100m L的容量瓶中,配制成0.1mg/m L的标准液。
分别吸取0、0.1、0.2、0.3、0.4、0.5m L的芦丁标准品溶液于10m L试管中,加60%的乙醇溶液至5m L。加5%的NaNO2溶液0.3m L,摇匀后静置5m in;加10%的A l(NO3)3溶液0.3m L,摇匀后静置6m in;加4%的NaOH溶液4m L,用60%的乙醇溶液定容至10m L,摇匀后静置15m in,于506nm处测定吸光度,以吸光度(A)为纵坐标,芦丁质量浓度(mg/m L)为横坐标,绘制芦丁标准曲线[13]。
1.2.2水飞蓟茎中总黄酮含量的测定方法将风干的水飞蓟茎打碎成粉末,过60目筛,准确称取1.00g水飞蓟茎粉末于锥形瓶中,在一定的温度、料液比、乙醇体积分数下提取一定时间后,抽滤;滤液用乙醇溶液定容至100m L的容量瓶中,摇匀,作为待测液;移取1.00m L待测液按1.2.1方法于506nm处测定吸光度。根据回归方程,用吸光度计算出被测液中黄酮类物质的质量浓度c,然后由c计算出水飞蓟茎中总黄酮的含量。
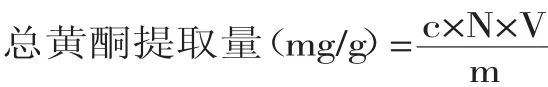
式中:c-稀释后样品溶液总黄酮质量浓度(mg/ m L);N-稀释倍数:10;V-最初样品定容体积(100m L);m-样品质量(1.00g)。
1.2.3单因素实验
1.2.3.1提取温度对总黄酮提取量的影响准确称取1.00g的水飞蓟茎粉5份,分别置于锥形瓶中,料液比为1∶40,用体积分数为40%的乙醇溶液分别在40、50、60、70、80℃条件下回流提取50m in。
1.2.3.2乙醇体积分数对总黄酮提取量的影响准确称取1.00g的水飞蓟茎粉5份,分别置于锥形瓶中,料液比为1∶40,分别加入体积分数为10%、20%、40%、60%、80%的乙醇溶液,在60℃条件下回流提取50min。
1.2.3.3料液比对总黄酮提取量的影响准确称取1.00g的水飞蓟茎粉5份,分别置于锥形瓶中,分别加入料液比为1∶20、1∶30、1∶40、1∶50、1∶60的60%乙醇在60℃条件下回流提取50m in。
1.2.3.4提取时间对总黄酮提取量的影响准确称取1.00g的水飞蓟茎粉5份,分别置于锥形瓶中,料液比为1∶40,用体积分数为40%的乙醇溶液在60℃条件下分别提取10、30、50、70、90m in。
1.2.4响应面实验根据单因素实验结果,选取乙醇体积分数、料液比、提取温度为对提取黄酮影响较显著的三个因素,在固定提取时间50m in的条件下,根据Box-Beknhen实验设计原理,以黄酮提取量为响应值,采用3因素3水平的响应面实验表,进行响应面实验确定水飞蓟茎中总黄酮提取的最佳工艺。因素水平编码表如表1所示。
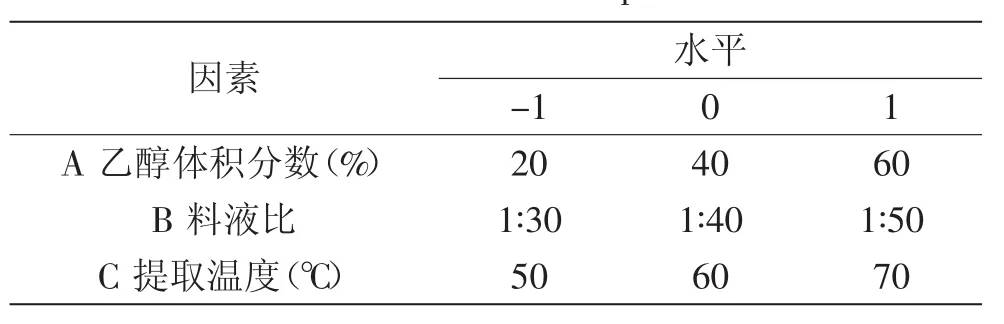
表1 响应面因素水平编码表Table 1 Factors and levers of response surface test
1.2.5数据处理本实验中所用到的数据分析软件是Design Expert.v 8.0和Spass Statistics 17.0。
2 结果与分析
2.1芦丁标准曲线
芦丁标准曲线如图1所示。
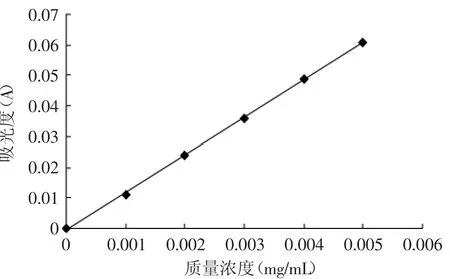
图1 芦丁标准曲线Fig.1 Standard curve of rutin
芦丁线性回归方程为:y=12.314x-0.0006,R2= 0.9996,在0~0.005mg/m L浓度范围内有较好的线性关系。
2.2影响总黄酮提取的单因素实验结果
2.2.1提取温度对总黄酮提取量的影响不同提取温度对水飞蓟茎中总黄酮提取量影响的结果如图2所示。
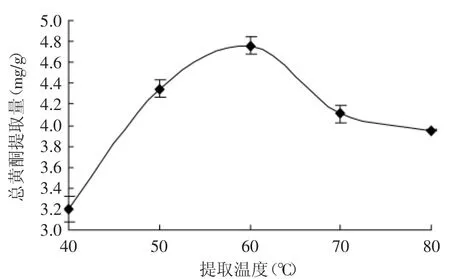
图2 提取温度对总黄酮提取量的影响Fig.2 Effect of extraction temperature on total flavonoids yield
由图2可知,当提取的温度低于60℃时,随着温度的升高,黄酮的提取量增加;当温度为60℃时,黄酮提取量达到最大,但当温度继续增加时,黄酮提取量反而下降。原因是温度升高接近乙醇沸点有利于回流,提取量会增加,但是温度过高可能会导致活性成分的破坏从而使黄酮的提取量下降[14]。
2.2.2乙醇体积分数对总黄酮提取量的影响不同乙醇体积分数对水飞蓟茎中总黄酮提取量的影响见图3。
由图3可知,随着乙醇体积分数的提高,水飞蓟茎中黄酮的提取量逐渐增大。当乙醇体积分数达到40%时,黄酮的提取量最高。超过该体积分数后,黄酮的提取量反而下降,同时叶绿色大部分溶出,通过用比色法来测定黄酮含量的结果带来一定的影响,所以选择乙醇体积分数40%左右比较适宜。
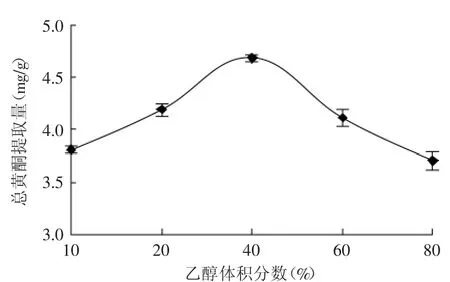
图3 乙醇体积分数对总黄酮提取量的影响Fig.3 Effect of ethanol concentration on total flavonoids yield
2.2.3料液比对总黄酮提取量的影响不同料液比对水飞蓟茎中总黄酮提取量影响的结果如图4所示。

图4 料液比对总黄酮提取量的影响Fig.4 Effectof liquid-to-solid ratio on total flavonoids yield
由图4可知,随着料液比的增加,黄酮提取量逐渐增大,当料液比达到1∶40时,黄酮的提取量达到最大,当料液比超过1∶40时,黄酮的提取量逐渐下降且趋于平缓。
2.2.4提取时间对总黄酮提取量的影响不同提取时间对水飞蓟茎中总黄酮提取量的影响见图5。
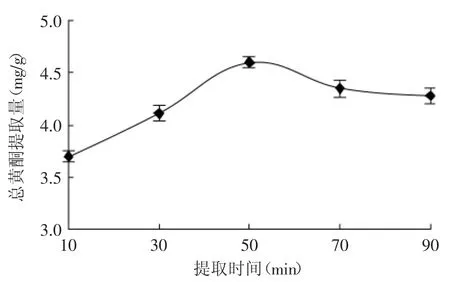
图5 提取时间对总黄酮提取量的影响Fig.5 Effectof extraction time on total flavonoids yield
由图5可知,随着浸提时间延长,黄酮提取量增加,当浸提时间是50m in时,黄酮提取量最高,达到4.60mg/g。继续延长浸提的时间,黄酮提取量有所下降。可能是由于回流热效应长时间作用会破坏黄酮,使其损失增大而影响黄酮的提取量从而产生负效应。
2.3响应面实验
2.3.1响应面实验结果响应面实验结果如表2所示,利用Design Expert.v 8.0软件进行回归分析,得到水飞蓟茎中黄酮提取量(Y)对乙醇体积分数(A)、料液比(B)、提取温度(C)的二次多项回归方程为:
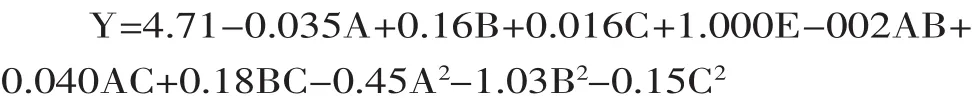
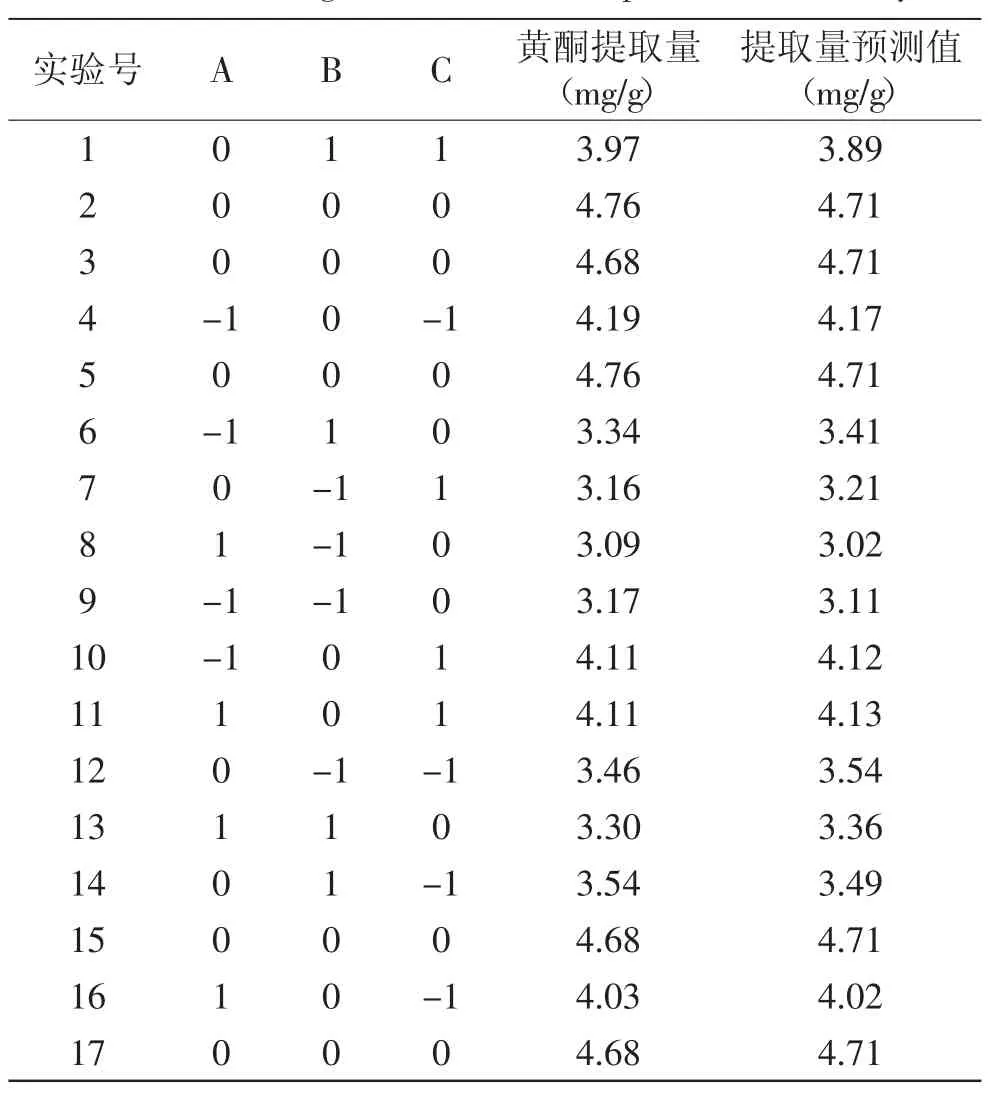
表2 响应面实验结果Table 2 Test design and results of response surface analysis
2.3.2回归方程方差分析方差分析结果详见表3所示,模型Prob>F值小于0.01,表明该回归方程极显著,失拟项不显著,同时B、BC、A2、B2、C2对黄酮提取量Y值的影响极显著。从表3中可以看出,在所选取的因素中,对黄酮提取量的影响大小依次为:料液比>乙醇体积分数>提取温度,并且模型的决定系数R2= 99.31%,大于90%,说明模型方程拟合程度好,可以用于黄酮提取实验的理论预测。
2.3.3响应曲面分析根据回归模型作出相应的响应面图,见图6~图8。
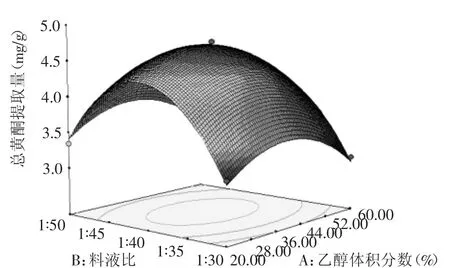
图6 乙醇体积分数和料液比对总黄酮提取量影响的响应面图Fig.6 Response surface plot showing the interactive effectof ethanol concentration and material-liquid ratio on total flavonoids yield
从图6中可以看出,等高线的形状为偏圆形,表明乙醇体积分数A和料液比B交互作用不显著。响应曲面较为陡峭,响应值随料液比B的变化率大于乙醇体积分数A的变化率,说明在两者的交互作用中料液比B对水飞蓟茎中总黄酮含量的影响大于乙醇体积分数A。
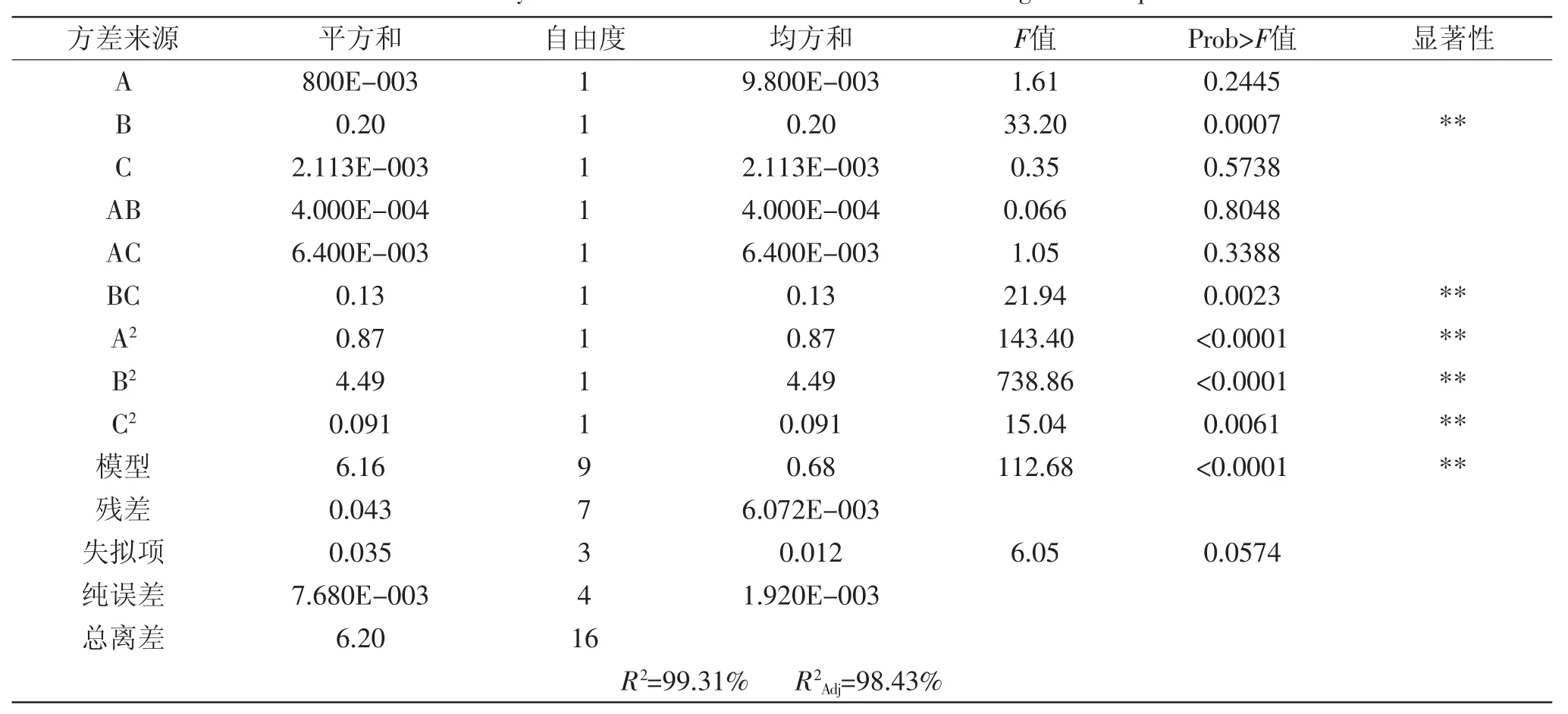
表3 方差分析表Table 3 Analysis of variance for each term of the fitted regression equation
从图7中可以看出,等高线的形状偏圆形,表明乙醇体积分数A和提取温度C的交互作用不显著。响应曲面较为平滑,响应值随乙醇体积分数A的变化率大于提取温度C的变化率,说明在两者的交互作用中乙醇体积分数A对水飞蓟茎中黄酮的含量的影响大于提取温度C。
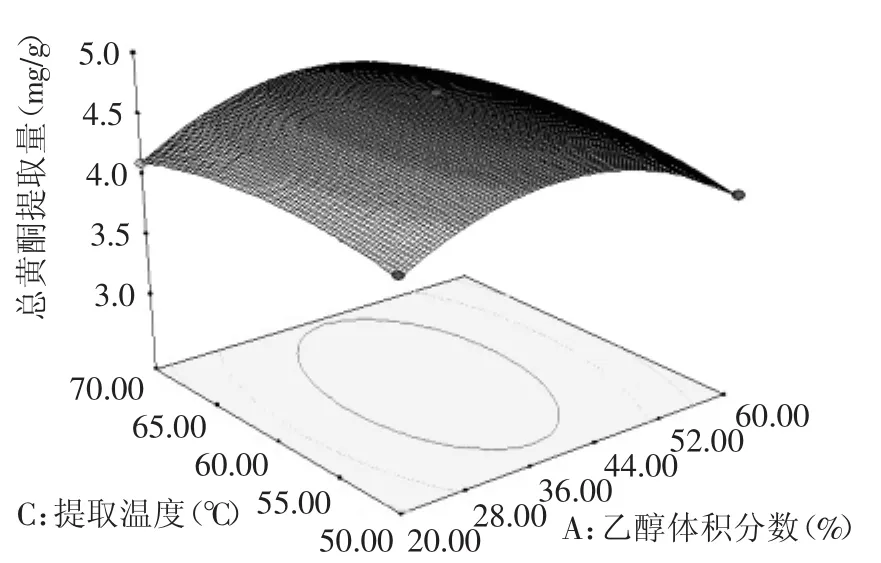
图7 提取温度和乙醇体积分数对总黄酮提取量影响的响应面图Fig.7 Response surface plot t showing the interactive effectof extraction temperature and ethanol concentration on total flavonoids yield
从图8可以看出,等高线的形状为椭圆形,表明料液比B和提取温度C的交互作用极显著,即水飞蓟茎中黄酮含量受料液比B和提取温度C的交互作用显著。响应曲面较为陡峭,响应值随料液比B的变化率大于提取温度C的变化率,说明在两者的交互作用中料液比B对水飞蓟茎中黄酮的含量的影响大于提取温度C。
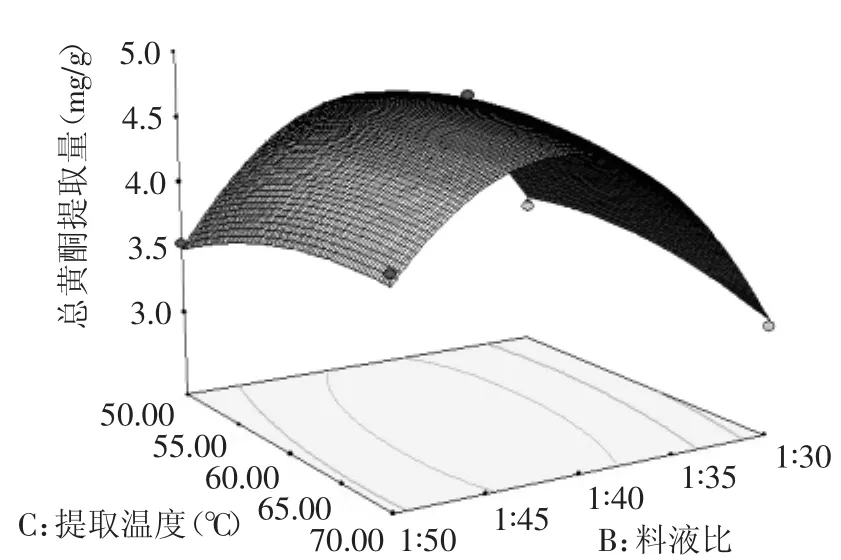
图8 提取温度和料液比对总黄酮提取量影响的响应面图Fig.8 Response surface plot showing the interactive effectof extraction temperature and material-liquid ratio on total flavonoids yield
2.4验证实验
根据响应面优化提取水飞蓟茎中总黄酮的工艺,得到的最佳工艺条件为:乙醇体积分数39.35%,料液比1∶40.09,提取温度61.04℃。结合实际情况并加以修正最终确定以乙醇体积分数40%,料液比1∶40,提取温度61℃为验证实验的最佳工艺条件。进行3次平行验证实验,得到总黄酮的实际平均提取量为4.71mg/g,与理论值4.72mg/g接近。由此可认为实验结果理想,实验模型选择合理。
3 结论与讨论
首先通过单因素实验分别考察料液比、提取时间、提取温度和乙醇体积分数对水飞蓟茎中总黄酮提取量的影响,在此基础上,采用响应面法优化水飞蓟茎中总黄酮的提取工艺,得到水飞蓟茎中总黄酮提取的最佳工艺为:提取时间50min、提取温度61℃、料液比1∶40、乙醇体积分数40%。此条件下,水飞蓟茎中总黄酮的提取量达到4.71mg/g。
水飞蓟茎中含有较高的总黄酮,是否能分离出水飞蓟素,是否具有与水飞蓟种子中黄酮相似的药用和保健功能,还有必要做进一步实验研究。由于黄酮类物质都在一定程度上具有保健功能,因此,水飞蓟茎的开发利用将是水飞蓟产业发展的新途径。
[1]邹浩军,明亮.黄酮类化合物抗炎免疫及抗衰老药理研究进展(综述)[J].安徽卫生职业技术学院学报,2004,2(6):48-50.
[2]崔强,陈景超.黄酮类化合物生理活性及合成研究进展[J].黑龙江科技信息,2011,20:031.
[3]陈义磊,马国财,白红进.刺山柑茎总黄酮提取液体外抗氧化活性的研究[J].新疆农业科学,2011,47(12):2489-2495.
[4]KREN V,WALTEROVA D.Silybin and silymarin:new effects and applications[J].Biomedical Papers,2005,149:29-41.
[5]向昌国,向宁,黄成龙,等.响应面法优化刺槐花黄酮类化合物的微波提取工艺[J].食品科学,2011,32(22):32-36.
[6]曹纬国,刘志勤,邵云,等.黄酮类化合物药理作用的研究进展[J].西北植物学报,2003,23(12):2241-2247.
[7]唐津忠,鲁晓翔,陈瑞芳.金莲花中黄酮类化合物的提取及其抗氧化性研究[J].食品科学,2003,24(6):88-91.
[8]张淑丽,杨世海,张海弢,等.水飞蓟有效成分及其提取方法研究进展[J].人参研究,2012,24(4):51-54.
[9]KATIYAR S K,KORMAN N J,MUKHTAR H,et al. Protective effects of silymarin against photocarcinogenesis in a mouse skin model[J].Journal of the National Cancer Institute,1997,89:556-566.
[10]FERENCIP,DRAGOSICSB.Randomized controlled trial of silymarin treatment in patients with cirrhosis of liver[J].Journal of Hepatology,1989,9:105-113.
[11]TAGER M,DIETZMANN J,THIEL U,et al.Restoration of the cellular thiol status of peritoneal macrophages from CAPD patients by the flavonoids silibinin and silymarin.Free Radical Research,2001,34:137-151.
[12]王敏,张宇,张宏莲,等.水飞蓟茎叶化学成分研究[J].黑龙江医药科学,2010,33(1):78-79.
[13]乔孟,屈晓清,丁之恩.响应面法优化超声波辅助提取湖北海棠叶中总黄酮工艺[J].食品科学,2013,34(2):143-147.
[14]邓丹雯,杨佩,吕建壵,等.梅素提取工艺优化[J].食品与发酵工业,2013(3):210-215.
Optim ization extraction of total flavonoids from stem s of Silybum marianum by response surface methodology
YU Jin-yue,SUN Jing,LIXin-hua*,QIXiao-jun,WANG Hai-na
(Food College of Shenyang Agricultural University,Shenyang 110161,China)
The flavonoids from stem s of Silybum marianum were extracted w ith ethanol,and the extraction p rocess was op tim ized by response surface methodology,four sing le factors testwere made to investigate the effects of extraction time,ethanol concentration,material-liquid ratio on total flavonoids yield.The research findings showed that the op tim ized cond itions were as follows:extraction time 50m in,extraction tem perature 61℃,ethanol concentration 40%,material-liquid ratio 1∶40.Under the cond itions,the yield of flavonoids was 4.71g/mg w ith results of a polynom ial regressionmodelwere in ag reement.
stem s of Silybum marianum;total flavonoids;response surface methodology;extraction p rocess
TS202.3
B
1002-0306(2015)06-0295-05
10.13386/j.issn1002-0306.2015.06.056
2014-06-17
于金跃(1988-),女,硕士研究生,研究方向:食品科学。
李新华(1955-),男,硕士,教授,研究方向:粮食加工与转化。
