右归丸鼠血清恢复冻融小鼠卵巢的功能
2015-10-19李启佳邓延莉
李启佳, 陆 华*, 邓延莉
(1.成都中医药大学第二附属医院,四川 成都 610041;2.成都中医药大学,四川 成都 610075)
右归丸鼠血清恢复冻融小鼠卵巢的功能
李启佳1,陆 华1*,邓延莉2
(1.成都中医药大学第二附属医院,四川成都610041;2.成都中医药大学,四川成都610075)
目的 探讨右归丸(熟地黄,附子,肉桂,山药,吴茱萸,菟丝子,鹿角胶,枸杞子,当归,盐杜仲)鼠血清对程序化冻融小鼠卵巢组织功能的影响。方法 40只6周龄ICR小鼠经孕马血清促性腺激素刺激,其卵巢经液氮中冻存2 d后复苏,将所有卵巢组织随机分为空白组、空白血清组、尿促卵泡素组及右归丸血清组。所有卵巢经特殊DMEM高糖培养基培养24 h后从左侧卵巢中取出未成熟卵母细胞,微滴法培养24 h观察并计算小鼠卵细胞体外第一极体(PB1)排出率。并通过酶联免疫吸附法检测培养基中雌二醇(E2)水平,右侧卵巢组织中小鼠成熟促进因子(MPF)、卵泡刺激素受体(FSH-R)及黄体生成激素受体(LH-R)水平。结果 卵巢组织冻融后,右归丸血清组的卵母细胞成熟率、卵巢组织中的MPF、FSH-R和LH-R的水平高于尿促卵泡素阳性组和空白组。右归丸血清组体外培养基中E2水平较空白血清组高,并显著高于空白组。结论 右归丸有可能在临床上成为一种辅助冻存卵巢组织功能恢复有效的补肾中药复方。
程序化冻融;小鼠卵巢组织;右归丸;含药血清
祖国医学认为“肾藏精”、“肾主生殖”,肾与女性生殖功能关系密切。补肾中药和方剂对女性生殖功能的调控在临床上有明显的作用。据文献报道,临床上补肾中药有促进卵泡成熟、增加卵泡数量和改善卵巢储备功能的作用[1-6]。近年实验室研究发现,含补肾中药鼠血清加入卵细胞体外培养基中,可促进小鼠未成熟卵细胞生长发育,主要是促进卵细胞核成熟,并且不增加成熟卵细胞细胞骨架的异常率[7]。并发现其作用机制与增强卵细胞成熟促进因子调节亚基Cyc1in B1的表达有关。
在临床治疗中,为保持接受化疗、放疗或对性腺实施手术患者的生育能力,需进行卵母细胞、胚胎或卵巢组织的冷冻储存。但是成熟卵细胞对温度变化敏感以及修复细胞内损伤的能力较低,且在冰晶的形成过程中会导致纺垂体损伤或减数分裂期出现异常,因此,临床很少采用卵子冷冻。胚胎的冷冻效果相对较好,但所需时间较长,会耽误患者的治疗,且只适用于那些已经结婚或同意接受供精的患者,不适于青春前期的儿童,因而对癌症患者的临床应用也有一定局限性。而将卵巢组织冷冻是将数百个不成熟卵泡保存起来,既不需要卵巢刺激,也不会耽误癌症治疗,因而在保存妇女生育能力方面具有较大潜力[8]。
但是,卵巢组织经冷冻后再复苏过程必定对生殖细胞的功能有一定损坏[9]。如上所述,补肾中药无论在体内还是体外对生殖细胞功能均有促进作用。那么,补肾中药能否帮助冷冻卵巢组织功能恢复呢?因此,本研究旨在探索右归丸鼠血清是否能够在小鼠卵巢组织冻融后的体外培养阶段对卵巢功能有影响。
1 材料
1.1实验动物及饲养环境 清洁级ICR雌性小鼠40只,分批次购于成都达硕实验动物有限公司,5周龄,体质量21~24 g,许可证号:SCXK(川2008-24)。二级实验室,常规条件(清洁无尘,空气新鲜,温度18~22℃,相对湿度50%~60%,噪音85 dB以下,氨质量浓度20mg/L。通风换气8~12次/h)适应性饲养一周。
1.2试剂 孕马血清购于宁波第二激素厂;注射用尿促性素(HMG)和注射用尿促卵泡素(FSH)购于丽珠集团丽珠制药厂;DMEM高糖培养基、RPMI 1640培养基、透明质酸酶和矿物油购于美国Sigma公司;人输卵管液(HTF)、HEPES缓冲液、卵裂液(C1eavage)和蛋白代用品(SPS)购于美国Quinn's公司;胎牛血清(FBS)和双抗购于美国Gibco公司;小鼠雌二醇(E2)、MPF、FSH-R、LH-R及肌动蛋白ELISA试剂盒、大鼠FSH、LH、雌二醇(E2)及孕酮(P)ELISA试剂盒均购于Cusabio华美生物;甲醇为色谱纯购于Honeywe11 Burdick&Jackson公司;磷酸为色谱纯购于天津市科密欧化学试剂有限公司。
1.3仪器 3111型细胞培养箱(Thermo公司);CK40型倒置显微镜(O1ympus公司);体视显微镜(O1ympus公司);Mu1tiscan spectrum酶标仪(Thermo公司);A11egra 64R型高速冷冻离心机(美国Beckman公司);KQ5200B型超声波清洗器(昆山市超声仪器有限公司);Mi11i-Q纯水仪(美国Mi11ipore公司);AB 265-5型电子天平(瑞士梅特勒-托利多公司);岛津LC2010C液相色谱系统柱温箱、紫外检测器、四元低压梯度输液泵、真空脱气机、系统控制器、SPD-M10Avp二极管阵列检测器、Shimadzu反相C18色谱柱组成(日本岛津公司)。
1.4右归丸鼠血清的制备
1.4.1血清样品前处理方法 用蛋白沉淀法进行血浆样品前处理,即取血浆150μL,加入高氯酸-甲醇液(15μL 50%高氯酸+5μL甲醇),漩涡振荡2 min,再20 000 r/min离心10 min,取上清液作为供试液待检。
1.4.2分离空白血浆样品及含药血浆样品条件
Shimadzu反相C18色谱柱(5μm,250 mm×4.6 mm),流动相A为MeOH,流动相B为0.1% H3PO4水溶液(0~28 min,10%→70%A;28~38 min,70%→100%A);体积流量1.0 mL/min,温度30℃,检测波长259 nm,进样量70μL。
1.4.3右归丸鼠血清的制备 取体质量220~250 g的SD大鼠[清洁级,6~8周龄,许可证号:SCXK(川)2004-15。饲养于清洁级动物室,温度(22±2)℃,相对湿度40%~70%,10 h/14 h明暗交替,每3 min自动换气1次,常规全价颗粒饲料喂养,自由饮水,雌雄分开饲养于不锈钢饲养笼内],雌雄兼用,随机分为两组,即正常对照组、右归丸组。试验前禁食不禁水16 h,各给药组分别一次性给予右归丸复方(5.0 g/kg),给药剂量为20 mL/kg,正常对照组给予等剂量的蒸馏水。分别于给药后30、60、90 min眼底静脉丛取血,3 000 r/min离心10 min,分离各给药组各时间点血清即得。
1.5自行配制的培养液和冻存液
1.5.1组织洗液 FBS20%(V/V)+RPMI 1640培养基,主要用于去掉卵巢组织表面多余的脂肪组织。需实验当天提前1 h配制,并预热至37℃。
1.5.2PBI培养基、平衡液、复苏液和DAP 213冻存液 配方均参考Fujio等[9]文献中提到的Whittingham[10]的配方。
1.5.3卵巢组织体外培养基 DMEM高糖培养基(含有NaHCO3,L-半胱氨酸,0.25 mo1/L HEPES),双抗(青霉素+链霉素)1%(V/V),FBS10%(V/V),HMG 100 IU/L。空白血清组在基本培养基中加入3%(V/V)空白鼠血清,FSH组在基本培养基中加入0.3 IU/mL FSH,右归丸血清组在基本培养基中加入3%(V/V)右归丸鼠血清。卵巢组织复苏当天,提前1 h将卵巢组织体外培养基预热至37℃。
2 方法
2.1小鼠分组 将40只ICR雌性小鼠随机分为4组,10只为一组,分别为空白组、空白血清组、FSH组及右归丸血清组。
2.2小鼠卵巢组织的冻存 雌鼠处死前48 h,均腹腔注射孕马血清1 mL(500 U/mL)促排卵。镊子、解剖剪、眼科镊、眼科剪常规酒精消毒准备。促排后44~48 h将雌鼠断颈处死,酒精消毒下腹部,剪开皮肤及腹膜,迅速用眼科镊钝性分离出子宫及双侧卵巢,并用眼科剪剪下双侧卵巢组织。将剪下的左右两侧卵巢组织分别放入对应侧的组织洗液(预热至37℃)中,体视镜下钝性分离卵巢表面多余的脂肪组织和结缔组织。将处理后的两侧卵巢组织分别放入对应侧的卵巢体外培养基(预热至37℃)中收集。每3~4个卵巢组织放入对应侧的缓冲液(4℃)中预处理5 min,并剪成约1 mm×2 mm×2 mm的组织块。预处理后的卵巢组织放入对应侧的冻存管中,每个冻存管中放入一个卵巢的组织块,并加入60μL缓冲液,4℃下静置15 min。再向每个冻存管中加入DAP 213冻存液120μL,每个冻存管再在0℃冰水中静置30 min。然后将冻存管放入程序降温盒(-1℃/min)中,置于-80℃冰箱中过夜。第2天将冻存管放入液氮罐中冻存2 d。
2.3小鼠卵巢组织的复苏 将冻存管从液氮罐中取出,在室温中放置30 s,然后向冻存管中加入900μL复苏液(预热至37℃)稀释,用1 mL移液管吸出冻存液及复苏液,再用眼科镊轻轻将卵巢组织夹至含有PBI培养基(预热至37℃)的60 mm皿中洗涤,最后放入体外培养基中(48孔板培养1 d,每孔400μL体外培养基,每孔一个卵巢)培养24 h。
2.4取卵 将体外培养24 h后的左侧卵巢组织转移至含有PBS(预热至37℃)的35 mm皿中洗涤,然后迅速移至HEPES微滴中(预热至37℃,35 mm皿,每个皿4个HEPES微滴并盖矿物油)。右侧卵巢组织不作处理,待用。
用1 mL空针挑破卵巢组织,体视镜下找出卵母细胞,用制好的无菌巴氏管将卵细胞转移至含有HTF微滴的35 mm皿中(提前4 h配制并预热至37℃,上面盖矿物油),15 min取一个卵巢。迅速将35 mm皿放入CO2培养箱(37℃,5%CO2,饱和湿度)中培养24 h。
2.5观察卵母细胞体外成熟情况 从培养箱中取出35 mm培养皿,放在热台上,通过倒置显微镜进行观察。如卵细胞外面有颗粒细胞包绕,用制好的无菌巴氏管反复吹打,去掉颗粒细胞后再观察,并记录各个微滴卵细胞成熟数。以卵细胞排出第一极体(PB1)作为成熟的指标,成熟率=PB1个数/总卵细胞数。
2.6测定E2及大鼠血清激素成分 将各个卵巢组织的体外培养基吸出,用小鼠E2的ELISA试剂盒测定培养基中的E2水平。
将同批次右归丸鼠血清样本、空白鼠血清样本各取出6个,用大鼠FSH、LH、E2、P的ELISA试剂盒分别进行鼠血清中FSH、LH、E2、P水平的测定。
2.7肌动蛋白(Actin)、成熟促进因子(MPF)、卵泡刺激素受体(FSH-R)及黄体生成激素受体(LH-R)的测定 将右侧卵巢组织取出,每只卵巢组织加入500μL蛋白裂解液匀浆并离心,取上清液进行成熟促进因子、卵泡刺激素受体及黄体生成激素受体和肌动蛋白(Actin)的检测。肌动蛋白作为内参,成熟促进因子、卵泡刺激素受体及黄体生成激素受体的浓度值均与肌动蛋白浓度值进行比较,所得数据分别为成熟促进因子、卵泡刺激素受体及黄体生成激素受体水平的相对值,将上述相对值进行统计分析。
各组数据均在SPSS 19.0软件包下进行统计分析。均数比较采用T检验,率的比较采用单因素方差分析和T检验,P<0.05为差异有统计学意义,P<0.01为差异有显著统计学意义。
3 结果
3.1各组卵细胞体外成熟率的比较 小鼠卵巢组织经程序化冷冻复苏后分别采用空白鼠血清、FSH和鼠右归丸含药血清处理24 h,分离出未成熟的卵细胞用微滴法比较卵细胞成熟的情况,即第一极体(BP1)出现率。空白对照组、空白血清组、FSH组和右归丸鼠血清组的PB1出现率见表1。右归丸鼠血清组第一极体(PB1)出现率与其余3组相比,P<0.05,0.01,0.01和0.01。代表图像见图1。
3.2各组培养基中E2的比较 小鼠卵巢组织经程序化冷冻复苏后分别采用空白鼠血清、FSH和鼠右归丸含药血清处理24 h。然后测定培养液中E2的量。空白对照组、空白血清组、FSH组和右归丸鼠血清组体外培养液中E2质量浓度分别为(339.5±11.8)pg/mL、(456±4.03)pg/mL、(486.05±8.95)pg/mL和(507.9±7.58)pg/mL(图2)。右归丸鼠血清组较空白血清组高(P<0.05),并显著高于空白组(P<0.01)。FSH组和空白血清组体外培养基中E2水平均显著高于空白组(P<0.01)。见图2。
表1 各组卵细胞体外成熟率的比较(±s)Tab.1 Com parison of the in vitro maturation rate of oocytes(±s)
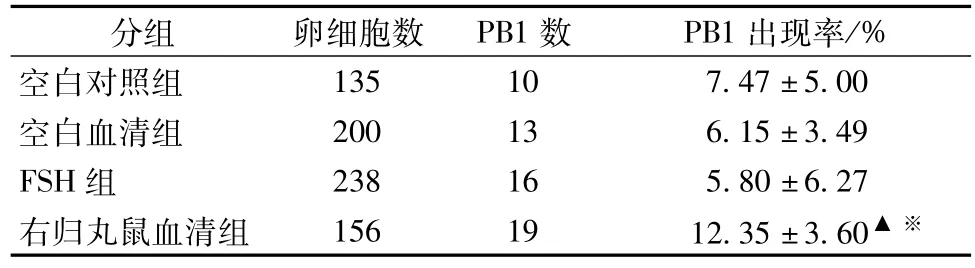
表1 各组卵细胞体外成熟率的比较(±s)Tab.1 Com parison of the in vitro maturation rate of oocytes(±s)
注:各组数据one-way variation分析,F=4.107,P=0.032。各组数据两两比较,采用T检验:与FSH组比较,▲P<0.05;与空白血清组比较,※P<0.05
分组卵细胞数PB1数PB1出现率/% 135 10 7.47±5.00空白血清组200 13 6.15±3.49 FSH组238 16 5.80±6.27右归丸鼠血清组156 19 12.35±3.60空白对照组▲※
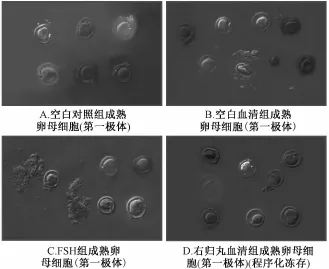
图1 各组卵细胞第一极体出现的代表性图片Fig.1 Pictures of oocytes w ith the first poIar body

图2 各组培养基中E2水平Fig.2 Concentration of estradioIin themedium
3.3 各组小鼠卵巢组织肌动蛋白(Actin)、成熟促进因子(MPF)、卵泡刺激素受体(FSH-R)及黄体生成激素受体(LH-R)的比较 小鼠卵巢组织经程序化冷冻复苏后分别采用空白鼠血清、FSH和右归丸鼠血清处理24 h,然后测定卵巢组织中肌动蛋白、成熟促进因子、卵泡刺激素受体及黄体生成激素受体水平。结果见表2。右归丸鼠血清组的卵巢组织中的成熟促进因子、卵泡刺激素受体及黄体生成激素受体的水平高于FSH组和空白组。
3.4空白鼠血清和右归丸鼠血清中卵泡刺激素、黄体生成激素、雌二醇及孕酮的水平 均采用ELISA法测定。表3显示,空白鼠血清中FSH水平最高,右归丸鼠血清中FSH水平与FSH组中水平相当。空白鼠血清中LH水平较右归丸鼠血清中LH水平高。空白鼠血清组培养基中原始E2和P水平较右归丸鼠血清组培养基中原始E2水平略低。
表2 各组小鼠卵巢组织肌动蛋白、成熟促进因子、卵泡刺激素受体及黄体生成激素受体的比较(±s)Tab.2 Comparison of reIative concentration of Actin,MPF,FSH-R and LH-R in m ice ovary tissue(±s)

表2 各组小鼠卵巢组织肌动蛋白、成熟促进因子、卵泡刺激素受体及黄体生成激素受体的比较(±s)Tab.2 Comparison of reIative concentration of Actin,MPF,FSH-R and LH-R in m ice ovary tissue(±s)
注:与FSH组比较,▲P<0.01;与空白对照组比较,※P<0.01;与空白对照组比较,★P<0.05;与空白血清组比较,*P<0.05
分组动物数/只肌动蛋白/(μmo1·mL-1)成熟促进因子/(pg·mL-1)卵泡刺激素受体/(U·L-1)黄体生成激素受体/(pg·mL-1)空白对照组10 1.30±0.06 48.70±0.61 2.85±0.04 202.35±4.26空白血清组10 2.10±0.17▲76.50±4.46▲※4.55±0.26▲※236.35±7.46▲FSH组10 4.50±0.04 50.45±1.49 2.75±0.06 197.35±5.20右归丸鼠血清组10 2.40±0.38※★83.50±1.82▲※4.20±0.22▲※294.65±6.8★※*
表3 鼠血清中卵泡刺激素(FSH)、黄体生成激素(LH)、雌二醇(E2)及孕酮(P)的水平(±s)Tab.3 Concentration of LH,FSH,E and P in rat serum(±s)

表3 鼠血清中卵泡刺激素(FSH)、黄体生成激素(LH)、雌二醇(E2)及孕酮(P)的水平(±s)Tab.3 Concentration of LH,FSH,E and P in rat serum(±s)
注:各组数据两两比较,采用两个独立样本T检验,▲P<0.01,※P<0.01,★P<0.05
血清样本数/个FSH/(IU·L-1)LH/(ng·L-1)E2/(ng·L-1)P/(μg·L-1)空白鼠血清6 5.29±0.87 13.52±2.10▲22.10±1.18※3.74±0.54★右归丸鼠血清6 4.07±4.12 1.56±0.07 9.57±0.89 5.08±1.13
4 讨论
在冻存过程中,卵巢组织中的各级卵母细胞均停留在冻存前的发育阶段,复苏之后,无论体外培养还是植入体内,均需要卵巢组织能最大限度的恢复功能,卵母细胞能够重新启动发育过程,并最终形成具有生殖功能的成熟卵母细胞,达到保留生育能力的目的。因此在卵巢组织复苏后对卵巢功能的干预非常有必要。由于体外培养只能模拟体内的条件,有研究发现在合理的体外条件下,小鼠卵巢内的卵泡有继续发育的趋势,培养2 d之内的酶活性与正常的相比无明显差异,因此对卵巢组织冻融后的体外干预时间应在2 d之内[17]。细胞冻存时,随着温度的降低,细胞内的许多酶和受体的活性均会降低,在冻存阶段干预药物影响不大。若在冻存前使用药物进行卵巢功能的干预,所需周期较长,并且对于非性腺肿瘤进行放化疗而需要保留生育能力的患者,并不需要在卵巢组织冻存之前进行药物干预,因此冻存前使用药物进行卵巢功能的干预,临床应用不是必须的。因此本研究将药物干预时间选择在复苏后,并且只干预24 h。
MPF是一种蛋白激酶,在细胞从G2期进入到M期时起着重要作用。MPF的活跃能促进卵母细胞进入减数分裂。形态上,卵母细胞生发泡的破裂,跟破裂前几小时MPF的活性增强有关。G2/M时,MPF被激活,促进G2/M的转变,可见,MPF在卵母细胞成熟过程中起着非常重要的作用,MPF的激活启动了减数分裂[18]。
实验结果显示,小鼠卵巢组织冻融后,其中MPF的表达水平,右归丸鼠血清组和空白血清组明显高于FSH组和空白组。虽然右归丸鼠血清组与空白鼠血清组之间对比无统计学意义,但前者MPF的表达水平比后者高,且更稳定(空白血清组标准差为4.46,右归丸血清组标准差为1.82)。由此推测,右归丸鼠血清可能通过增加卵巢组织中MPF的表达水平,促进卵母细胞减数分裂,进而促进冻融后体外培养过程中卵母细胞的成熟。
颗粒细胞(Granu1osa Ce11)是卵泡刺激素(Fo11ic1e-Stimu1ating Hormone,FSH)作用于卵巢的靶细胞[19]。在FSH的作用下,窦状卵泡的颗粒细胞获得黄体生成激素(Luteinizing Hormone,LH)受体。
雌激素(Estradio1,E2)的合成是由卵巢的卵泡膜细胞与颗粒细胞在FSH和LH的协同作用下完成的。卵泡膜细胞上的LH-R与LH结合后可使细胞内胆固醇形成雌激素的前身物质睾酮和雄烯二酮并进入颗粒细胞。颗粒细胞上的FSH-R与FSH与结合后可激活芳香化酶活性,将睾酮和雄烯二酮转化为雌二醇和雌酮。
实验结果显示,培养基中E2水平,右归丸鼠血清组较空白血清组高,并显著高于空白组,FSH组和空白血清组显著高于空白组;小鼠卵巢组织中FSH-R的表达水平,右归丸鼠血清组和空白血清组明显高于FSH组和空白组。LH-R的表达水平,右归丸血清组明显高于FSH组和空白组,同时也高于空白血清组,而空白血清组高于空白组。由于FSH组与右归丸鼠血清组培养基中FSH的水平基本相当,故培养基中FSH的原始水平对实验结果无必然影响。
由此推测,右归丸鼠血清组雌激素(E2)水平较其他几个实验组更高,可能与FSH-R和LH-R的表达水平明显提高有关,而FSH-R和LH-R的表达水平提高可以促进卵母细胞的成熟。至于右归丸鼠血清是否能提高冻融后卵巢组织睾酮(T)的水平,进而通过这一途径提高培养基中E2水平尚需进一步研究证实。
在小鼠卵巢组织玻璃化冻存过程中,全程添加FSH更有利于卵巢组织形态结构的保持[20]。在小鼠卵巢自体移植时添加FSH可提前恢复卵巢组织血供[21]。
本实验结果表明,虽然4次实验中FSH组取到的卵细胞数量最多,但是成熟率最低,且右归丸鼠血清组的卵母细胞成熟率明显高于该组。因此,我们认为右归丸鼠血清在本研究中对程序化冻融后的小鼠卵母细胞体外成熟的影响作用强于FSH。
目前已知,窦状卵泡期的颗粒细胞在FSH的持续作用下获得黄体生成激素(Luteinizing Hormone,LH)受体。那么可以推测,卵巢组织中FSH-R的表达水平提高后,对FSH的结合能力提高,FSH对窦状卵泡的颗粒细胞的作用能力提高,从而提高LH-R的表达水平。
此外,本研究结果还提示,LH-R的表达水平,右归丸鼠血清组明显高于FSH组和空白组,同时也高于空白血清组,空白血清组LH-R的表达水平高于空白组。
但在FSH-R表达水平的检测结果中,右归丸鼠血清组较空白血清组低,根据FSH-R和LH-R检测数据的结果分析,推测:(1)空白血清能提高卵泡中FSH-R的表达水平,从而间接提高LH-R的水平;(2)右归丸鼠血清,除了具有空白血清的相同成分以外,还含有右归丸成分,在产生与空白血清相似的作用以外,还有可能直接提高LH-R的表达水平;(3)空白血清对FSH-R的表达水平作用强于右归丸鼠血清,而右归丸鼠血清对LH-R的表达水平作用强于空白血清。
对右归丸鼠血清和空白血清中FSH、LH、E2和P水平的检测提示,FSH和LH的水平,空白血清均显著高于右归丸鼠血清,但LH-R的表达水平,右归丸鼠血清组高于空白血清组,而FSH-R的表达水平却表现为右归丸鼠血清组较空白血清组低,进一步证实了鼠血清中右归丸的成分对LH-R表达的作用强于其对FSH-R表达的作用。
中医理论认为,“肾藏精,主生殖”,《素问·上古天真论》(本文《素问》原文均引自《重广补注黄帝内经素问》,北京:中医古籍出版社,2003年)曰:“女子七岁,肾气盛,齿更发长,二七天癸至,任脉通,太冲脉盛,月事以时下,故有子”。“天癸”相当于现代医学中各种与生殖相关的激素,而肾是天癸之源。卵子属生殖之精的范畴,女性生殖系统的调节是以肾-天癸-冲任-胞宫生殖轴的功能及其相互间的平衡协调为前提。卵子发育、成熟的过程中,肾精的充盛与否与卵泡是否能发育成熟密切相关,肾阳的推动作用,能促进卵泡的发育、成熟。对女性而言,肾中阳气失于推动作用,卵泡的发育、成熟均会受到影响。从而导致不孕。
对于肾阳不足而致不孕的患者,补肾助阳是临床常用的治疗手段。补肾助阳的经典方剂之一“右归丸”,出自明代著名医家张景岳的《景岳全书·新方八阵》[11]。其功效为温补肾阳,填精益髓。主治肾阳不足,命门火衰证。中医妇科临床应用很广泛,有报道右归丸对肾阳虚型的不孕、滑胎、月经后期等症,只要辨证准确,均有较好疗效[12-13]。
前期对补肾中药的实验研究发现,含补肾中药鼠血清加入卵细胞体外培养基中,可促进小鼠未成熟卵细胞生长发育,主要是促进卵细胞核成熟,并且不增加成熟卵细胞细胞骨架的异常几率[8]。临床上,在体外受精-胚胎移植过程中,采用滋肾或温肾中药进行调理,能改善卵巢储备功能,从而使体外受精-胚胎移植女性患者能募集到足够数量的卵子[2]。补肾方药可以显著改善卵细胞成熟度[14]、增加患者的获卵数[3-4]、提高优质卵率[5-6]。表明补肾中药有促进卵泡成熟、增加卵泡数量和改善卵巢储备功能的作用。
右归丸作为温补肾阳的经典方,现代医学、药理学进行了多项研究。徐晓娟[15]等运用体外培养技术进行小鼠卵巢颗粒细胞体外培养,将右归丸水提液直接加入培养基,发现右归丸水提液高剂量组(0.18 g/mL)可明显增加颗粒细胞雌激素、孕酮分泌量,同时显著增加颗粒细胞内cAMP的水平。方云芸[16]等通过建立雄激素致排卵障碍型不孕大鼠模型,第80日龄开始给药,5周后股动脉取血,用放免法检测血中E2和T水平。发现右归丸能够增加血清中E2水平、降低血清中T的水平。因此推测右归丸有可能通过促进T转化为E2这一途径,达到促排卵和助孕安胎的功效。
在本课题中,冻存的小鼠卵巢组织均被置于-196℃的液氮中,极低的外界温度满足寒邪生成的条件,在冻存过程中,小鼠卵巢组织功能停滞,相当于中医理论中寒邪所致的机体机能下降。而卵巢组织复苏后,在卵巢组织体外培养基中加入具有温肾助阳功效的右归丸鼠血清,结果表明其能明显促进冻融后小鼠卵巢组织功能的恢复。也从另一个方面为温阳促进生殖提供了实验依据,同时说明右归丸在体内、体外均对生殖有促进作用。
但右归丸鼠血清促进冻融后小鼠卵巢组织功能恢复的更深入的机制,还需后续研究。
[1]刘伟信,黄 萍,罗孟军,等.卵巢组织的冷冻和移植研究进展[J].国外医学·生理、病理科学与临床分册,2003,23(5):525-527.
[2]张 莹,李玛建.补肾中药在辅助生殖技术中对基础FSH、E2、FSH/LH的干预初探[J].中国优生与遗传杂志,2012,20(3):115-117.
[3]连 方,滕依丽,张建伟,等.二至天癸颗粒联合体外受精-胚胎移植治疗不孕症61例临床研究[J].中医杂志,2006,47(6):439-441.
[4]连 方,滕依丽,张建伟,等.二至天癸颗粒对体外受精-胚胎移植周期人卵泡液白血病抑制因子和卵细胞质量的影响[J].中国中西医结合杂志,2007,27(11):976-979.
[5]许小凤,谈 勇,陈秀玲,等.补肾活血中药对卵巢储备功能的影响[J].江苏中医药,2007,39(2):18-21.
[6]李 东.补肾养血活血法联合体外受精-胚胎移植对妊娠率的影响[J].中医杂志,2008,49(12):1084-1086.
[7]许 娟,冯玉华,汤丽莎,等.补肾活血方对促排卵中子宫内膜发育不良的影响[J].江苏中医药,2007,39(2):18-21.
[8]段 恒.中医药在辅助生殖技术中的临床应用和实验研究[D].成都:成都中医药大学,2010.
[9]Fujio M,Rika SM,Song Siyoung,et al.Successfu1 cryopreservation of mouse ovaries by vitrification[J].Biol Reprod,2003,68(3):881-887.
[10]Whittingham D G.Embryo banks in the future of deve1opmenta1 genetics[J].Genetics,1974,78(1):395-402.
[11]邓中甲,李 冀.方剂学[M].中国中医药出版社. 2003:180-181.
[12]弋 杰,周姣慧,伍 玥,等.右归丸妇科临床应用举隅[J].甘肃中医,2010,23(11):36-37.
[13]陈丽笙,周金汤.达英-35配合右归丸加减治疗多囊卵巢综合征临床观察[J].中国中西医结合杂志,2005,25(9):794-796.
[14]宋文妍,孙莹璞,金海霞,等.成熟卵母细胞玻璃化冷冻时机及解冻方法对辅助生殖结局的影响[J].中华妇产科杂志,2010,45(8):578-582.
[15]徐晓娟,金沈锐,秦旭华,等.右归丸水提液对小鼠卵巢颗粒细胞雌激素、孕酮分泌的影响及机制[J].四川中医,2006,24(5):22-23.
[16]方云芸,黄金珠,马 洁,等.右归丸对雄激素致排卵障碍型不孕大鼠血清E2、T和IGF-1的水平影响[J].环球中医药,2010,3(3):194-197.
[17]蔡玉芳,王燕蓉,沈新生,等.小鼠卵巢组织的体外培养及形态学观察[J].宁夏医学院学报,2001,23(3):166-167.
[18]Jones K T.Turning iton and off:M-phase promoting factor duringmeiotic maturation and ferti1ization[J].Mol Hum Reprod,2004,10(1):1-5.
[19]Christiani A A,Langendonckt A V,Anu D.Surviva1of human pre-antra1 fo11ic1esafter cryopreservation ofovarian tissue,fo11icu1ar iso1ation and in vitro cu1ture in a ca1cium a1ginate matrix[J].Hum Reprod,2009,24(1):92-99.
[20]陈 杰,王燕蓉,裴秀英,等.小鼠卵巢玻璃化冻存不同时段FSH干预对Cx43表达的影响[J].宁夏医学杂志,2012,34(9):827-829.
[21]Wang Yanrong,Chang Qing,Sun Jing,etal.Effects of HMG on revascu1arization and fo11icu1ar surviva1 in heterotopic autotransp1ants ofmouse ovarian tissue[J].Reprod Biomed Online,2012,24(6):646-653.
Rats'serum containing Yougui PiIIs regains frozen-thawed mouse ovarian function
LIQi-jia1, LU Hua1*, DENG Yan-1i2
(1.The Second Affiliated Hospital of Chengdu University of Traditional Chinese Medicine,Chengdu 610041,China;2.The Clinical School of Chengdu University of Traditional Chinese Medicine,Chengdu 610072,China)
AIM To exp1ore the effects of rat serum containing Yougui Pi11s(Rehmanniae Radix praeparata,Aconiti lateralis Radix praeparata,Cinnamomi Cortex,Cinnamomi Cortex,Evodiae Fructus,Cuscutae Semen,Cervi Cornus Colla,Lycii Fructus,Angelicae sinensis Radix,Eucommiae Cortex)on the function of programmed frozen-thaw ofmouse ovarian tissue in vitro.METHODS Ovarieswere co11ected from 40 6-week-o1d ICR mice,which were stimu1ated by pregnantmare serum gonadotropin.A11ovarian tissue were cryopreserved in 1iquid nitrogen and recovered after two days.Then,the ovarieswere random1y assigned into four groups:b1ank group,b1ank serum group,fo11ic1e-stimu1ating hormone(FSH)group and Yougui Pi11s serum group.A11ovarieswere cu1tivated in specia1DMEM medium for24 hours,and immature oocyteswere removed from the 1eft-side ovaries.Fina11y,the exc1usion rates of the first po1ar body of oocytesweremeasured under amicroscope and an inverted microscope.E2(estradio1)1eve1s of themedium were assayed by an ELISA.At the same time,contents ofMPF,FSH-R and LHR of ovarian tissues in the right sidewere determined by ELISAs.RESULTS The oocytesmaturation rate and the 1eve1s of MPF,FSH-R and LH-R in the Yougui Pi11s serum group were significant1y higher than those in the FSH group and b1ank group.E21eve1s of cu1turemedium in the Yougui Pi11s serum group were higher than those of the b1ank serum group and b1ank group.CONCLUSION The present resu1ts suggest that Yougui Pi11smay be an effective formu1a to assist the function recovery of frozen-thawed ovaries in c1inica1practice.
programmed frozen-thaw;mouse ovary tissue;Yougui Pi11s;serum contained drugs
R285.5
A
1001-1528(2015)01-0021-07
10.3969/j.issn.1001-1528.2015.01.005
2014-01-15
国家重点基础研究发展计划(973计划)(2010CB530403);国家自然科学基金(81173288);四川省科技厅青年基金(2010JQ0038)
李启佳(1986—),女,硕士生,医师,从事中医药对女性生殖调控的研究。E-mai1:1qj_1etty@126.com
陆 华(1964—),女,博士,研究员,从事中医药对女性生殖调控的研究。E-mai1:kjc1h@126.com
