化瘀涤痰汤对急性硬膜下血肿模型大鼠血清的影响
2015-10-19陆松侠龙子江任振兴王成华余晓琪陈师农
陆松侠, 龙子江*, 干 磊, 任振兴, 王成华, 陈 杨, 余晓琪, 陈师农
(1.安徽中医药大学,安徽 合肥 230038;2.安徽医科大学第一附属医院中医科,安徽 合肥 230022;3.安徽省药物研究所,安徽 合肥 230022)
[药 理]
化瘀涤痰汤对急性硬膜下血肿模型大鼠血清的影响
陆松侠1,龙子江1*,干 磊2,任振兴1,王成华2,陈 杨2,余晓琪2,陈师农3
(1.安徽中医药大学,安徽合肥230038;2.安徽医科大学第一附属医院中医科,安徽合肥230022;3.安徽省药物研究所,安徽合肥230022)
目的 观察化瘀涤痰汤(水蛭、地龙、胆南星、川芎)对急性硬膜下血肿模型大鼠血清炎症因子的影响及脑组织形态改变。方法 SD大鼠采用自体血液注射法复制急性硬膜下血肿模型,将造模成功50只大鼠随机均分为模型组(等容量蒸馏水)、化瘀涤痰汤组(高、中、低剂量组)、阳性组(天丹通络胶囊),另取10只作为假手术组(只钻孔不注血)。各组按剂量灌胃给药14 d,末次给药后,采用酶联免疫吸附法(ELISA)测定各组大鼠血清TNF-α、IL-6、IL-8、IL-2水平;HE染色观察脑组织形态改变。结果 与假手术组比较,模型组大鼠血清TNF-α、IL-6、IL-8水平显著升高(P<0.01),IL-2水平显著下降(P<0.01);与模型组相比,药物治疗组大鼠血清TNF-α、IL-6、IL-8水平明显降低(P<0.05),IL-2水平上升(P<0.05)。镜下可见模型组大鼠脑组织皮质上方有少量血肿存在,血肿区下方可见炎症细胞浸润,细胞排列紊乱,间隙较大,并出现坏死现象。各用药组与模型组比较,血肿消失,炎症细胞浸润较轻,坏死细胞明显减少,间质水肿减轻;假手术组基本正常。结论 化瘀涤痰汤能通过降低TNF-α、IL-6、IL-8炎症因子水平,上调IL-2水平,抑制急性硬膜下血肿继发性脑损伤,促进大鼠硬膜下血肿的消散,发挥脑保护作用。
化瘀涤痰汤;急性硬膜下血肿;TNF-α;IL-6;IL-8;IL-2
由于多种原因导致颅内出血聚集于硬膜下腔形成的血肿称为硬膜下血肿(Subdura1 Hematoma,SDH),为神经外科常见病之一,预后差,死亡率和致残率较高[1],严重威胁着人们的生命安全。急性硬膜下血肿主要由创伤性颅脑损伤引起[2],其发生后血肿周围局部脑血流量减少,受损部位过度炎症反应参与损伤后一系列病理改变,最终会导致严重的继发性脑损伤及神经功能障碍[3]。炎症因子(TNF-α、IL-6、IL-8)是脑损伤后重要的内源性脑损害因子,参与炎症级联反应;IL-2是一种神经营养因子,对神经元损伤有预防和修复作用,因此调节炎症因子水平平衡对降低组织损伤显得尤为重要[4]。化瘀涤痰汤是安徽医科大学第一附属医院国家名老中医工作室孔昭遐教授临床长期应用治疗硬膜下血肿的经验方。该方以水蛭为君药,配伍地龙、胆南星、川芎等药,功能破血逐瘀、祛痰开窍,临床研究已证实该方能够加快血肿吸收、改善血肿引起的眩晕、肢体麻木等症状,对硬膜下血肿患者具有良好的治疗作用[5]。本实验通过观察急性硬膜下血肿模型大鼠血清炎症因子TNF-α、IL-6、IL-8、IL-2水平及脑组织形态变化,旨在探讨化瘀涤痰汤对急性硬膜下血肿(ASDH)继发性脑损伤的治疗作用及机制,为化瘀涤痰汤的临床应用提供实验依据。
1 材料
1.1实验动物 健康SD大鼠,雌雄各半,体质量(200±20)g,由安徽医科大学动物中心提供,许可证编号:SCXK(皖)2011-002。
1.2实验药物与试剂 化瘀涤痰汤:方中各药材均购买及鉴定于安徽中医药大学第一附属医院,药物经传统方法煎煮后浓缩至相应浓度保存备用。天丹通络胶囊:山东凤凰制药股份有限公司,批号1301230,临用前用蒸馏水配制成所需浓度。IL-6试剂盒(批号CK-E67489C)、IL-8试剂盒(批号CK-E87059C)、TNF-α试剂盒(批号CKE83559C)、IL-2试剂盒(批号CK-E95459C)均购自上海源叶生物技术有限公司。
1.3主要仪器 Stoe1ting脑立体定位仪(Stoe1ting公司);STRONG-204牙科钻头(Saeshin公司);RT-6000酶标仪(雷杜公司);TS-12A生物组织自动脱水机(湖北省孝感市宏业医用仪器有限公司);BM-IX生物组织包埋机(孝感市宏业医用仪器有限公司);Leica RM2016轮转式切片机(上海五相仪器仪表有限公司)。
2 方法
2.1急性硬膜下血肿(ASDH)模型制备 参照Yokobori[6]造模方法经改良后复制ASDH模型。以3.5%水合氯醛(1 mL/kg)腹腔注射麻醉大鼠后俯卧固定,常规消毒,头部剃毛后沿正中线切开,剥离骨膜,在矢状缝右侧3 mm,冠状缝后侧2 mm处开一个直径是1.0 mm的孔,从自体心脏取血,以50μL/min速度缓慢向硬膜下腔隙注射500μL,注血完成后,待血液凝固后拔除注射针。牙科粉封闭钻孔,缝合头皮,连续3 d注射青霉素防止感染。假手术组大鼠操作过程同造模组,但不注入自体血液。
2.2ASDH大鼠模型评估 动物苏醒后,参考大鼠行为学评价方法[7],对大鼠进行前肢对称试验,前肢触发试验及躯体转向试验,表现出左侧肢体活动较右侧肢体活动欠佳的大鼠视为成功的模型。随机抽取2只模型成功大鼠进行解剖,可见硬膜下皮质上方血肿(如图1)。
2.3动物分组及给药 模型复制成功大鼠随机分为模型组,化瘀涤痰汤高剂量组(生药56.52 g/kg)、中剂量组(生药28.26 g/kg)、低剂量组(生药14.13 g/kg),阳性药物组(天丹通络胶囊,0.54 g/kg),假手术组只钻孔不注血,每组10只,假手术组和模型组灌胃等容量蒸馏水,每天给药1次,连续给药14 d。

图1 ASDH模型大鼠血肿分布Fig.1 Distribution of hematoma in ASDH modeI
2.4指标检测
2.4.1大鼠血清TNF-α、IL-6、IL-8、IL-2水平的测定 末次给药1 h后,3.5%水合氯醛(1 mL/kg)腹腔注射麻醉大鼠,腹主动脉取血,3 000 r/min离心15 min,取血清,采用酶联免疫吸附法(ELISA)测定各组大鼠血清TNF-α、IL-6、IL-8、IL-2水平。检测步骤按照各试剂盒说明书依法操作。
2.4.2脑组织形态学观察 末次给药1 h后,3.5%水合氯醛(1 mL/kg)腹腔注射麻醉大鼠,用10%中性甲醛溶液内固定后,断头取脑去除小脑,置于10%中性甲醛溶液中固定1周,常规梯度脱水、石蜡包埋,切片,厚度为5μm,HE染色,观察各组大鼠脑组织形态。
2.5数据分析 采用SPSS 17.0软件进行统计学处理。数据结果以±s表示,定量资料多组间两两比较采用方差分析(方差齐采用LSD检验,方差不齐者采用Dunnett t检验)。
3 结果
3.1化瘀涤痰汤对ASDH模型大鼠血清IL-6、IL-8水平的影响 与假手术组比较,模型组大鼠血清IL-6、IL-8水平显著升高,具有显著性差异(P<0.01);与模型组比较,化瘀涤痰汤高剂量组、中剂量组、低剂量组、阳性组血清IL-6水平下降,有明显差异(P<0.05),IL-8水平显著降低,有显著性差异(P<0.01),见表1。
表1 化瘀涤痰汤对ASDH模型大鼠血清IL-6、IL-8水平的影响(±s,n=10)Tab.1 Effects of Huayu Ditan Decoction on serum IL-6,IL-8 in ASDH modeI rats(±s,n=10)
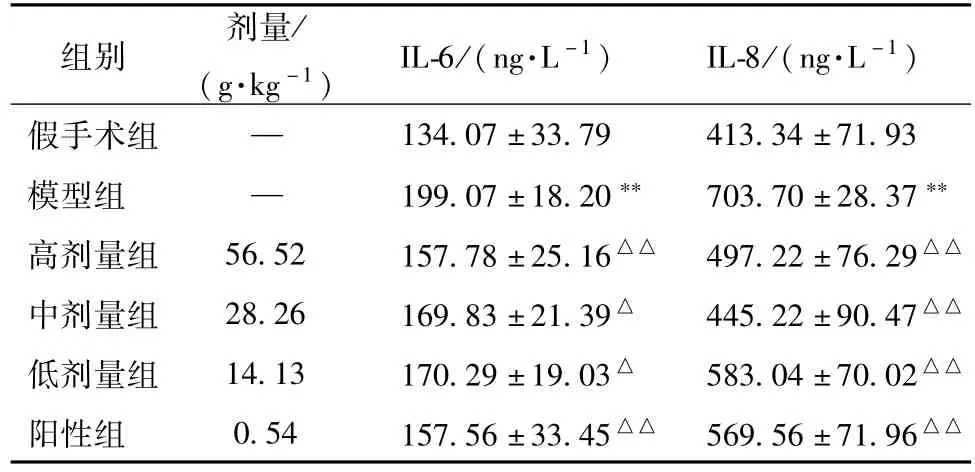
表1 化瘀涤痰汤对ASDH模型大鼠血清IL-6、IL-8水平的影响(±s,n=10)Tab.1 Effects of Huayu Ditan Decoction on serum IL-6,IL-8 in ASDH modeI rats(±s,n=10)
注:与假手术组比较,**P<0.01;与模型组比较,△△P<0.01,△P<0.05
组别剂量/(g·kg-1)IL-6/(ng·L-1)IL-8/(ng·L-1)假手术组—134.07±33.79 413.34±71.93模型组—199.07±18.20**703.70±28.37**高剂量组56.52 157.78±25.16△△497.22±76.29△△中剂量组28.26 169.83±21.39△445.22±90.47△△低剂量组14.13 170.29±19.03△583.04±70.02△△阳性组0.54 157.56±33.45△△569.56±71.96△△
3.2化瘀涤痰汤对ASDH模型大鼠血清TNF-α、IL-2水平的影响 与假手术组比较,模型组大鼠血清TNF-α水平显著上升、IL-2水平明显降低,差异均具有统计学意义(P<0.01);与模型组比较,化瘀涤痰汤高剂量组、中剂量组、低剂量组血清TNF-α水平下降,具有显著性差异(P<0.05),IL-2水平显著上升,差异具有统计学意义(P<0.05),阳性组TNF-α水平下降明显,有统计学差异(P<0.01),见图2。

图2 化瘀涤痰汤对ASDH模型大鼠血清TNF-α、IL-2的影响(±s,n=10)Fig.2 Effects of Huayu Ditan Decoction on serum TNF-α,IL-2 in ASDH modeI rats(±s,n=10)
3.3脑组织形态学观察结果 光镜下观察,假手术组可见细胞间排列紧密,核仁清晰,未见坏死灶及炎性细胞浸润(图3a)。模型组可见皮质上方有少量血肿存在,血肿区下方细胞结构紊乱,可见坏死区域,炎症细胞浸润、细胞间隙增大等(图3b)。阳性组(图3c)、化瘀涤痰汤高剂量组(图3d)、中剂量组(图3e)、低剂量组(图3f)与模型组比较血肿消失,炎症细胞浸润较轻,间质水肿减轻,坏死细胞明显减少。
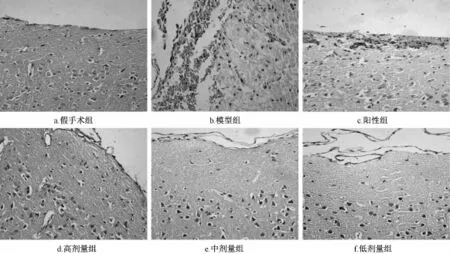
图3 化瘀涤痰汤对脑组织形态学的影响(40×10)Fig.3 Effect of Huayu Ditan Decoction on brain tissuem orphoIogy(40×10)
4 讨论
急性硬膜下血肿是由颅脑损伤引起的一种常见疾病[8]。传统医学认为外伤之后,血溢脉外,离经之血形成瘀血;而后瘀阻经脉,气血运行不畅,后聚津为湿,酿湿为痰,同时瘀血郁而化热,热盛伤津,亦会炼津为痰,因此痰瘀互结是导致硬膜下血肿发病的主要原因。本实验采用自体血液注入硬膜下腔,形成瘀血,瘀阻经络,与硬膜下血肿中医发病机制相似,同时该造模方法形成的血肿位置恒定,操作方法相对简单,且动物死亡率低,故可通过此动物模型探讨化瘀涤痰汤对急性硬膜下血肿的干预作用。
急性硬膜下血肿引起的脑水肿及颅内压增高是一种非感染性炎症表现[9],这种炎症反应主要是由血肿压迫脑组织引起的缺血、缺氧作用引起。一般认为,炎症介质释放是脑缺血性损伤的重要机制之一[10]。细胞因子IL-6、IL-8、TNF-α、IL-2是参与机体炎症反应和一系列病理生理过程的重要介质。Vi11a等[11]研究证明,IL-8对神经组织炎性反应中性粒细胞具有趋化活性和激活作用,能促进神经组织的炎性反应,在脑损伤过程中起有害作用,降低IL-8能够减轻脑损伤。此外,颅脑损伤后IL-6、TNF-α表达明显增加,能够介导细胞之间的直接毒性作用或相互作用,增加血脑屏障的通透性,并导致钙离子通道开放,使钙离子内流,引起细胞水肿、在脑继发性损伤中起着重要作用。星形细胞在应急状态下能产生IL-6、TNF-α,在损伤发生后IL-6水平上升,并且损伤程度越重,血液中IL-6的水平越高,血液IL-6水平可作为反映损伤程度的指标之一[12]。TNF-α来源于脑内神经胶质细胞及外周循环中的单核巨噬细胞、中性粒细胞等细胞,脑创伤病人脑脊液及血液中TNF-α水平都会增高。此外,TNF-α是体外循环炎性反应网络的关键环节,它能诱导IL-6、IL-8等细胞因子的生成,增加细胞黏附因子的表达及吞噬细胞的活性,促进中性粒细胞活化及脱颗粒,使炎症反应呈级联放大模式,最终形成全身炎症反应[13]。IL-2是由Th11细胞产生的一类细胞因子,在免疫调节中起着重要的作用。当脑组织受到缺血、缺氧刺激后,神经-免疫-内分泌调节功能受到影响,使免疫反应受到抑制,IL-2生成减少,抑制神经功能的恢复。脑缺血不仅可以诱导神经系统的炎症反应,还可以引起外周系统的炎症反应,因此血液中炎症因子水平可作为评价脑组织继发性炎症反应强弱的指标[14]。
本实验结果可见,急性硬膜下血肿模型大鼠血清TNF-α、IL-6、IL-8水平明显上升,IL-2水平明显下降,应用化瘀涤痰汤治疗后能够明显降低血清TNF-α、IL-6、IL-8水平,升高IL-2水平,减轻炎症反应,降低脑损伤。HE染色显示,模型组大鼠脑血肿区细胞结构紊乱,可见梗死区域,血管周围及细胞间隙增大,脑水肿严重。应用化瘀涤痰汤干预后,血肿区组织结构紊乱及间质水肿和细胞变性程度明显减轻,坏死细胞明显减少,炎症细胞浸润程度明显抑制,细胞形态较模型组明显改善。综上所述,化瘀涤痰汤通过抑制细胞因子TNF-α、IL-6、IL-8水平,升高IL-2水平,能够减轻炎症反应,促进神经功能恢复,对急性硬膜下血肿模型大鼠有明显的治疗作用,为临床治疗硬膜下血肿提供实验依据。
[1]Danie1J,Chrysostomos PM D,Axe1Heimann D V M,et al. Effects of hypertonic/hyperoncotic treatmentand surgica1evacuation after acute subdura1hematoma in rats[J].Crit CareMed,2008,36(2):543-549.
[2]吴称平,杨秋荣,孙志宏.双侧慢性硬膜下血肿与单侧慢性硬膜下血肿的临床比较[J].现代生物学进展,2010,10(5):887-889.
[3]Ichiro N,Daisuke W,Kentaro T,et al.The neuroprotective effect of diazoxide ismediated bymitochondria1ATP-dependent potassium channe1s in a ratmode1 of acute subdura1 hematoma[J].JClini Neurosci,2013,20(1):144-147.
[4]张卫民,雷 鹏,贺建勋.N-乙酰半胱氨酸对大鼠颅脑损伤后炎性因子表达的影响[J].中华神经外科疾病研究杂志,2009,8(1):43-46.
[5]王成华,干 磊,余晓琪,等.化瘀涤痰方治疗慢性硬膜下血肿临床研究[J].新中医,2012,44(11):39-41.
[6]Yokobori S,Gajave11i S,Monde11o S,et al.Neuroprotective effect of preoperative1y induced mi1d hypothermia as determined by biomarkers and histopatho1ogica1estimation in a rat subdura1 hematoma decompression mode1[J].JNeurosurg,2013,118(2):370-380.
[7]Hua Y,Scha11ert T,Keep R F,et al.Behaviora1tests after intracerebra1hemorrhage in the rat[J].Stroke,2002,33(10):2478-2484.
[8]黄敏东,杨应明.家兔急性脑损伤合并硬膜下血肿模型的建立[J].实用医学杂志,2007,23(6):813-814.
[9]吴 刚,赖润龙,杨峰涛,等.泊洛沙姆188对大鼠急性硬膜下血肿模型脑组织含水量、NF-κB基因表达的影响[J].中国微侵袭神经外科杂志,2010,15(2):80-82.
[10]李俐涛,张祥建,尹 静,等.氧化苦参碱对局灶性脑缺血大鼠脑组织炎症信号TLR4表达的影响[J].中成药,2009,31(2):194-198.
[11]Vi11a P,Triu1zi S,Cava1ieri B,et al.The inter1eukin-8(IL-8/ CXCL8)receptor inhibitor reparixin improves neuro1ogica1deficits and reduces 1ong-term inf1ammation in permanent and transient cerebra1ischemia in rats[J].MolMed,2007,13(3-4):125-133.
[12]胡德志,江澄川,乔 健,等.手术性急性脑损伤血清IL-6、神经元特异性烯醇化酶水平的监测及意义[J].中华急诊医学杂志,2002,11(2):86-88.
[13]何庚戌,李伯君,要 彤.全身炎症反应在体外循环术后脑损伤中的作用[J].临床外科杂志,2004,12(S1):38-40.
[14]马 鑫,陈贺愈,夏伟梁.炎性反应在缺血性脑损伤中的作用和机制[J].中国现代神经疾病杂志,2011,11(2):160-164.
InfIuence of Huayu Ditan Decoction on serum in ratsw ith acute subduraIhematoma
LU Song-xia1, LONG Zi-jiang1*, GAN Lei2, REN Zhen-xing1, WANG Cheng-hua2, CHEN Yang2, YU Xiao-qi2, CHEN Shi-nong3
(1.Anhui University of Traditional ChineseMedicine,Hefei230038,China;2.Department of Traditional ChineseMedicine,First Affiliated Hospital of Anhui Medical University,Hefei230022,China;3.Anhui Institute of Medicine,Hefei230022,China)
AIM To observe the effects of Huayu Ditan Decoction(Hirudo,Pheretima,Arisaema cum bile,Chuanxiong Rhizoma)on serum 1eve1s of inf1ammatory cytokine IL-6,IL-8,TNF-α,and IL-2,and change of brain tissuemorpho1ogy in ratswith acute subdura1hematoma.METHODS Ratmode1 for acute subdura1hematoma was induced by auto1ogous injection of b1ood into SD rats.Fifty rats with acute subdura1hematoma were random1y divided equa11y into themode1group(given disti11ed water),the high,medium and 1ow dose Huayu Ditan Decoction group,the contro1group(Tiandan Tong1uo Capsu1es).Another ten ratswere served as the sham operation group(given disti11ed water),which were on1y dri11ed but not injected the b1ood.After the 1ast one of successive administration for14 days,the serum 1eve1s of inf1ammatory cytokine IL-6,IL-8,TNF-α,and IL-2 weremeasured by ELISA,brain tissuemorpho1ogy wasmeasured by HE staining.RESULTS Compared with the sham operation group,the 1eve1s of serum TNF-α,IL-6,IL-8 went significant1y up(P<0.01)and IL-2 1eve1went down(P<0.01)in themode1group.As compared with themode1 group,serum 1eve1s of TNF-α,IL-6,IL-8 in the drug therapy groups decreased significant1y(P<0.05),IL-2 1eve1 increased(P<0.05).In themode1group,a sma11amountof hematoma existed at the top of cerebra1cortex.Inf1ammatory ce11s infi1trated,ce11s arranged irregu-1ar1y,ce11s gap increased and therewere areas of necrosis at the bottom of the hematoma.Compared with themode1 group,hematoma appeared to subside in each treatmentgroup and their inf1ammatory ce11infi1tration,necrotic ce11s and edema decreased.Rats in sham operation group were norma1.CONCLUSION Huayu Ditan Decoction can inhibit the secondary brain injury of acute subdura1hematoma and promote the absorption of hematoma in rats.The mechanism is possib1y re1ated to the reduction of TNF-α,IL-6,IL-8 1eve1s and the increase of the 1eve1of IL-2,which p1ays a ro1e in protecting cerebra1 tissue.
Huayu Ditan Decoction;acute subdura1hematoma;TNF-α;IL-6;IL-8;IL-2
R285.5
A
1001-1528(2015)01-0001-05
10.3969/j.issn.1001-1528.2015.01.001
2014-01-15
安徽省研究生”千人计划“项目资助(2013)
陆松侠(1989—),女,硕士生,主要从事中药对心脑血管疾病防治作用的研究。Te1:15156871761,E-mai1:1usongxia5678 @126.com
龙子江(1957—),男,教授,主要从事中药对心脑血管疾病防治作用的研究。Te1:(0551)5169216,E-mai1:1zjy1s@ 163.com
