食品中亚致死损伤单增李斯特菌的研究进展
2015-10-18宣晓婷刘东红
宣晓婷,丁 甜*,刘东红
(浙江大学生物系统工程与食品科学学院,浙江 杭州 310058)
食品中亚致死损伤单增李斯特菌的研究进展
宣晓婷,丁 甜*,刘东红
(浙江大学生物系统工程与食品科学学院,浙江 杭州 310058)
单核细胞增生李斯特菌(Listeria monocytogenes)是一类人畜共患的食源性致病菌。食品加工过程中所产生的亚致死损伤单增李斯特菌是不容忽视的,在适宜的环境下,损伤菌会恢复至正常状态继续生长,对消费者的健康造成威胁,因此亚致死损伤菌的存在是食品安全的一大隐患。探究亚致死损伤菌的检测、修复是目前研究的热点之一,本文将综合相关研究对近年来食品中亚致死损伤单增李斯特菌的检测、修复方法以及发展趋势进行综述。
亚致死损伤;单核细胞增生李斯特菌;检测;修复;发展趋势
单核细胞增生李斯特菌(Listeria monocytogenes)简称“单增李斯特菌”,是一种广泛分布于自然界的人畜共患食源性致病菌,它能引起人、畜的李斯特菌病,感染后主要表现为败血症、脑膜炎和单核细胞增多,特别对孕妇、新生儿、老年人和免疫缺陷病人危害严重。2011年美国暴发了10多年来最严重的一起食源性疾病事件,由于食用污染了单增李斯特菌的香瓜导致21 人死亡,其中受感染的人群中多为老年人、怀孕妇女以及免疫功能低下者。2012年8月美国再现甜瓜染菌事件,造成2 人死亡。世界卫生组织(World Health Organization,WHO)将其列为20世纪90年代食品中四大致病菌之一[1]。
研究表明,在食品加工过程中,通过加热、冷冻、干燥、辐射、高静水压、发酵、加抗菌药物等方法处理食品后,食源性致病菌会出现3 种生理状态不同的细胞:正常的细胞、处于亚致死损伤状态的细胞和死亡细胞[2]。1951年Hartsell[3]最先将亚致死菌定义为在营养丰富的非选择性培养基上能生长,而选择性培养基上无法产生可见菌落的微生物存在状态。而细菌在非选择性培养基和选择性培养基上的菌落数的差值,即为该菌处于亚致死状态的数目[4]。在实际的生产与流通过程中,由于技术上的缺陷、人为的操作不当以及杀菌处理对产品质量的影响等因素,产品中的致病菌并未被完全杀死而是处于亚致死状态,普通检测致病菌的方法并不能检测出亚致死状态致病菌,而在产品贮藏、运输等过程中,一旦处于亚致死状态的致病菌处于适宜的环境条件下,亚致死菌能够自我修复并且恢复到正常的状态,因此处于亚致死损伤状态的细菌可能导致食品二次污染,一旦进入人体便会存在潜在危害,给食品安全保障带来严重隐患。
目前亚致死损伤菌的检测成为了食品安全检测的热点和难点之一[5],本文综合大量的文献数据,对其进行归整和分析,对亚致死损伤单增李斯特菌的检测和修复方法进行研究,并对检测和修复技术的发展趋势作一综述。
1 食品中的处理方式可以引起单增李斯特菌亚致死损伤
在食品工业中,为了防止食品腐败变质、延长食品货架期,食品的处理方式可以分为热处理和非热处理。就目前而言,在所有可利用的消毒灭菌方法中,热力杀菌是一种应用最早、效果最可靠、使用最广泛的方法,它可以杀灭大部分的微生物,包括细菌繁殖体、真菌、原虫、藻类、病毒和抵抗力更强的细菌芽孢,热力灭菌在工业消毒灭菌上深受重视。对于单增李斯特菌,Busch等[6]将其在56 ℃条件下处理50 min后,损伤率达到98.1%~99.9%,热力杀菌对单增李斯特菌有较好的杀菌效果。
随着生活水平的不断提升,人们对食品的安全、营养、新鲜等要求越来越高,这就推动了非热加工技术的研究开发[7]。目前新型的食品非热杀菌技术有辐射、超临界CO2系统[8]、高压静电场、脉冲电场(pulsed electric fields,PEF)、超声波、电位水[9]、振荡磁场(oscillating magnetic fields,OFM)等[10],或将这些技术与一些化学试剂相结合[11]。不同的加工处理方法对单增李斯特菌的影响不同,国内外很多学者就加工处理方法和环境胁迫对单增李斯特菌的影响进行了研究[12]。Vicky等[13]研究致使单增李斯特菌、空肠弯曲菌和大肠杆菌O157亚致死的方法,研究发现单增李斯特菌对氧化应激更为敏感。Zhao Wei等[14]进行了脉冲电场(PEF)导致牛奶中金黄色葡萄球菌、单增李斯特菌、大肠杆菌致死的研究,同时比较了脉冲电场强度对3 种菌的致损伤情况。当脉冲电场强度为30 kV/cm、处理时间为200 ☒s时,单增李斯特菌亚致死损伤率达到最大值43.64%;而大肠杆菌和金黄色葡萄球菌在脉冲电场强度为25 kV/cm、处理时间为200 ☒s时亚致死损伤率达到最大值分别为40.74%和36.51%,之后随着脉冲电场强度的增加,亚致死损伤率降低,实验发现单增李斯特菌对PEF的抵抗能力是最强的。其中当脉冲电场强度为30 kV/cm、处理时间为200 ☒s时,单增李斯特菌的亚致死率始终高于金黄色葡萄球菌和大肠杆菌,研究发现,单增李斯特菌对于恶劣的环境条件有更强的抵抗力,但更多的是以亚致死损伤菌的状态生存,一旦环境条件适宜,亚致死状态会自动修复到正常状态,对食品安全产生了极大的威胁。
2 食品中单增李斯特菌亚致死检测与修复
由于亚致死损伤单增李斯特菌的修复、再生长导致的食品安全问题更为严重,越来越多的研究者对亚致死损伤单增李斯特菌的检测方法、修复再生长机理进行研究。
2.1食品中单增李斯特菌亚致死检测方法
由于食品中可能存在亚致死状态的单增李斯特菌,对于新型的检测技术就要求能够同时检出活性细胞和损伤细胞。同时,大多数食品中单增李斯特菌的存在都是很低水平的,因此在检测之前需要对食品中单增李斯特菌进行选择性增菌培养。然而,目前常用的作为选择性培养基的成分对损伤致病菌的修复和生长会产生抑制作用,因此在检测之前,必须经过非选择性培养基修复后再进行选择性增菌[15]。非选择性和选择性培养法是检测亚致死菌最常用的方法。非选择性培养基既可以让非目的菌生长,又可以使损伤的目的菌修复,而选择性培养基只可以使非目的菌生长,细菌在非选择性培养基和选择性培养基上的菌落数的差值,即为该菌处于亚致死状态的数目。检测亚致死单增李斯特菌大多采用胰酪胨大豆酵母浸膏琼脂(trypticase soy-yeast extract agar,TSA-YE)作为非选择性培养基,PALCAM琼脂作为选择性培养基[4]。单增李斯特菌的死亡率和亚致死损伤率是通过非选择性培养基TSA-YE和选择性培养基PALCAM的计数结果的差值来计算[16],计算公式如下所示。

在食品加工过程中,高温、冷冻、辐射、盐分、抗生素、消毒剂等处理都有可能导致单增李斯特菌亚致死。Vicky[13]和Zhao Wei[14]等研究不同处理方式对单增李斯特菌所造成影响的差异,所采用的检测方法都是非选择性和选择性培养法(表1)。在7 种应激状态中,加酸、饥饿、过氧化和脉冲电场的应激都能产生较大的亚致死损伤率,其中加酸的处理方式导致单增李斯特菌亚致死损伤率达到最大值。碱和氯同样会影响对单增李斯特菌的热杀菌效果,Taormina等[17]研究发现单增李斯特菌在56 ℃、pH 12的胰蛋白磷酸肉汤中培养时其热阻性比在pH 7.3时的热阻性要强,实验说明碱能提高单增李斯特菌的热阻性,碱能中和致病菌所产生的酸,以防止pH值降低。单增李斯特菌在56 ℃、pH 7、含2.0 mg/L或2.4 mg/L游离氯的磷酸钾缓冲液中菌落数减少1.3 (lg(CFU/mL)),而在56 ℃、pH 7、含有6 mg/L的游离氯的磷酸钾缓冲液中菌落数减少4.02 (lg(CFU/mL)),由于氯对细菌会造成部分损伤,导致单增李斯特菌对热更为敏感。
Rowan等[18]采用氧化还原荧光探针5-氰基-2,3-二甲苯基四氮唑氯化物(5-cyano-2,3-ditolyl tetrazolium chloride,CTC)对单增李斯特菌的呼吸细胞进行标记,对单增李斯特菌进行脉冲等离子体气体放电(pulsed plasma gas discharge,PPGD)处理,导致单增李斯特菌亚致死率为46.8%。研究发现单增李斯特菌对PPGD有更强的抵抗力,但其亚致死比例相比于大肠杆菌、金黄色葡萄球菌和沙门氏菌却是最高的,此现象与Zhao Wei等[14]研究脉冲电场(PEF)对单增李斯特菌的亚致死的规律相同。Al-Qadiri等[19]采用傅里叶变换红外光谱(fourier translation infrared spectroscopy,FT-IR)研究单增李斯特菌和血清型鼠伤寒沙门氏菌的热损伤,此方法快速高效地检测并区分出健康、亚致死和死亡致病菌。

表1 不同检测方法检测不同处理方式导致单增李斯特菌亚致死程度[13-14,17]Table1 Percentage of sub-lethal injury in L. monocytogenes subjected to different stresses[13-14,17]
此外,聚合酶链式反应(polymerase chain reaction,PCR)技术近年来也被广泛地运用到食源性致病菌快速检测中。常规PCR及其衍生出来的许多PCR技术广泛地应用到单增李斯特菌检测中。由于实际样品中单增李斯特菌数量很少,这给检测带来了很大的难度,增菌虽然可以提高灵敏度,但在一定程度上稀释了样品中对PCR产生抑制作用的物质,其增加了检测时间,很难满足快速检测的要求[20]。一种新型PCR技术——实时荧光PCR技术因其具有敏感度高、特异性强等优点而被广泛应用到微生物检测中,索标等[21]研究食品中热损伤沙门氏菌选择性增菌及实时荧光聚合酶链式反应检测中,基于选择性增菌培养液SEL建立一种实时荧光聚合酶链式反应检测技术。SEL是Kim等[22]开发出来的用于沙门氏菌、大肠杆菌O157:H7以及单增李斯特菌的选择性增菌培养液,但目前对该培养基修复并增菌培养损伤致病菌的能力尚不清楚。将SEL用于亚致死单增李斯特菌修复,进而可以采用实时荧光PCR检测。
2.2食品中单增李斯特菌亚致死修复技术
研究表明,单增李斯特菌的亚致死损伤过程是可逆的,受损单增李斯特菌在进行繁殖之前必须先经过修复过程。对于亚致死菌的修复,存在经典的修复理论[4],包括:1)损伤菌在适当的温度和培养基条件下能很快得到修复;2)修复过程发生在细菌繁殖之前,修复时间通常为1~6 h;3)完全修复的细菌对相应的选择性添加物质反应正常;4)处理方式不同,所需的最优温度和修复时间不同;有研究认为20 ℃是超高压损伤的单增李斯特菌的最佳修复温度,而一般研究菌体修复时多数采用37 ℃,修复的具体时间的长度是与损伤程度、菌种类型和损伤类型相关的,超高压处理方法降低了亚致死单增李斯特菌的最佳修复温度。
对于修复过程需要确定以下三方面:修复法的选择、修复温度的选择和修复时间的选择。第一,目前亚致死菌的修复法主要有两种方法:固体修复法和液体修复法。常用的固体修复法有:滤膜法、表面覆盖法、双层琼脂培养法、薄层琼脂覆盖法[23-27]。亚致死单增李斯特菌最为典型的固体修复法是双层薄层平板法,该方法同样也被应用到了许多其他致病菌的修复中,如大肠杆菌O157:H7、沙门氏菌等。固体修复法的优点是可以减少因亚致死菌的繁殖而造成的计数误差,更加准确判断修复时间。但是固体修复法也存在缺点,操作较为繁琐,倾倒上层培养基时会对亚致死单增李斯特菌造成二次损伤,甚至导致其死亡,且该方法的连续性不强,不适用于连续的污染分析。而液体修复法相比较操作较为简单,不会对单增李斯特菌造成二次损伤,且液体修复后可进行连续的后续处理,更为适合实际检验工作[4]。
第二,亚致死菌常用的修复温度为25、37 ℃,亚致死单增李斯特菌修复温度一般定为37 ℃。从酶活力角度来看,37 ℃条件下过氧化酶、超氧化酶、热休克蛋白等细胞保护酶类的活力较高,有研究表明,在培养基中添加过氧化氢酶可以提高热损伤菌的修复率,过氧化氢酶等具有帮助蛋白装配、跨膜、转运、清除毒性基团和变性蛋白的清除等功能,可以提高热损伤菌修复的能力[28]。第三,修复时间的确定标准是在选择性培养基与非选择性培养基上的菌落数接近或同时增加,则表示亚致死菌达到完全修复,此段时间为修复时间。修复时间过短,易造成漏检或假阴性,修复时间过长,会由于大量繁殖而导致数值过大。修复时间过短或过长,都不利于正确反映热加工食品的卫生状况。
目前常采用增菌培养基对亚致死菌进行修复,BPW、TSB-YE、UPB、SEL[22]、SSL[29]、NB、蛋白胨等都可以作为亚致死单增李斯特菌的增菌培养基[4]。在修复过程中,一些物质的添加会影响受损细胞修复速度。段学辉等[30]研究发现氯化镁、丙酮酸钠及吐温-80可以使亚致死菌体在选择性培养基上得到不同程度地修复。吐温-80作为液体表面活性剂,可修复细胞质膜的损伤,氯化镁的添加补充了流失的镁离子,丙酮酸钠具有一定的还原性,能分解代谢过程中产生的副产物H2O2,从而解除H2O2的毒害作用。研究发现,Mg2+、Fe2+、Ca2+、Mn2+、酵母浸膏、丙酮酸盐、过氧化氢酶、乳糖、蔗糖、果糖、半乳糖、麦芽糖、甘露糖都有助于热损伤单增李斯特菌的修复、再生长(表2)。由表中可以发现,向TSB培养基中加入0.6 g/100 mL酵母浸膏后,可以大大提高亚致死单增李斯特菌的修复效果。因此,在开发加快亚致死菌修复速度的方法过程中,需要将这些添加物考虑在内。
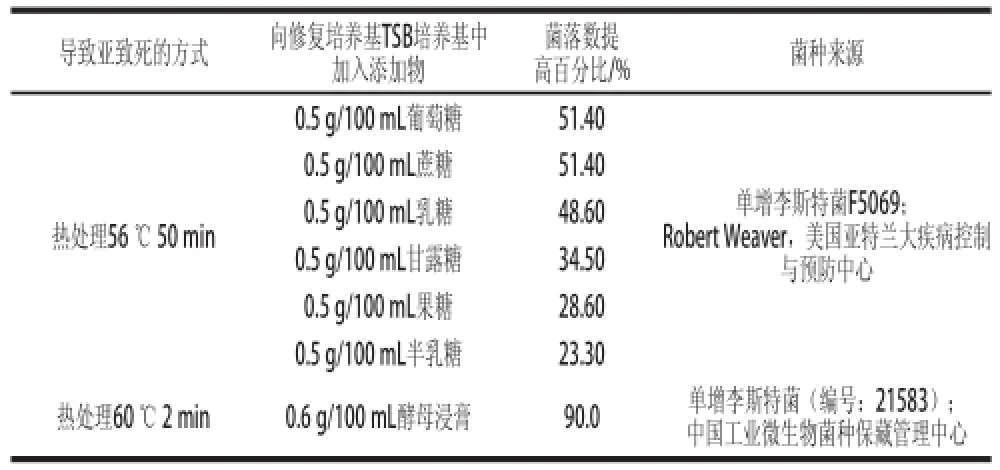
表2 影响亚致死单增李斯特菌修复的添加物[4-6]Table2 Effects of additives on the self-repair of sub-lethal injury in L. monocytogenes[4-6]
3 食品中单增李斯特菌亚致死检测与修复技术的发展趋势
虽然已经发展了诸多的单增李斯特菌亚致死的检测方法和修复技术,这些方法都有各自的优点、缺点以及适用的对象和环境。但这些方法仍然面临食品本身性质与检测要求的挑战,因此,为了保障食品安全性,未来还需要加大对单增李斯特菌快速检测技术研究,开发更准确、更简单快速的检测方法和修复技术。
随着现代免疫学和分子生物学理论和技术的不断发展,免疫磁珠分离法[29]、酶免疫测定等免疫学技术、荧光探针技术[18]和PCR技术因其特异性强、敏感性高、操作简单快速等优点而广泛应用于食品致病菌的检测中,目前也有部分技术逐渐应用于检测亚致死状态的食品致病菌。在基于这些检测技术之前,采用合适的方法对亚致死单增李斯特菌进行修复,才能有效地检测到处于亚致死状态的单增李斯特菌,而修复过程中,大多采用选择性增菌培养基来满足不同细胞修复过程中所需要的营养。但更多的时候不仅仅只是对亚致死单增李斯特菌进行检测,可能存在其他处于亚致死状态的致病菌,当要检测多种亚致死致病菌时,可能需要分别进行菌体选择性增菌。所以有研究开发能同时对多种致病菌增菌的培养基,目前报道的共增菌培养基有NB、蛋白胨、SSL[31]、SEL[22]等。Kawasaki等[32]开发出一种No.17增菌液,可以用于食品中沙门氏菌、单增李斯特菌以及大肠埃希氏菌O157:H7同时非选择性增菌培养,现在也已经应用于多重检测平台的开发。王虎虎等[4]以BPW、TSB-YE、UPB为备选共增菌介质对热损伤沙门氏菌、单增李斯特菌、大肠杆菌O157:H7进行修复。实验结果显示TSB-YE培养基对热损伤沙门氏菌、单增李斯特菌、大肠杆菌O157:H7的修复效果最好,且对前两种菌的修复时间为2 h,对后一种菌的修复时间为4 h。了解能够真正在一个检查平台中完成多种亚致死食源性致病菌的同时检测,并开发能同时增菌培养多种亚致死目的致病菌的培养液是亚致死致病菌检测的发展趋势。
4 结 语
食品中亚致死单增李斯特菌给食品安全带来严重隐患,人们必须对此给予足够的重视。由于亚致死单增李斯特菌对选择性培养基敏感,因此很容易造成检测的假阴性结果。在食品安全检测过程中,通过对亚致死单增李斯特菌进行修复,可以降低假阴性结果的出现,提高检测的灵敏度。而在修复过程中需要考虑修复法、修复温度、修复时间以及添加物质对修复程度的影响。随着分子生物学的不断发展,PCR反应体系中加入扩增内标技术正逐渐成为学者们的研究重点,食品中多种致病菌共修复增菌技术在食品安全检测中也具有一定的应用前景。
[1] 韩斌, 刘战民, 高海燕, 等. 单核细胞增生李斯特菌的检测技术[J].中国生物工程杂志, 2008, 28(6): 125-128.
[2] WU V C H. A review of microbial injury and recovery methods in food[J]. Food Microbiology, 2008, 25(6): 735-744.
[3] HARTSELL S E. The longevity and behavior of pathogenic bacteria in frozen foods: the influence of plating media[J]. American Journal of Public Health and the Nations Health, 1951, 41(9): 1072-1077.
[4] 王虎虎, 董洋, 闫振国, 等. 冰鲜鸡肉中3种主要致病菌的共修复-增菌条件研究[J]. 食品科学, 2012, 33(9): 182-187.
[5] SHINTANI H. Importance of considering injured microorganisms in sterilization validation[J]. Bioc ontrol Science, 2006, 11(3): 91-106.
[6] BUSCH S V, DONNELLY C W. Development of a repair-enrichment broth for resuscitation of heat-injured Listeria monocytogenes and Listeria innocua[J]. Applied and Environmental Microbiology, 1992,58(1): 14-20.
[7] 宋金丽, 索标, 王娜, 等. 食品中的亚致死致病菌修复及检测技术研究进展[J]. 食品安全质量检测学报, 2013, 4(3): 841-846.
[8] YUK H G, GEVEKE D J. Nonthermal inactivation and sublethal injury of Lactobacillus plantarum in apple cider by a pilot plant scale continuous supercritical carbon dioxide system[J]. Food Microbiology,2011, 28(3): 377-383.
[9] 王军, 丁甜. 电位水在食品杀菌领域的研究进展[J]. 食品科学, 2011,32(3): 241-246.
[10] 赵伟, 杨瑞金, 张文斌, 等. 高压脉冲电场对食品中微生物、酶及组成影响的研究进展[J]. 食品与机械, 2010, 26(3): 451-454.
[11] 戚伟民, 钱平, 余坚勇, 等. 中性体系中超高压-Nisin协同作用下的细菌致死机理[J]. 微生物学报, 2011, 51(1): 35-42.
[12] PENG S, TASARA T, HUMMERJOHANN J. An overview of molecular stress response mechanisms in Escherichia coli contributing to survival of Shiga toxin-producing Escherichia coli during raw milk cheese production[J]. Journal of Food Protection, 2011, 74(5): 849-864.
[13] VICKY J, MIEKE U, ANDREJA R. Establishment of procedures provoking sub-lethal injury of Listeria monocytogenes, Campylobacter jejuni and Escherichia coli O157 to serve method performance testing[J]. International Journal of Food Microbiology, 2007, 118(3): 241-249.
[14] ZHAO Wei, YANG Ruijin, SHEN Xiaohan, et al. Lethal and sublethal injury and kinetics of Escherichia coli, Listeria monocytogenes and Staphylococcus aureus in milk by pulsed electric fields[J]. Food Control, 2013, 32(1): 6-12.
[15] NUGEN S R, BAEUMNER A J. Trends and opportunities in food pathogen detection[J]. Analytical and Bioanalytical Chemistry, 2008,391(2): 451-454.
[16] RAY B, HAWKINS S M, HACKNEY C R. Method for the detection of injured Vibrio parahaemolyticus in seafoods[J]. Applied and Environmental Microbiology, 1978, 35(6): 1121-1127.
[17] TAORMINA P J, BEUCHAT L R. Survival and heat resistance of Listeria monocytogenes after exposure to alkali and chlorine[J]. Applied and Environmental Microbiology, 2001, 67(6): 2555-2563.
[18] ROWAN N J, ESPIE S, HARROWER J, et al. Evidence of lethal and sublethal injury in food-borne bacterial pathogens exposed to highintensity pulsed-plasma gas discharges[J]. Applied Microbiology,2008, 46(1): 80-86.
[19] AL-QADIRI H M, LIN M, AL-HOLY M A. Detection of sublethal thermal injury in Salmonella enterica serotype Typhimurium and Listeria monocytogenes using fourier transform infrared (FT-IR)spectroscopy(4000 to 600 cm-1)[J]. Food Microbiology and Safety,2008, 73(2): 54-61.
[20] 徐伟, 李素芳, 刘军. PCR技术检测单核细胞增生李斯特氏菌研究进展[J]. 生物技术通报, 2008(1): 95-99.
[21] 索标, 滕要辉, 史贤明, 等. 食品中热损伤沙门氏菌选择性增菌及实时荧光聚合酶链式反应检测[J]. 食品科学, 2012, 33(10): 223-227.
[22] KIM H, BHUNIA A K. SEL, a selective enrichment broth for simultaneous growth of Salmonella enterica, Escherichia coli O157:H7, and Listeria monocytogenes[J]. Applied Environment Microbiology, 2008, 74(15): 4853-4866.
[23] ROCELLE M, CLAVERO S, BEUCHAT L R. Suitability of selective plating media for recovering heat- or freeze-stressed Escherichia coli O157:H7 from tryptic soy broth and groun beef[J]. Applied Environment Microbiology, 1995, 61(9): 3268-3273.
[24] MACKEY B M, DERRICK C M, THOMAS, J A. The recovery of sublethally injured Escherichia coli from frozen meat[J]. Journal of Applied Bacteriology, 1980, 48(2): 315-324.
[25] HARA-KUDO Y, IKEDO M, KODAKA H, et al. Selective enrichment with a resuscitation step for isolation of freeze-injured Escherichia coli O157:H7 from foods[J]. Applied Environment Microbiology, 2000,66(7): 2866-2872.
[26] KANG D H, SIRAGUSA G R. Agar underlay method for recovery of sublethally heat-injured bacteria[J]. Applied Environment Microbiology, 1999, 65(12): 5334-5337.
[27] McCARTHY J, HOLBROOK L R, STEPHENS L P. An improved direct plate method for the enumeration of stressed Escherichia coli O157:H7 from foods[J]. Journal of Food Protection, 1998, 61(3): 1093-1097.
[28] 曾庆梅, 张冬冬, 韩抒. 热损伤肠炎沙门氏菌的修复方法研究[J]. 食品科学, 2009, 30(23): 233-236.
[29] CHO I H, MAUER L, IRUDAYARAJ J. in-situ fluorescent immunomagnetic multiplex detection of foodborne pathogens in very low numbers[J]. Biosensors and Bioelectronics, 2014, 57: 143-148.
[30] 段学辉, 魏斌, 傅奇. 食品微生物检验中损伤大肠杆菌的修复研究[J].食品工业, 2011, 32(6): 89-91.
[31] 刘园园, 肖性龙, 余以刚. 一种能同时富集沙门氏菌、金黄色葡萄球菌和单增李斯特菌的培养基[J]. 微生物学报, 2009, 49(10): 1389-1396.
[32] KAWASAKI S, HORIKOSHI N, YUKIO O, et al. Multiplex PCR for simultaneous detection of Salmonella spp., Listeria monocytogenes,and Escherichia coli O157:H7 in meat samples[J]. Journal of Food Protection, 2005, 68(3): 551-556.
Progress in Understanding Sub-lethal Injury of Listeria monocytogenes in Food
XUAN Xiaoting, DING Tian*, LIU Donghong
(College of Biosystems Engineering and Food Science, Zhejiang University, Hangzhou 310058, China)
Listeria monocytogenes (L. monocytogenes) is a class of zoonotic foodborne pathogens. The presence of sub-lethal injury of L. monocytogenes during food processing should not be ignored due to their self-repair capability under proper conditions. Therefore, the presence of sub-lethal injury pathogens is one of the hidden dangers of food safety. The detection and resuscitation of sub-lethal injury pathogens is one of the hottest topics of current research. By gathering and combining the related research, this paper reviews current methods for the detection and resuscitation of sub-lethally injured L. monocytogenes. Finally future trends in this area are also discussed.
sub-lethal injury; L. monocytogenes; detection; resuscitation; development trend
TS201.3
A
1002-6630(2015)03-0280-05
10.7506/spkx1002-6630-201503052
2014-01-26
浙江省自然科学基金项目(LQ13C200001);中央高校基本科研业务费专项资金项目(2013QNA6010);浙江大学优秀青年教师资助计划(紫金计划)项目
宣晓婷(1991—),女,硕士研究生,主要从事食品微生物研究。E-mail:21313057@zju.edu.cn
丁甜(1985—),男,讲师,博士,主要从事预测微生物与风险评估研究。E-mail:tding@zju.edu.cn
