甘蓝苗生长过程中主要生理生化变化
2015-10-18王志英郭丽萍李倩倩杨润强郭强晖顾振新
王志英,郭丽萍,2,李倩倩,杨润强,郭强晖,顾振新,*
(1.南京农业大学食品科技学院,江苏 南京 210095;2.青岛农业大学食品科学与工程学院,山东 青岛 266109)
甘蓝苗生长过程中主要生理生化变化
王志英1,郭丽萍1,2,李倩倩1,杨润强1,郭强晖1,顾振新1,*
(1.南京农业大学食品科技学院,江苏 南京 210095;2.青岛农业大学食品科学与工程学院,山东 青岛 266109)
以“新夏50”和“紫红钻”两种甘蓝种子为试材,研究了芽苗生长过程中芽长、呼吸速率、含水量、硫苷含量、异硫氰酸盐含量、多酚含量、抗坏血酸含量等主要的生理生化变化。结果表明:两种甘蓝在发芽过程中芽长、呼吸速率和含水量逐渐升高,“新夏50”的生长速率较“紫红钻”快;硫苷和总酚含量在种子中含量最高,随发芽时间延长均逐渐下降。“新夏50”和“紫红钻”芽苗中的异硫氰酸盐含量均在发芽1 d后达到最高水平,之后异硫氰酸盐含量缓慢下降至较低水平;而黑芥子酶活性则分别在第3天和第1天达到最高。两种甘蓝种子中未检测到抗坏血酸,随着种子发芽其含量先上升后下降。
甘蓝种子;发芽;硫苷;总酚;异硫氰酸盐;黑芥子酶;抗坏血酸
甘蓝(Brassica oleracea var. capitata)为十字花科芸薹属蔬菜中的一种,又称包菜、卷心菜,食用部位为叶球,是我国消费量最大的蔬菜之一。甘蓝营养丰富,含有较多的膳食纤维、VA原、VB1、VB2和钙、铁等营养成分。除此之外,甘蓝还含有多种抗癌化合物,抗氧化成分及促进健康的化合物,如硫代葡萄糖苷、总酚和抗坏血酸等[1-2]。
甘蓝等芸薹属蔬菜富含的硫代葡萄糖苷(glucosinolates,GLS),是一类含硫和氮的次生代谢产物,当植物组织遭受损伤引起细胞破裂时,硫苷会与黑芥子酶接触,并被水解产生异硫氰酸盐(isothiocyanates,ITCs)、腈类、硫氰酸盐等化合物[3-4]。其中,异硫氰酸盐会通过抑制Ⅰ型致癌酶和激活Ⅱ型解毒酶来发挥抗癌作用[5-7]。此外,多酚具有很强的抗氧化能力,有助于人体慢性疾病的预防[8]。抗坏血酸与人体健康密切相关,人体必须摄入一定量的抗坏血酸来保证正常的生理代谢[9]。
甘蓝中硫苷含量是白菜和芥菜的10 倍、萝卜的15倍之多[10],且与成熟的组织相比,芸薹属植物幼苗中硫苷含量更高[11]。在日本、欧美等发达国家甘蓝等芸薹属芽苗菜已被开发为一种具有抗癌保健功能的食品,近几年芸薹属芽苗菜的保健功能逐渐引起国内学者的重视,甘蓝作为我国种植最多和食用最多的芸薹属蔬菜之一,其芽苗菜的生产和利用具有广阔的前景。
目前,已有学者对西兰花和萝卜种子发芽过程中的生理生化变化进行了研究。Gu Yingjuan等[12]对西兰花芽苗的研究表明,萝卜硫苷在发芽的72 h达到最高,萝卜硫素在48 h达到最高;在种子萌发过程中伴随着物质间的转换、有机物的消耗及新物质的合成[13]。周晨光等[14]研究了萝卜芽苗生长过程中营养物质的动态变化。有研究发现甘蓝种子发芽过程中,脂肪族硫苷含量减少和吲哚族硫苷含量增加[15];且不同的植物中硫苷种类不同,其种子发芽过程中的物质代谢变化差异也较大。目前我 国关于甘蓝芽苗菜的研究报道较少,而对甘蓝苗发芽过程中生理生化代谢变化的研究也未见报道。因此,本研究以“新夏50”和“紫红钻”两种较有代表性的绿甘蓝和紫甘蓝品种为试材,探索甘蓝种子在发芽过程中硫苷含量、异硫氰酸盐含量、黑芥子酶活性、总酚和抗坏血酸等含量的变化,旨在为甘蓝芽苗及相关食品的开发提供科学依据。
1 材料与方法
1.1材料与试剂
甘蓝种子:“新夏50”和“紫红钻”,购于南京理想种苗有限公司,保存于-20 ℃备用。
DEAE Sephadex A-25树脂 北京Solarbio公司;苯甲基硫苷(glucotropaeolin)、萝卜硫素(sluforaphane)、硫酸酯酶(sulphatase)、抗坏血酸 美国Sigma公司;甲醇、乙腈(色谱级) 美国天地公司;二氯甲烷、没食子酸、Folin-酚、牛血清白蛋白(bovine serun albumin,BSA)、考马斯亮蓝(G-250)、草酸、醋酸钠 中国医药集团(上海)化学试剂公司。1.2 仪器与设备
PGX-150智能光照培养箱 宁波海曙赛福实验仪器厂;DY02九阳智能发芽机 山东九阳股份有限公司;红外线二氧化碳分析仪、Agilent 1200型高效液相色谱仪 美国安捷伦公司;UV-2802型紫外-可见分光光度计尤尼柯(上海)仪器有限公司;TDL-40B型离心机 上海安亭科学仪器厂;RW-52型旋转蒸发仪 上海亚荣生化仪器厂;Orion818型pH计 美国Orion公司。
1.3方法
1.3.1种子发芽
取4.0 g甘蓝种子,在体积分数1.5%次氯酸钠溶液中浸泡15 min后,用蒸馏水漂洗至中性,于30 ℃浸种3 h。然后,将种子均匀地铺入发芽机苗盘(直径15 cm)中发芽,苗盘底层铺有2层滤纸和4~5 mm厚经消毒处理的蛭石。种子发芽过程中每6 h喷水一次,培养室的温度控制在30 ℃,无光照,发芽时间为5 d。每24 h取样1次,芽苗用蒸馏水清洗,并吸干表面水分,称质量,设置3 次重复,用保鲜膜包好,置于液氮中速冻,待测。
1.3.2芽长测定
随机取30 株芽苗为一个样本,用游标卡尺测定其长度。
1.3.3呼吸速率测定
参照Gu Zhenxin等[12]的方法,并稍作修改。取5 g新鲜的甘蓝种子或芽苗于一封闭容器中,室温下放置1 h。然后用红外线气体分析仪,进行CO2含量的测定。每个样品重复两次,呼吸速率表示为mg CO2/(g·h)。
1.3.4黑芥子酶活性测定
参照Burow等[16]的方法。取甘蓝种子或芽苗0.5 g,用3 mL磷酸盐缓冲液(0.1 mol/L,pH 6.5)冰浴研磨成浆状,于4 ℃、10 000×g离心15 min,得上清液,即为黑芥子酶粗提液。取500 μL烯丙基硫苷(0.1 mg/L)与500 μL粗酶液混匀,在37 ℃下反应15 min,然后沸水浴10 min以终止反应。通过葡萄糖测定试剂盒测定反应液中葡萄糖含量。以每分钟每毫克蛋白质对应产生1 nmol葡萄糖量定义为1 个酶活力单位U,黑芥子酶活力最后表示为U/(min·mg pro)。
1.3.5含水量测定
含水量测定参照GB/T 5009.3—2010《食品中水分的测定》。
1.3.6硫苷含量测定
按照Wei Jia等[17]的方法并稍作修改。取甘蓝种子或芽苗0.5 g,用2 mL煮沸的75%甲醇研磨,80 ℃提取15 min后,10 000×g离心10 min,收集上清液,残渣再用2 mL煮沸的75%甲醇提取1次,合并上清液,即为硫苷粗提液。取1 mL硫苷粗提液流经DEAE SephadexTMA-25离子交换柱,排干后,用2 mL 0.02 mol/L醋酸钠溶液分两次冲洗柱子。然后加200 μL硫酸酯酶至柱子中,置于35 ℃条件下反应16 h。用3 mL去离子水洗脱,洗脱液过0.45 μm有机相膜后,用于高效液相色谱(high performance liquid chromatography,HPLC)分析。HPLC色谱条件:色谱柱为Eclipse XDB-C18column(4.6 mm×150 mm,5 μm),流动相为超纯水和20%乙腈,先用水洗脱1 min,1~21~26 min内乙腈线性梯度:0%~100%~0%;检测波长:226 nm;流速:1 mL/min;柱温:30 ℃;进样量:20 μL;以苯甲基硫苷作为内标。结果以μmol/g(以鲜质量计,下同)表示。
1.3.7异硫氰酸盐含量测定
按照Guo Qianghui等[18]的方法,取甘蓝芽苗0.5 g,用4 mL蒸馏水匀浆,在40 ℃条件下酶解3 h后,离心(10 000×g,15 min),收集上清液。取100 μL上清液,与2 mL甲醇,1.8 mL硼砂缓冲液(0.2 mol/L,pH 8.5),200 μL 1,2-苯二硫醇(7 nmol/L)混匀后,于65 ℃反应1 h后,过0.45 μm膜,进行HPLC分析,以萝卜硫素的标准曲线来计算。HPLC色谱条件:色谱柱为Eclipse XDB-C18column(4.6 mm×150 mm,5 μm);流动相为甲醇-水(70:30,V/V);流速:1.00 mL/min;进样量:20 μL;检测波长:365 nm。结果以mg/100 g(以鲜质量计,下同)表示。
1.3.8总酚含量测定
依据参考文献[19],取甘蓝种子或芽苗0.2 g,用5 mL 50%甲醇作为提取液将芽苗研磨匀浆,室温下10 000×g离心15 min,上清液即为总酚粗提液。取0.25 mL上清液与1 mL Folin-酚溶液(0.2 mol/L)、2 mL Na2CO3溶液(2 g/100 mL)混匀,在室温下黑暗中反应1.5 h后,于765 nm波长处测定吸光度。以没食子酸为标准,制定标准曲线并计算出样品中总酚含量。结果以g/100 g(以鲜质量计,下同)表示。
1.3.9抗坏血酸含量测定
抗坏血酸的测定参考Volden等[20]的方法。取0.2 g甘蓝种子或芽苗,用4 mL草酸(2 g/100 mL)研磨匀浆后,10 000 ×g离心15 min得上清液。过0.45 μm膜,HPLC测定。HPLC色谱条件:色谱柱:SB-C18色谱柱(4.6 mm×250 mm,5 μm);检测波长:254 nm;流速:0.8 mL/min;柱温:30 ℃;进样量:20 μL;流动相:0.1 g/100 mL草酸-甲醇(95:5,V/V)。结果以mg/100 g(以鲜质量计,下同)表示。
1.4数据处理与统计分析
实验数据采用统计分析软件SPSS 18.0进行统计分析,均值间比较采用Duncan’s多重比较,在0.05水平上进行显著性检验。
2 结果与分析
2.1芽长及含水量的变化

图1 两种甘蓝种子发芽过程中芽长及含水量的变化Fig.1 Changes in sprout length and water content in cabbage sprouts during germination
“新夏50”和“紫红钻”甘蓝种子随发芽时间的延长,芽长逐渐伸长(图1A)。在发芽的前2 d,两品种间甘蓝芽长无显著差异;发芽第3~5天时,芽长迅速伸长,芽苗处于最快生长期,且“新夏50”的芽长显著长于“紫红钻”;发芽至第5天时,“新夏50”和“紫红钻”芽长分别为5.36、4.14 cm。
由图1B可知,两种甘蓝品种在发芽过程中含水量的变化趋势一致,即随着发芽时间的延长,两种甘蓝芽苗中含水量逐渐升高。发芽前4 d,“新夏50”芽苗中含水量明显高于“紫红钻”,发芽至第5天两种芽苗含水量基本一致,均在92%左右。可见,“紫红钻”芽苗生长较“新夏50”缓慢。
2.2呼吸速率变化

图2 两种甘蓝种子发芽过程中呼吸速率的变化Fig.2 Changes in respiratory rate in cabbage sprouts during germination
呼吸作用是物质和能量代谢的核心,呼吸速率越高,说明生命力越旺盛,代谢越强。由图2可知,两种甘蓝种子发芽期呼吸速率的变化均先上升后下降至稳定,在发芽第2天达到最高,“新夏50”和“紫红钻”分别为5.05、3.02 mg CO2/(g·h)。“新夏50”呼吸速率在发芽第1天低于“紫红钻”,之后均显著高于“紫红钻”,可能的原因是“新夏50”萌芽缓慢,但在发芽1 d后芽长伸长较快,基础生理代谢高于“紫红钻”。
2.3硫苷含量变化
由表1可知,在“新夏50”中检测到9 种硫苷(脂肪族硫苷5 种,吲哚族硫苷4 种),“紫红钻”中检测到7 种硫苷(脂肪族硫苷5 种,芳香族和吲哚族硫苷各1 种),发芽后两种甘蓝苗中硫苷种类无变化,这说明硫苷种类与甘蓝品种有关,与生长阶段无关;两种甘蓝芽苗中脂肪族硫苷含量均显著高于芳香族和吲哚族硫苷含量,“新夏50”种子中,脂肪族硫苷占总硫苷的97.86%,含量最多的硫苷为GIB和SIN,其次为GNA,分别占总脂肪族硫苷的29.11%、37.75%和22.31%。而在“紫红钻”种子中,脂肪族硫苷占总硫苷的91.31%,其中含量较高的为PRO和SIN硫苷,分别占总脂肪族硫苷的42.58%和33.34%。
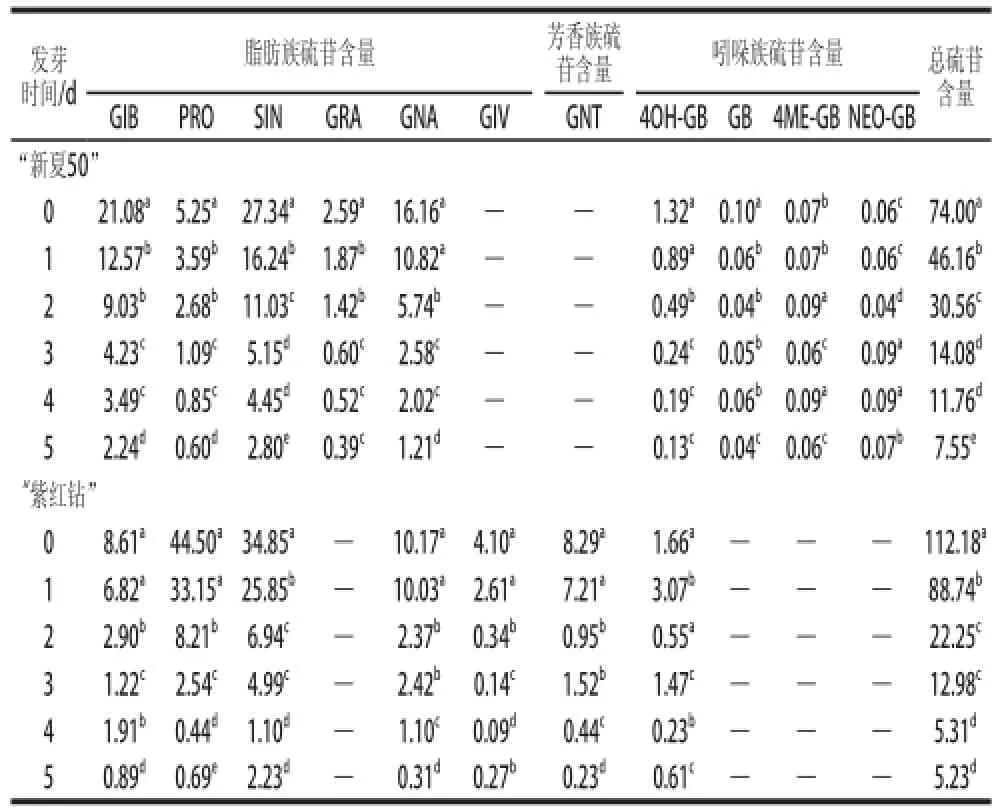
表1 甘蓝种子及芽苗中硫苷含量变化Table1 Changes in individual glucosinolates content in cabbage seeds and sprouts μmol/g
各种硫苷及总硫苷含量在发芽过程中逐渐下降。发芽前2 d硫苷含量下降迅速,“新夏50”和“紫红钻”在发芽第3天时总硫苷含量分别下降了80.97%和88.42%;脂肪族硫苷的含量分别下降了81.17%和90.44%,第3~5天,芽苗中硫苷含量下降缓慢。种子及发芽1 d的“新夏50”中的硫苷总含量显著低于“紫红钻”(P<0.05),但从发芽第2天开始直至第5天,“新夏50”芽苗中硫苷总含量下降缓慢,显著高于“紫红钻”(P<0.05),在第5天时“新夏50”苗中总硫苷为“紫红钻”的1.40 倍。PRO是致甲状腺肿素的前体,水解后会形成对人体有害的5-乙烯噁唑烷-2-硫酮[10],其含量在“紫红钻”种子中较高,但随着种子发芽和芽苗的生长,PRO含量逐渐下降,发芽至第3天时,PRO含量迅速下降,下降率为81.55%。这说明发芽可能有利于PRO的降解。种子发芽过程中,存在着复杂的硫苷合成与分解过程。两种甘蓝发芽后,其硫苷的合成速率明显低于分解速率,同时,随着芽苗生长其含水量不断升高,故硫苷相对含量随着发芽时间延长不断降低。
2.4黑芥子酶活性和异硫氰酸盐含量变化

图3 两种甘蓝种子发芽过程中黑芥子酶活性和异硫氰酸盐含量变化Fig.3 Changes in myrosinase activity and isothiocyanates content in cabbage sprouts during germination
由图3A可知,在发芽过程中,“紫红钻”在发芽1 d后黑芥子酶活力达到最高,为67.59 U/(min·mg pro),之后下降至较低水平;而“新夏50”的黑芥子酶活力则呈先下降后上升再下降的趋势,并在发芽至第3天时达到最高,为60.81 U/(min·mg pro)。由图3B可知,“新夏50”和“紫红钻”在发芽过程中异硫氰酸盐含量变化趋势一致,“紫红钻”中异硫氰酸盐含量明显高于“新夏50”,在发芽第1天,异硫氰酸盐含量显著上升,并达到最高值,“新夏50”和“紫红钻”苗中其含量分别为157.03、195.57 mg/100 g;之后显著下降,3~5 d无显著差异,这与硫苷含量的减少及黑芥子酶活性的降低有关。
2.5总酚和抗坏血酸含量变化
两种甘蓝种子中总酚含量最高均为1.15 g/100 g(图4A),在发芽第1天迅速下降,“新夏50”和“紫红钻”分别下降了55.74%和51.30%。芽苗生长过程中,部分酚类物质通过相关生物途径转化为其他物质如木质素等[14],从而导致含量迅速下降。整个发芽过程中,“紫红钻”总酚含量下降速率较“新夏50”慢。
由图4B可知,两种甘蓝种子中均未检测到抗坏血酸。但随着发芽的进行,抗坏血酸含量呈先上升后下降趋势。发芽第3天时,其含量均达到最大值,“新夏50”和“紫红钻”中分别为66.87、70.65 mg/100 g。因此,甘蓝种子发芽能够促进抗坏血酸的合成,提高其营养价值。
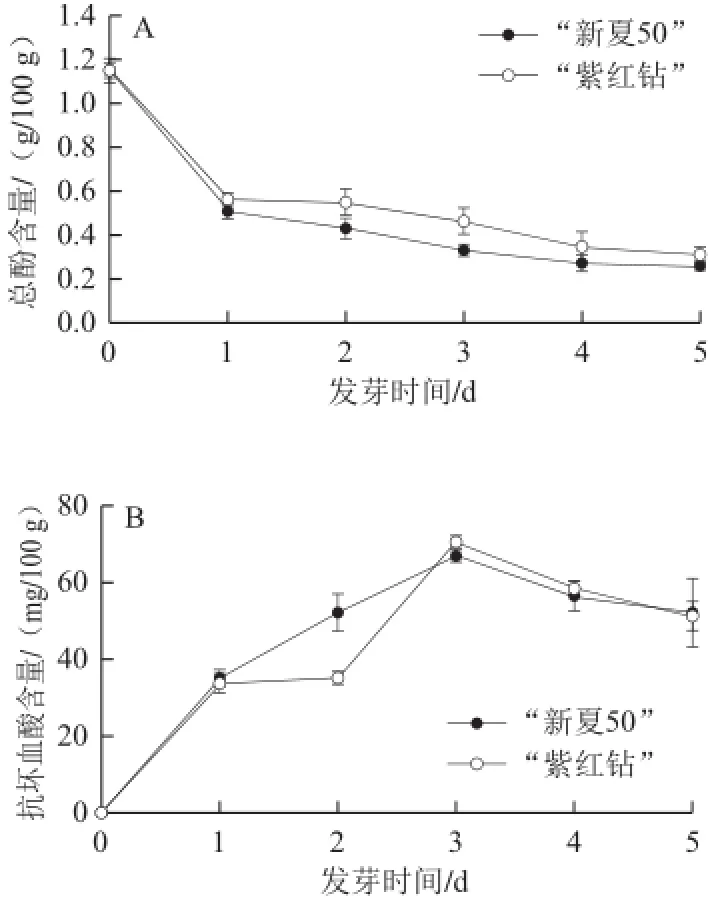
图4 两种甘蓝种子发芽过程中总酚和抗坏血酸含量变化Fig.4 Changes in total phenolic and ascorbic acid contents in cabbage sprouts during germination
3 讨 论
甘蓝种子发芽初始阶段,吸水膨胀,进入萌芽状态;呼吸作用加强,将蛋白质、脂肪等有机物分解,为萌芽生长提供充足能量。表现为芽长和含水量迅速上升,呼吸速率先升高后缓慢下降,同样的现象也表现在西兰花种子[12]发芽的过程中。
不同品种的甘蓝中硫苷种类及含量差别较大[21-22],本实验中研究的两种甘蓝,“紫红钻”种子及发芽1 d的芽苗中硫苷含量远高于“新夏50”;“新夏50”种子及芽苗中检测到4 种吲哚族硫苷,未检测到芳香族硫苷;而“紫红钻”中只检测到一种吲哚族硫苷4OH-GB,及较高含量的芳香族硫苷。两甘蓝品种中,吲哚族硫苷含量较少,脂肪族硫苷均为优势硫苷,这与Kushad[23]和Sarvan[24]等在甘蓝叶球上检测到的各种硫苷比例相似。甘蓝种子在发芽过程中硫苷含量的变化趋势与西兰花芽苗[25-27]和萝卜苗[14]基本一致。随着发芽时间的延长,两种甘蓝芽苗中硫苷含量逐渐下降,这是由于甘蓝芽苗生长过程中,体内含水量增加,硫苷的相对含量下降[25]。与此同时,甘蓝芽苗内贮藏性物质分解与新物质的合成。硫苷作为一种含硫含氮的次生代谢产物,在芽苗生长过程中亦存在着原有硫苷分解与新硫苷合成的复杂过程[12],整个发芽过程中,新合成的硫苷可能少于分解掉的硫苷从而造成硫苷含量下降的现象。致甲状腺肿素前体硫苷PRO在甘蓝发芽后显著降低,这进一步增加了甘蓝芽苗的可食性。
黑芥子酶活性与植物品种[17]、植物部位[28]及植物生长阶段[29]等因素有关。本研究中,在两种甘蓝芽苗的不同生长阶段,黑芥子酶活性不同,“新夏50”和“紫红钻”分别在发芽第3天和发芽第1天达到最高值。Williams等[30]在海甘蓝和西兰花芽苗生长过程中发现了与本研究类似的黑芥子酶活性变化趋势;而Yuan Gaofeng等[29]通过研究萝卜芽苗不同生长阶段的黑芥子酶活性发现,发芽过程中黑芥子酶活性呈现先上升后一直下降的趋势,并在发芽第5天时酶活性达到最高。
异硫氰酸盐是硫苷的水解产物的一种,具有非常有效的抗癌作用[31]。其生成量受到多种因素的影响,其中最主要的影响因子有前体硫苷的含量、黑芥子酶活性及ESP衍生蛋白的活性[11]。本研究中,“紫红钻”种子及芽苗中异硫氰酸盐含量显著高于“新夏50”,但发芽过程中其变化趋势一致,即异硫氰酸盐含量先上升至最高后下降,最后处于较低水平。Gu Yingjuan等[12]发现在西兰花种子发芽过程中萝卜硫素含量呈先下降后上升在下降的趋势,并在发芽至48 h时萝卜硫素含量达到最高。而本研究中在发芽第1天时,异硫氰酸盐含量达到最高值。这是因为在发芽第1天时,种子进入萌芽状态,其体内相关的生物合成及代谢途径被激活,硫苷在黑芥子酶的作用下分解产生异硫氰酸盐。而随着芽苗的生长,含水量不断上升,硫苷在芽苗体内得到稀释呈下降趋势[25],因此其水解产物异硫氰酸盐含量总体呈现下降趋势。
多酚为抗氧化成分之一,在两甘蓝种子中其含量相当。随着发芽时间的延长,多酚含量下降,这与Rosa等[21]在甘蓝苗和Pérez-Balibrea等[25]在西兰花苗中的研究结果一致。甘蓝发芽过程中,打破了甘蓝种子原有结构,种子发芽,吸水膨胀,原有组织受到一定程度的破坏;同时,随着甘蓝芽苗的生长,部分多酚化合物与木质素等物质发生转化[14],甘蓝苗中含水量不断上升,这些都可能是导致发芽过程中总酚含量持续下降的原因。
抗坏血酸是由半乳糖酸-1,4-内酯在半乳糖酸-1,4-内酯脱氢酶的作用下产生的[14],本研究在甘蓝种子中未检测到抗坏血酸,与Kwon等[32]在白菜种子,Pérez-Balibrea等[25]在西兰花种子中的测定结果一致,说明打破种子休眠后才能激活该酶,进一步合成抗坏血酸。本研究中甘蓝芽苗在第3天时抗坏血酸含量达到最高,而Pérez-Balibrea等[25]在西兰花苗中的研究结果显示发芽5 d时抗坏血酸含量最高,周晨光等[14]在萝卜苗中发现,抗坏血酸含量呈现上升趋势但在5~7 d无显著差异。这可能与半乳糖酸-1,4-内酯脱氢酶[33]在不同品种芽苗及不同生长阶段中的活性差异有关。发芽3 d后抗坏血酸含量下降,可能是3 d后抗坏血酸合成速率减慢,而芽苗生长迅速,抗坏血酸相对含量下降。
4 结 论
硫苷、异硫氰酸盐、总酚、抗坏血酸等生物活性物质受甘蓝品种及芽苗生长阶段影响较大。甘蓝芽苗生长过程中,硫苷、异硫氰酸盐及总酚含量总体呈现下降趋势,但这些生物活性物质的含量仍处于较高水平;抗坏血酸在发芽过程中才逐渐合成,第3天含量达到最高;而且,发芽能够显著促进致甲状腺肿素的前体硫苷PRO的降解。甘蓝品种“紫红钻”芽苗较“新夏50”更具营养价值。甘蓝芽苗可作为一种新型蔬菜,具有广阔的开发前景。
[1] CARTEA M E, VELASCO P. Glucosinolates in Brassica foods: bioavailability in food and significance for human health[J]. Phytochemistry Reviews, 2007, 7(2): 213-229.
[2] WICZKOWSKI W, SZAWARA-NOWAK D, TOPOLSKA J. Red cabbage anthocyanins: profile, isolation, identification, and antioxidant activity[J]. Food Research International, 2012, 51(1): 303-309.
[3] P☒REZ-BALIBREA S, MORENO D A, GARC☒A-VIGUERA C. Glucosinolates in broccoli sprouts (Brassica oleracea var. italica) as conditioned by sulphate supply during germination[J]. Journal of Food Science, 2010, 75(8): 673-677.
[4] KESTWAL R M, LIN J C, BAGAL-KESTWAL D, et al. Glucosinolates fortification of cruciferous sprouts by sulphur supplementation during cultivation to enhance anti-cancer activity[J]. Food Chemistry, 2011, 126(3): 1164-1171.
[5] MUNDAY R, MUNDAY C M. Induction of phase Ⅱ detoxification enzymes in rats by plant-derived isothiocyanates: comparison of allyl isothiocyanate with sulforaphane and related compounds[J]. Journal of Agricultural and Food Chemistry, 2004, 52(7): 1867-1871.
[6] JUGE N, MITHEN R F, TRAKA M. Molecular basis for chemoprevention by sulforaphane: a comprehensive review[J]. Cellular and Molecular Life Sciences, 2007, 64(9): 1105-1127.
[7] K W A K M K, W A K A B A Y A S H I N, K E N S L E R T W. Chemoprevention through the Keap1-Nrf2 signaling pathway by phase 2 enzyme inducers[J]. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis, 2004, 555(1): 133-148.
[8] GUO Rongfang, YUAN Gaofeng, WANG Qiaomei. Effect of sucrose a nd mannitol on the accumulation of health-promoting compounds and the activity of metabolic enzymes in broccoli sprouts[J]. Scientia Horticulturae, 2011, 128(3): 159-165.
[9] DAVEY M W, MONTAGU M V, INZ☒ D, et al. Plant L-ascorbic acid: chemistry, function, metabolism, bioavailability and effects of processing[J]. Journal of the Science of Food and Agriculture, 2000,80(7): 825-860.
[10] 何洪巨, 陈杭, SCHNITZLER W H. 芸薹属蔬菜中硫代葡萄糖苷鉴定与含量分析[J]. 中国农业科学, 2002, 35(2): 192-197.
[11] GU Zhenxin, GUO Qianghui, GU Yingjuan. Factors influencing glucoraphanin and sulforaphane formation in brassica plants: a review[J]. Journal of Integrative Agriculture, 2012, 11(11): 1804-1816.
[12] GU Yingjuan, GUO Qianghui, ZHANG Liang, et al. Physiological and biochemical metabolism of germinating broccoli seeds and sprouts[J]. Journal of Agricultural and Food Chemistry, 2011, 60(1): 209-213.
[13] BEWLEY J D, BLACK M. Physiology and biochemistry of seeds in relation to germination[M]. Berlin: Springer-Verlag, 1982.
[14] 周晨光, 朱毅, 罗云波. 萝卜苗发芽过程中营养物质的动态变化[J].食品科学, 2014, 35(9): 1-5.
[15] BELLOSTAS N, KACHLICKI P, S☒RENSEN J C, et al. Glucosinolate profiling of seeds and sprouts of B. oleracea varieties used for food[J]. Scientia Horticulturae, 2007, 114(4): 234-242.
[16] BUROW M, LOSANSKY A, M☒LLER R, et al. The genetic basis of constitutive and herbivore-induced ESP-independent nitrile formation in Arabidopsis[J]. Plant Physiology, 2009, 149(1): 561-574.
[17] WEI Jia, MIAO Huiying, WANG Qiaomei. Effect of glucose on glucosinolates, antioxidants and metabolic enzymes in Brassica sprouts[J]. Scientia Horticulturae, 2011, 129(4): 535-540.
[18] GUO Qianghui, GUO Liping, WANG Zhiying, et al. Response surface optimization and identification of isothiocyanates produced from broccoli sprouts[J]. Food Chemistry, 2013, 141(3): 1580-1586.
[19] AINSWORTH E A, GILLESPIE K M. Estimation of total phenolic content and other oxidation substrates in plant tissues using Folin-Ciocalteu reagent[J]. Nature Protocols, 2007, 2(4): 875-877.
[20] VOLDEN J, BENGTSSON G B, WICKLUND T. Glucosinolates,L-ascorbic acid, total phenols, anthocyanins, antioxidant capacities and colour in cauliflower (Brassica oleracea L. ssp. botrytis); effects of long-term freezer storage[J]. Food Chemistry, 2009, 112(4): 967-976.
[21] ROSA E A, RODRIGUES P M. The effect of light and temperature on glucosinolate concentration in the leaves and roots of cabbage seedlings[J]. Journal of the Science of Food and Agriculture, 1998,78(2): 208-212.
[22] OERLEMANS K, BARRETT D M, SUADES C B, et al. Thermal degradation of glucosinolates in red cabbage[J]. Food Chemistry,2006, 95(1): 19-29.
[23] KUSHAD M M, BROWN A F, KURILICH A C, et al. Variation of glucosinolates in vegetable crops of brassica oleracea[J]. Journal of Agricultural and Food Chemistry, 1999, 47(4): 1541-1548.
[24] SARVAN I, VALERIO F, LONIGRO S L, et al. Glucosinolate content of blanched cabbage (Brassica oleracea var. capitata) fermented by the probiotic strain Lactobacillus paracasei LMG-P22043[J]. Food Research International, 2013, 54(1): 706-710.
[25] P☒REZ-BALIBREA S, MORENO D A, GARC☒A-VIGUERA C. Influence of light on health-promoting phytochemicals of broccoli sprouts[J]. Journal of the Science of Food and Agriculture, 2008, 88(5): 904-910.
[26] PEREIRA F M V, ROSA E, FAHEY J W, et al. Influence of temperature and ontogeny on the levels of glucosinolates in broccoli(Brassica oleracea var. italica) sprouts and their effect on the induction of mammalian phase 2 enzymes[J]. Journal of Agricultural and Food Chemistry, 2002, 50(21): 6239-6244.
[27] FAHEY J W, ZHANG Yuesheng, TALALAY P. Broccoli sprouts: an exceptionally rich source of inducers of enzymes that protect against chemical carcinogens[J]. Proceedings of the National Academy of Sciences, 1997, 94(19): 10367-10372.
[28] PHELAN J R, ALLEN A, VAUGHAN J G. Myrosinase in Raphanus sativus L[J]. Journal of Experimental Botany, 1984, 35(10): 1558-1564.
[29] YUAN Gaofeng, WANG Xiaoping, GUO Rongfang, et al. Effect of salt stress on phenolic compounds, glucosinolates, myrosinase and antioxidant activity in radish sprouts[J]. Food Chemistry, 2010,121(4): 1014-1019.
[30] WILLIAMS D J, CRITCHLEY C, PUN S, et al. Epithiospecifier protein activity in broccoli: the link between terminal alkenyl glucosinolates and sulphoraphane nitrile[J]. Phytochemistry, 2008,69(16): 2765-2773.
[31] FENWICK G R, HEANEY R K, MULLIN W J, et al. Glucosinolates and their breakdown products in food and food plants[J]. Critical Reviews in Food Science & Nutrition, 1982, 18(2): 123-201.
[32] KWON J H, KIM G R, AHN J J, et al. Changes in physicochemical,nutritional and hygienic properties of Chinese cabbage seeds and their sprouts on gamma and electron beam irradiation[J]. Journal of Food Quality, 2013, 36(5): 316-323.
[33] XU Maojun, DONG Jufang, ZHU Muyuan. Effects of germination conditions on ascorbic acid level and yield of soybean sprouts[J]. Journal of the Science of Food and Agriculture, 2005, 85(6): 943-947.
Changes in Main Physiological and Biochemical Metabolism in Cabbage Sprouts during Germination
WANG Zhiying1, GUO Liping1,2, LI Qianqian1, YANG Runqiang1, GUO Qianghui1, GU Zhenxin1,*
(1. College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China;2. College of Food Science and Engineering, Qingdao Agricultural University, Qingdao 266109, China)
In this study, sprout length, respiratory rate, water content, glucosinolates, isothiocyanates, total phenolic and abcorbic acid contents, and myrosinase activity in cabbage sprouts from the cultivars “Xinxia 50” and “Zihongzuan” during germination were studied. The results showed that the sprout length, respiratory rate, and water content increased during the period of germination. “Xinxia 50” grew faster than “Zihongzuan”. Glucosinolates and total phenolic contents were found to be the highest in cabbage seeds but decreased with germination time. The isothiocyanates contents in “Xinxia 50” and“Zihongzuan” increased to the highest level at the fi rst day of germination but then decreased to the lowest value at day 5. However, the myrosinase activity increased to the highest at d ays 1 and 3 after germination, respectively. While abcorbic acid was not detected in cabbage seeds, and its content increased at the early germination stage but then declined.
cabbage seeds; germination; glucosinolates; total phenols; isothiocyanates; myrosinase; ascorbic acid
TS255.1
A
1002-6630(2015)03-0006-06
10.7506/spkx1002-6630-201503002
2014-03-18
国家自然科学基金面上项目(31271912);南京农业大学SRT项目(1418A03)
王志英(1988—),女,硕士研究生,研究方向为农产品加工与综合利用。E-mail:2012108020@njau.edu.cn
顾振新(1956—),男,教授,博士,研究方向为生物技术与农产食品加工。E-mail:guzx@njau.edu.cn
