蒲公英对胃癌BGC823细胞迁移、侵袭作用的影响
2015-10-18郭钦钰陈逸轩陈文莉陈新年
郭钦钰,陈逸轩,杨 剑,陈文莉,陈新年
(兰州大学基础医学院,甘肃 兰州 730000)
蒲公英对胃癌BGC823细胞迁移、侵袭作用的影响
郭钦钰,陈逸轩,杨 剑,陈文莉,陈新年
(兰州大学基础医学院,甘肃 兰州 730000)
目的 研究蒲公英对胃癌BGC823细胞迁移、侵袭作用的影响及其机制。方法 不同浓度蒲公英处理细胞后,用MTS、Transwell小室、荧光实时定量PCR等方法分别检测胃癌BGC823细胞的增值、迁移、侵袭作用以及基质金属蛋白酶2 (MMP2)基因的表达。结果 2.5 mg/ml蒲公英组抑瘤率为11.27%;对照组迁移细胞数为362个,2.5 mg/ml蒲公英组迁移细胞数为234个(P<0.05);对照组侵袭细胞数为266个,2.5 mg/ml蒲公英组侵袭细胞数为183个(P<0.05);荧光实时定量PCR结果显示,2.5 mg/ml蒲公英组胃癌BGC823细胞MMP2基因表达下调。结论 蒲公英可抑制胃癌BGC823细胞生长,使胃癌BGC823细胞的迁移、侵袭作用减弱,其机制可能是蒲公英引起MMP2基因表达下降所致。
蒲公英;胃癌BGC823细胞;迁移;侵袭
胃癌是严重危胁人类健康的恶性肿瘤,其发病率在恶性肿瘤中占第二位。胃癌传统的治疗手段,如手术治疗、放射治疗和化学治疗都会给患者带来一系列不良反应及并发症。近年来的研究发现,中药无论在早、中期作为手术、化疗以及介入治疗的辅助手段,还是在晚期因失去手术机会、不能耐受化疗或介入治疗时作为主要治疗手段都显示出一定的临床效果。有研究表明,蒲公英可以抑制体外培养的肿瘤细胞生长[1],蒲公英提取物、蒲公英多糖等均具有一定的防癌、抑癌作用以及抑制肿瘤引起的炎症反应[2],但是其抗肿瘤机制尚不明确。本实验研究蒲公英水煎剂对胃癌BGC823细胞迁移、侵袭作用的影响,为蒲公英在抗肿瘤方面的研究及应用提供实验依据。
1 材料与方法
1.1 实验药物
药用蒲公英购自甘肃省兰州市众友药业公司,本实验所选用的药用蒲公英由蒲公英全草经热水提取,减压浓缩后喷雾干燥而成的粉末,获得粉末是提取前蒲公英总量的15%。实验中将蒲公英粉末溶解在RIPM-1640细胞培养液中,按重量体积比分别配制含1.0 mg/ml、2.5 mg/ml蒲公英的细胞培养液,配制好后用0.22μm的一次性滤器过滤除菌。
1.2 试剂与材料
胎牛血清、RIPM-1640细胞培养液(美国Hyclone公司),0.25%胰蛋白酶(美国Gibico公司),DMSO试剂(美国Sigma公司),悬挂式8.0 μm24孔板Transwell小室、0.22 μm一次性针头滤器、0.45 μm一次性针头滤器(美国Millipore公司),Matrigel TM Basement Membrane matrix基质胶(美国BD公司),cDNA逆转录试剂盒、PrimeScript TM 1st Strand cDNA Synthesis试剂盒、SYBR Premix Ex Taq TM II试剂盒、琼脂糖(大连TaKaRa公司),RNA提取试剂Trizol(美国Invitrogen公司),FuGENE 6 Transfection Reagent、CellTiter 96 AQueous One Solution Cell Proliferation Assay(北京Promega公司)。
1.3 细胞培养
胃癌BGC823细胞由兰州大学病理生理研究所提供。将BGC823细胞置入含10%胎牛血清、100 U/ml青霉素、100 U/ml链霉素的RIPM-1640细胞培养液中,置于5%CO2、37℃恒温培养箱中培养,每日观察细胞情况,及时更换培养液。
1.4 用MTS法检测蒲公英对胃癌BGC823细胞增殖的影响
胰蛋白酶消化胃癌BGC823细胞,制得1×105/ml的细胞悬液,分别种于96孔板中(1×104/孔),将细胞分为3组,即空白对照组、1.0 mg/ml蒲公英组、2.5 mg/ml蒲公英组,每组平行6个孔。置于37℃、5%CO2培养箱中培养。24 h后取出96孔板,置于超净工作台上,吸弃96孔板中旧培养液,PBS清洗各孔两次后,加入无血清培养液,然后每孔滴入MTS 20 μl,37℃孵育4 h。用酶标仪在波长490 nm条件下检测。
1.5 用Transwell小室检测蒲公英对胃癌BGC823细胞迁移、侵袭作用的影响
1.5.1 细胞处理 实验前一天,将对照组细胞培养液更换为无胎牛血清的RIPM-1640培养液,实验组细胞培养液更换为含2.5 mg/ml蒲公英的无胎牛血清RIPM-1640培养液,37℃,5% CO2培养。24 h后,以胰蛋白酶消化细胞,分别制成2×105/ml的细胞悬液。
总之,在大数据时代,新媒体与传统媒体的融合是媒体发展的必然过程。只有明确媒体融合的目的,提高媒体工作者的全媒体能力,并对媒体渠道进行有效的融合,才能真正促进媒体行业良好高速的发展。
1.5.2 肿瘤迁移实验 24孔细胞培养板的孔中预先加入完全培养液(500 μl/孔),将预处理Transwell小室置于孔中,把已制好的对照组、实验组细胞悬液分别加入Transwell小室的上室(100 μl/孔、2×104/孔)。将24孔细胞培养板37℃,5%CO2培养24 h。
1.5.3 肿瘤侵袭实验 将10%人工基质胶均匀铺于Transwell小室上室中,4℃静置1 h。在24孔细胞培养板的孔中预先加入完全培养液(500 μl/孔),将铺好基质胶的Transwell小室置于孔中,把已制好的对照组、实验组细胞悬液分别加入Transwell小室的上室(100 μl/孔、2×104/孔)。将24孔细胞培养板37℃,5%CO2培养24 h。
1.5.4 结晶紫染色计数 培养24 h后,将Transwell小室轻轻取出,轻柔擦去小室上室残留的细胞悬液,用结晶紫对小室膜的下室进行染色。染色后镜检,每个小室镜下随机选取5个视野,进行拍照并计数。
迁移/侵袭下降率=(对照组迁移或侵袭细胞数-实验组迁移或侵袭细胞数)÷对照组迁移或侵袭细胞数×100%。
1.6 荧光实时定量PCR
1.6.1 细胞总RNA提取及反转录 将生长良好的胃癌BGC823细胞接种在细胞培养瓶中,分为空白对照组(0.0 mg/ml)、1.0 mg/ml蒲公英组、2.5 mg/ml蒲公英组。待细胞生长到铺满70%瓶底时,加入相应的细胞培养液,37℃,5%CO2培养。24 h后按Trizol总RNA提取试剂盒说明书分别提取3组细胞总RNA,并将RNA反转录为cDNA,置于-20℃备用。
1.6.2 荧光实时定量PCR 根据GenBank中公布的基质金属蛋白酶2(MMP2)基因序列(NM_001127891)设计定量PCR特异引物,F:gatggcatcg ctcagatccg、R:tcaggccaga atgtggccac。采用SYBR Green I*嵌合荧光法进行实时定量PCR,扩增目的基因和内参基因。反应体系 10 ul:SYBR Premix Ex Taq II(Tli RNaseH Plus)(2×)5 ul,正向引物0.5 ul,反向引物0.5 ul,cDNA 1.0ul,ddH2O 3.0 ul。反应条件:95℃,2 min,一个循环;95℃,5 s,60℃,30 s,40个循环;溶解曲线分析65℃~95℃。每个样品均设有3个复孔。
2 结果
2.1 蒲公英对胃癌BGC823细胞增殖的影响
MTS实验结果显示,1.0 mg/ml蒲公英组抑瘤率为-50.76%、
2.5 mg/ml蒲公英组抑瘤率为11.27%,有显著性差异(P<0.05),见图1。

图1 蒲公英对胃癌BGC823细胞增殖的影响
2.2 蒲公英对胃癌BGC823细胞迁移作用的影响
处理后的细胞经Transwell迁移小室培养24 h后,镜下观察结晶紫染色结果,对照组迁移数为362个,2.5 mg/ml蒲公英组为234个,有显著性差异(P<0.05),见图2、图3。
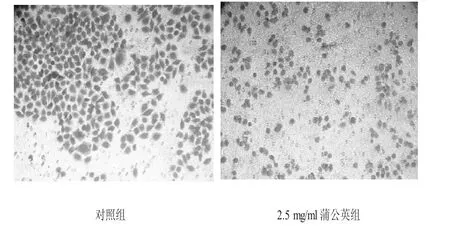
图2 Transwell小室检测胃癌BGC823细胞迁移作用结果

图3 蒲公英对胃癌BGC823细胞迁移作用的影响
2.3 蒲公英对胃癌BGC823细胞侵袭作用的影响
处理后的细胞经Transwell侵袭小室培养24 h后结晶紫染色,结果显示,对照组侵袭细胞数为266个,2.5 mg/ml蒲公英组侵袭细胞数为183个,有显著性差异(P<0.05),见图4、图5。
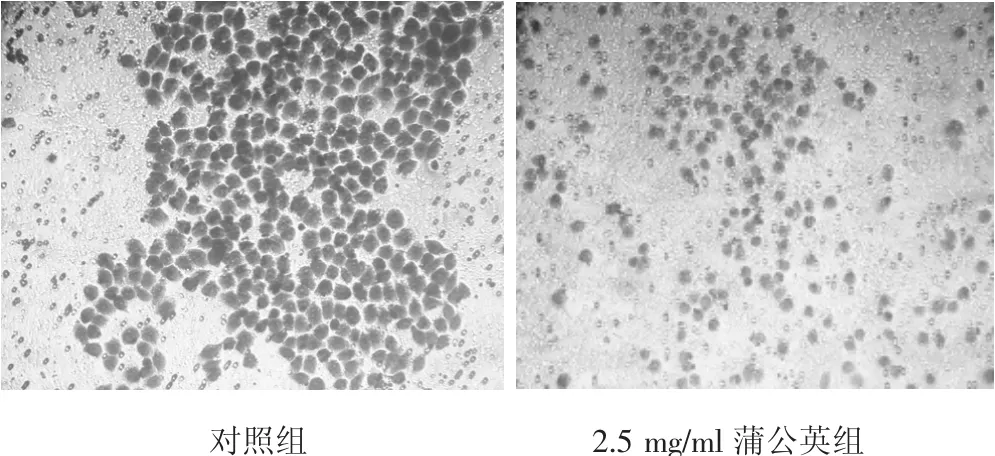
图4 Transwell小室检测胃癌BGC823细胞侵袭作用结果

图5 蒲公英对胃癌BGC823细胞侵袭作用的影响
2.4 荧光实时定量PCR结果
荧光实时定量PCR结果显示,1.0 mg/ml蒲公英组的MMP2相对量为0.82,2.5 mg/ml蒲公英组的MMP2相对量为0.35,有显著性差异(P<0.05),见图6。

图6 荧光实时定量PCR结果
3 讨论
近年来中药在临床肿瘤治疗方面取得了长足进步,无论是在增强免疫还是在整体调节方面,都显出其较化疗药物的优势[3]。现代研究表明,蒲公英的药理活性多样,具有抗菌消炎、消肿散结、抗氧化及抗肿瘤等作用。蒲公英主要含有胡萝卜素类、脂肪酸类、三枯类、香豆素类、黄酮类及酚酸类化合物。其中,发挥药理活性的主要成分为黄酮类化合物[4,5]。具有抗肿瘤作用的黄酮类化合物有芦丁、水飞蓟素、柚皮苷和槲皮素等。其抗癌、防癌机制可能与抑制自由基和致癌因子的产生、抑制肿瘤血管生长以及提高机体免疫力等有关[6]。也有研究显示蒲公英的多糖成分具有很好的抗肿瘤作用,其机制与促进肿瘤细胞凋亡有关[7]。胃癌的发病率及死亡率在恶性肿瘤中位居前列,导致死亡的主要原因是发生浸润增生与远处转移,在转移过程中,发挥功能的大部分是基质金属蛋白酶(MMP)[8],而MMP2基因的表达调控在肿瘤细胞迁移和侵袭中起着主要作用[9]。本实验选用浓度为2.5 mg/ml蒲公英的细胞培养液处理胃癌BGC823细胞24 h后,Transwell小室检测结果显示,与对照组相比,处理过的胃癌BGC823细胞迁移及侵袭能力均呈下降趋势;定量PCR结果表明,经蒲公英处理过的胃癌BGC823细胞MMP2基因表达下降,并随蒲公英浓度的增加而降低。提示蒲公英可抑制胃癌BGC823细胞的迁移、侵袭作用,其机制可能与蒲公英下调MMP2基因表达有关。作为一种无毒且具有多种活性的抗肿瘤药物,蒲公英极具开发潜力,但其是否能作为治疗肿瘤的临床药物,还需进行深入、系统的研究。
[1]Park C M,Park J Y,Noh K H,et al.Taraxacum officinale Weber extracts inhibit LPS-induced oxidative stress and nitric oxde oruduction via NF-kappaB modulation in RAW 264.7 cells [J].Ethnopharmacol,2011,133(2):834-842.
[2]Jeon H J,Kang H J,Jung H J,et al.Anti-inflammatory activity of Taraxacum officinale[J].Ethnopharmacol,2008,115(1):82-88.
[3]Parekh H S,Liu G,Wei M Q.A new dawn for the use of traditional Chinese medicine in cancer therapy[J].Mol Cancer,2009(8):21.
[4]卫建琮,李华峰,乔华,等.中药蒲公英花中总黄酮的分离纯化研究[J].中国药物与临床,2014,14(1):19-21.
[5]杨岚,李华峰,刁海鹏,等.蒲公英花中总黄酮和总酚酸含量测定及其抗氧化性能研究[J].食品科学,2011,17(32):160-163.
[6]Vanhees K,de Bock L,Godschalk R W,et a1.Prenatal exposure to flavonoids:implication for cancer risk[J].Toxicol Sci,2011,120(1):59-67.
[7]Ghavami S,Hashemi M,Ande S R,et al.Apoptosis and cancer:mutations within caspase genes[J].Med Genet,2009(46):497-510.
[8]Kai Kessenbrock,Vicki Plaks,Zena Werb.Matrix Metalloproteinases:Regulators of the Tumor Microenvironment[J].Cell,2010(141):52-67.
[9]Lee Y H,Albig A R,Regner M,et al.Fibulin-5 initiates epithelialmesenchymal transition(EMT)and enhancesEMT induced by TGF-beta in mammary epithelial cells via a MMP-dependent mechanism[J].Carcinogenesis,2008,29(12):2243-2251.
R735.2
B
1671-1246(2015)09-0142-03
