蜂毒注射液对类风湿关节炎成纤维样滑膜细胞凋亡影响的研究
2015-10-18谭宁王科澎贺守第罗晓光朱辉军黄胜光
谭宁,王科澎,贺守第,罗晓光,朱辉军,黄胜光
1.广东医学院附属深圳南山医院中医风湿科,广东 深圳 518052 2.深圳市福田区中医院,广东 深圳 508060 3.湖南中医药大学,湖南 长沙 410006
蜂毒注射液对类风湿关节炎成纤维样滑膜细胞凋亡影响的研究
谭宁1,王科澎2,贺守第3,罗晓光1,朱辉军1,黄胜光1
1.广东医学院附属深圳南山医院中医风湿科,广东 深圳 518052 2.深圳市福田区中医院,广东 深圳 508060 3.湖南中医药大学,湖南 长沙 410006
目的:探究蜂毒注射液对类风湿关节炎成纤维样滑膜细胞(FLS-RA)凋亡的影响。方法:原代培养FLS-RA,MTT法测定蜂毒注射液对细胞增殖及细胞毒性作用,hoechst染色法观察凋亡小体,Annexin V/PI双染法检测细胞凋亡率。结果:组织块培养法培养2周后细胞向心性排列,呈梭形及三角形。经过3~5次传代,FLS-RA细胞逐渐纯化,以FLS为主(>95%),体外生长稳定。倒置相差显微镜观察细胞形态:细胞排列整齐,向心性排列,呈梭形或三角形,偶见圆形细胞,细胞核成卵圆形,居细胞中央,胞质均匀透亮。干预24 h:各组生存率低于空白对照组(P<0.05),浓度越高,生存率越低;蜂毒注射液处理48 h:各组生存率低于空白对照组(P<0.05),浓度越高,生存率越低;同浓度蜂毒注射液处理24 h生存率与48 h比较:48 h组小于24 h组(P<0.05)。利用ORIGIN 5.0软件计算蜂毒注射液的半数抑制浓度(IC50)为(16.79±0.13)mg/L。实验组与阳性对照组中凋亡小体形态相似,细胞核呈致密浓染,颜色发白,而阴性对照组未见明显凋亡小体,细胞核未见固缩的染色质。B1区为细胞碎片,B2区为晚期凋亡和死亡的细胞,B3区为正常细胞,B4区为早期凋亡的细胞。由于B2区包含死亡的细胞,多选择B4区比较早期凋亡率。低浓度组蜂毒注射液作用FLS-RA细胞24 h,早期凋亡率大于空白对照组(P<0.05);高浓度组蜂毒注射液早期凋亡率明显高于空白对照组(P<0.01),且大于低浓度组(P<0.05)。结论:蜂毒注射液可诱导成纤维样滑膜细胞凋亡,这可能是蜂毒治疗类风湿关节炎的机理之一。
类风湿关节炎(RA);蜂毒注射液;成纤维样滑膜细胞(FLS-RA);细胞凋亡
类风湿关节炎(Rheum atoid arthritis,RA)是以对称性多关节肿痛为主要临床表现的一种系统性自身免疫性疾病,以关节滑膜慢性炎症、关节进行性破坏、关节畸形及功能丧失为主要病理表现。临床表现为对称性多关节肿胀、疼痛、晨僵以及全身多系统的受累,此病病因未明,具有发病率高、致残率高的特点,严重影响了患者的劳动力及生活质量[1~2]。蜂毒对类风湿关节炎病人具备较好的疗效,但蜂毒通过何种机制起作用很少有人探究,国内外研究发现成纤维样滑膜细胞(FLS-RA)增生特点类似于肿瘤细胞增生特点,蜂毒可通过多条途径诱导肿瘤细胞凋亡,故设计本实验探究蜂毒对FLS-RA凋亡的影响。
1 材料与方法
1.1 标本取材 4例类风湿关节炎滑膜标本均取自深圳市第六人民医院骨科行关节置换或关节镜手术患者,所有RA患者诊断均符合2009年ACR/EULA制定的RA分类标准和评分系统,得分均>6分。
1.2 仪器和试剂 恒温CO2细胞培养箱、流式细胞仪(美国beckm an coulter公司)、蜂毒注射液(长春博奥生物有限公司)、胎牛血清(美国Sigm a公司)、DMEM/F12细胞培养基(Hyclone公司)、MTT试剂盒(碧云天公司)、hoechst试剂盒(碧云天公司)、Annexin V/PI试剂盒(invitrogen公司)、细胞凋亡阳性对照试剂盒(碧云天公司)。
1.3 成纤维样滑膜细胞的分离培养 将术后RA滑膜组织放入盛有DMEM/F12培养基的15m L离心管内低温保存,除去附着的脂肪组织及血块,用预冷PBS液冲洗3次,将组织块修剪成1mm×1mm×1mm的小块,放置于培养瓶中,加入DMEM/F12完全培养基,放置于细胞培养箱细胞培养箱内培养,每3天更换培养基,观察滑膜细胞生长情况,待成纤维样滑膜细胞长满至覆盖瓶底细胞>80%,进行传代,一般采用一传二。将3~5代的细胞在倒置光学显微镜下进行鉴定及实验。
1.4 MTT检测实验 蜂毒浓度配置参照临床蜂毒注射液浓度稀释于DMEM/F12完全培养基中。取96孔细胞培养板,设置空白对照组、低浓度组(0.1m g/L,0.5m g/L,1m g/L)、中浓度组(2 m g/L,4 m g/L,8 m g/L)、高浓度组(16 m g/L,20 m g/L,25m g/L),每个浓度设置3个复孔,首先加入100 μL细胞混悬液(FLS-RA细胞数5×104/m L),细胞培养箱培养24 h,吸除培养基,加入100μL上述浓度配置的蜂毒注射液培养基,细胞培养箱培养24 h,加入100μLMTT液,培养箱孵育4 h,再加入100μL甲瓒溶解液,培养箱孵育4 h后,在酶标仪下采用570mm波长测定吸光度。
1.5 hoechst染色法观察凋亡小体 实验设置阴性对照组、实验组(根据MTT实验的半数抑制浓度确定蜂毒注射液浓度16 m g/L)、阳性对照组。将盖玻片放置于6孔板中,每孔加入2 m L细胞混悬液(FLS-RA细胞数1×104/m L),显微镜下观察细胞爬片成功后,分别加入完全培养基、16m g/L蜂毒注射液培养基、细胞凋亡诱导试剂A+B,放入培养箱孵育24 h,吸除玻片表面培养基,加入0.5m L固定液,室温固定10m in,无菌PBS冲洗2次,滴入适量Hoechst染色液染色9 m in,无菌PBS冲洗2次,封片液封片,倒置荧光显微镜下观察细胞形态。
1.6 Annexin V/PI双染法检测细胞凋亡率 根据MTT实验结果选择最佳浓度,设置低浓度组(4 m g/L),高浓度组(16 m g/L),空白对照组(完全培养基)。6孔培养板每孔加入1m L细胞重悬液(FLS-RA细胞数5×104个/m L)中。按照实验设计依次加入蜂毒注射液培养基混悬液,孵育24 h,无菌PBS冲洗两次,胰酶消化后转移至流式管中,离心去上清,无菌PBS冲洗1次,加入1×AnnexinV重悬,将重悬液稀释至1×106/m L,各组取100μL至流式管中,同时加入5μLAlexa Fluor 488 Annexin V和1μL 100μg/m LPI工作液,室温孵育15m in,离心去上清后,加入1X Annexin V定容至500μL,细胞滤网过滤,流式细胞仪检测各组细胞的凋亡情况。
2 实验结果
2.1 FLS原代培养及鉴定 组织块培养法培养2周后细胞向心性排列,呈梭形及三角形。经过3~5次传代,FLS-RA细胞逐渐纯化,以FLS为主(>95%),体外生长稳定。倒置相差显微镜观察细胞形态:细胞排列整齐,向心性排列,呈梭形或三角形,偶见圆形细胞,细胞核成卵圆形,居细胞中央,胞质均匀透亮。
2.2 各组OD值比较 见表1。干预24 h:各组生存率低于空白对照组(P<0.05),浓度越高,生存率越低;蜂毒注射液处理48 h:各组生存率低于空白对照组(P<0.05),浓度越高,生存率越低;同浓度蜂毒注射液处理24 h生存率与48 h比较:48 h组小于24 h组(P<0.05)。利用ORIGIN 5.0软件计算蜂毒注射液的半数抑制浓度(IC50)为(16.79±0.13)m g/L。
表1 各组OD值比较±s)

表1 各组OD值比较±s)
与空白对照组比较,①P<0.05;与同组24 h比较,②P<0.05
组别空白对照组低浓度组低浓度组低浓度组中浓度组中浓度组中浓度组高浓度组高浓度组高浓度组蜂毒注射液浓度(mg/L)0 0.1 0.5 OD值1 2 4 8 16 20 25 24 h 0.0291±0.0015 0.0279±0.0020①0.0261±0.0019①0.0248±0.0017①0.0232±0.0019①0.0194±0.0013①0.0174±0.0017①0.0153±0.0206①0.0093±0.0020①0.0038±0.0011①48 h 0.0312±0.0012 0.0266±0.0016 0.0244±0.0020①②0.0232±0.0019①②0.0180±0.0010①②0.0154±0.0015①②0.0121±0.0012①②0.0074±0.0151①②0.0016±0.0012①②0.0008±0.0009①②
2.3 hoechst染色观察凋亡小体 见图1。实验组与阳性对照组中凋亡小体形态相似,细胞核呈致密浓染,颜色发白,而阴性对照组未见明显凋亡小体,细胞核未见固缩的染色质。
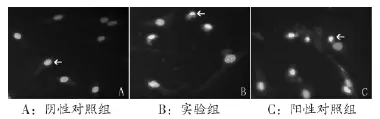
图1 hoechst染色观察凋亡小体
2.4 各组细胞凋亡率比较 见图2。B1区为细胞碎片,B2区为晚期凋亡和死亡的细胞,B3区为正常细胞,B4区为早期凋亡的细胞。由于B2区包含死亡的细胞,多选择B4区比较早期凋亡率。低浓度组蜂毒注射液作用FLS-RA细胞24 h,早期凋亡率大于空白对照组(P<0.05);高浓度组蜂毒注射液早期凋亡率明显高于空白对照组(P<0.01),且大于低浓度组组(P<0.05)。

图2 各组细胞凋亡率比较
3 讨论
RA是以对称性多关节损害的一种自身免疫性疾病,其病理表现为滑膜组织异常增生。滑膜组织是包裹在关节外面的一层膜组织,正常的滑膜组织在解剖学上可分为两个部分:滑膜内层(衬里层)和滑膜下层(衬里下层),滑膜内层介于滑膜下层与滑液之间,这层有两种主要类型的细胞:巨噬样细胞(又称A型滑膜细胞)和成纤维样细胞(又称B型滑膜细胞)[3~4]。大量的研究证实,FLS-RA拥有超常的增殖能力以及高强度的侵蚀力,衬里层的滑膜细胞异常增生可能与细胞凋亡受到不同程度的抑制相关[5~6]。
蜂毒是经受长时期考验的天然药物,在风湿病的治疗中占有重要地位[7]。药理研究表明,蜂毒具备镇痛、抗炎、降血压、抗凝血、抗菌、防辐射、抗肿瘤等作用。近年来用于治疗自身免疫性疾病、神经系统疾病、运动系统疾病、心血管疾病、变态反应性疾病等。临床试验研究表明,蜂毒有抗炎、调节免疫作用,可改善类风湿因子、血沉、C-反应蛋白、抗环瓜氨酸抗体等指标[8~11]。体外研究及动物实验发现,蜂毒可以有效抑制大鼠体内多种细胞因子的水平,这对抑制滑膜组织炎症和阻断关节软骨基质的降解有正面作用,进而起到保护关节软骨的作用[12~14]。
本实验通过蜂毒注射液作用于体外原代培养的FLS,MTT实验显示在一定范围内[(0.1~25)m g/L]随着蜂毒注射液浓度升高,FLS的的生存率逐渐下降,通过hoechst染色法可观察到凋亡小体,利用AnnexinV/PI双染法联合流式细胞术检测发现蜂毒注射液诱导FLS-RA凋亡,且高剂量组的早期凋亡率大于低剂量组以及阴性对照组。有动物实验研究发现,蜂毒肽是蜂毒治疗RA的活性成分[15],是否蜂毒通过蜂毒肽而诱导FLS的凋亡有待进一步探究。
[1]Liu AL,Shen PW,Chen PJ.Strontium ranelate in fracture healing and joint pain im provem ent in arheum atoid arthritis patient[J].Clin Cases M iner Bone Metab,2013,10(3):206-209.
[2]Karlson EW,Deane K.Environm ental and geneenvironm ent interactions and risk of rheum atoid arthritis[J].Rheum Dis Clin North Am, 2012, 38(2):405-426.
[3]Ospelt C, Neidhart M, Gay RE, et al.Synovial activation in rheum atoid arthritis [J].Frontiers in Bioscience,2004,9:2323-2334.
[4] M elinte R,Jung I,Georgescu L,et al.VEGF and CD31 expression in arthritic synovium and cartilage of hum an knee joints[J].Rom J Morphol Em bryol,2012,53(4):911-915.
[5]W ang F, Xu L, Feng X, et al.Interleukin-29 m odulates proinflamm atory cytokine production in synovialinflamm ation of rheum atoid arthritis[J].Arthritis Research&Therapy,2012,14(5):R228.
[6] Fan W,Zhou ZY,Huang XF,et al.Deoxycytidine kinase prom otes the m igration and invasion of fibroblast-like synoviocytes from rheum atoid arthritis patients [J].International Journal of Clinical and Experim entalPathology,2013,6(12):2733-2744.
[7]黄胜光,谭宁,朱辉军.雷公藤、附子、蜂毒在风湿病中的应用[J].辽宁中医药大学学报,2011,13(6):20-22.
[8]张金禄,刘喜德.蜂针疗法治疗类风湿关节炎膝关节滑膜炎的临床随机对照研究[J].中华中医药学刊,2011,29(8):1904-1906.
[9]邓鸣,张炜宁.蜂针疗法治疗类风湿性关节炎20例临床观察[J].中医药导报,2011,14(6):71-73.
[10]马辉,袁敏哲,姚卓.蜂疗对类风湿性关节炎的治疗[J].辽宁中医杂志,2012,39(6):1063-1064.
[11]刘喜德,张金禄,郑汉光,等.蜂针疗法对类风湿关节炎患者外周血TNF-α、IL-1β的影响[J].中华中医药学刊,2008,26(5):996-997.
[12]赵争敏,薛鸾,曹瑶.蜂毒对胶原诱导大鼠关节炎IL-1β、TNF-α、PGE2的影响[J].河南中医,2009,29(12):1169-1170.
[13]周颖芳,段颖华,李万瑶.蜂针对胶原诱导关节炎大鼠HPA轴的影响[J].辽宁中医药大学学报,2012,14(4):233-235.
[14]杨顺益,刘金芝.冯淑兰.等.蜂针对实验性类风湿关节炎动物细胞因子影响的研究[J].中国自然医学杂志,2002,4(1):41-43.
[15]李晶华,马静,李军昌.蜂毒肽对类风湿关节炎模型大鼠患侧关节的影响[J].武警医学,2011,22(9):741-743.
(责任编辑:骆欢欢)
Study o f Ap istoxin In jection on Apop tosis o f Fib rob last-like Synovial Cells o f Rheum atoid Arth ritis Patien ts
TAN Ning,WANG Kepeng,HE Shoudi,et al
Objective:To explore the influence of Apistoxin injection on the apoptosis of fibroblast-like synovial cells of rheum atoid arthritis patients.M ethods:Rheum atoid arthritis fibroblast-like synovial cells(FLS-RA)w as concentrated by the prim ary culture in vitro.Effect of Apistoxin injection on cellproliferation and cell toxicity w as m easured by MTT technique,and apoptotic body w as observed by Hoechst staining,apoptotic rate w as detected after Annexin V/PIdouble staining.Results:After prim ary culture for2 w eeks,the cells w ere fusiform or triangle-like,arranged around the center.After passage culture for 3-5 generations,FLS-RA becam e pure and the percentage of FLSw as over 95%,grow ing steady in vitro.The results under inverted phase contrast m icroscope show ed that the cells w ere arranged around the center in order,w ere fusiform or triangle-like,and seldom w ere round w ith oval nucleus in the center of the cell.The cytoplasm w as w ell-distributed and lucency.After intervention w ith Apistoxin injection for24 and 48 hours,the survival rate of FLS-RAw as low er in the intervention groups than that in the blank control group(P<0.05),and the survival rate decreased w ith the increase of Apistoxin injection concentration(P<0.05).The survival rate induced by the sam e concentration of Apistoxin injection w as low erafter intervention for 48 hours than that after 24 hours(P<0.05).The 50%inhibiting concentration(IC50)of Apistoxin injection w as 16.79±0.13m g/L. The apoptotic body w as found in both observation group and positive controlgroup,w hile w as not show n in the negative control group.The cells in B4 region w ere chosen for the calculation of early apoptotic rate,and the results show ed that low-andhigh-concentration Apistoxin injection groups had higherearly apoptotic rate than the blank controlgroups(P<0.05 or P<0.01),and the high-concentration groups had the highestearly apoptotic rate(P<0.05).Conclusion:Apistoxin injection can induce the apoptosis of fibroblast-like synovial cells,w hich m ay be one of the therapeutic m echanism s of Apistoxin injection for rheum atoid arthritis.
Rheum atoid arthritis;Apistoxin injection;Fibroblast-like synovialcells;Apoptosis.
R593.22
A
0256-7415(2015)06-0280-03
10.13457/j.cnki.jncm.2015.06.130
2014-12-29
深圳市科技计划项目(201303177)
谭宁(1977-),女,副主任医师,研究方向:中西医结合风湿病。
黄胜光,E-mail:282111306@qq.com。
