三叶青相关序列扩增多态性-聚合酶链式反应体系的建立与优化
2015-10-18纪其雄吴晓菁杨雄志
纪其雄, 彭 昕*, 吴晓菁, 杨雄志
(1.浙江医药高等专科学校,浙江 宁波 315100;2.太极集团浙江东方制药有限公司,浙江 绍兴 312000)
三叶青相关序列扩增多态性-聚合酶链式反应体系的建立与优化
纪其雄1, 彭 昕1*, 吴晓菁2, 杨雄志1
(1.浙江医药高等专科学校,浙江宁波315100;2.太极集团浙江东方制药有限公司,浙江绍兴312000)
目的 建立浙江和江西产的三叶青(Tetrastigma hemsleyanum)SRAP-PCR的反应体系和扩增程序。方法 应用L9(34)正交设计方法,以三叶青基因组DNA为模板,研究了Mg2+、dNTP、引物和模板DNA 4种PCR反应组分浓度变化对扩增结果的影响,根据梯度PCR仪引物的条带数量及清晰度选择退火温度。结果 优化后的25μL反应体系包含:10×PCR buffer2.5μL,2.5 mmol/LMgCl2,0.15 mmol/L dNTP,0.15μmol/L引物,1.0 U Taq DNA聚合酶,50 ng DNA模板。扩增程序的最佳退火温度为51℃。并筛选出8对扩增产物丰富,多态性好的引物。结论 正交设计优化的三叶青SRAP反应体系,经过10份样品检验,证明该体系稳定可靠,多态性好,可用于三叶青遗传多样性分析。
三叶青;相关序列扩增多态性-聚合酶链式反应(SRAP-PCR);正交设计
三叶青Tetrastigma hemsleyanum Diels et Gilg为葡萄科崖爬藤属植物,是我国独有的珍稀药用植物,是抗肿瘤常用药物[1-2],也可用于治疗风湿性关节炎、肝炎、高热及病毒性脑膜炎等多种疾病。目前该植物野生资源濒临灭绝,其组培快繁技术虽有包括本课题组在内的一些探索[3-6],但技术尚不够成熟,满足不了临床需求。用分子标记的方法研究物种间亲缘关系及种内遗传多样性,可为品种鉴别、良种选育、基因资源保护与利用等提供科学依据。而三叶青遗传多样性的评价及DNA指纹图谱建立方面尚未见报道。
目前使用最广泛的DNA分子标记技术有RFLP、RAPD、ISSR、AFLP、SNP和SRAP等。其中SRAP标记(sequence-related amplified polymorphism)是2001年由Li等[7]提出的基于聚合酶链式反应(PCR)的一种标记。基本原理是利用特殊的引物设计方式实现对ORFs(开放阅读框架)的扩增,正向引物中的核心序列CCGG锚定ORF区的外显子;反向引物中的核心序列AATT锚定内含子与启动子。因不同个体的内含子、启动子及其间隔区长度不等而产生多态性,从而扩增出丰富的SRAP多态性标记,具有多态性高,重复性好,操作简单等特点,是一种比较理想的新型分子标记。本研究拟对影响三叶青SRAP-PCR反应体系的Mg2+,dNTP,模板DNA水平,TaqDNA聚合酶,引物浓度,退火温度等因素进行优化实验,旨在建立适用于三叶青的SRAP-PCR反应体系,为今后进一步开展三叶青种质资源遗传多样性研究、遗传图谱构建和品种鉴定等工作奠定实验基础。
1 材料与仪器
本实验所有试剂及合成引物均购自上海生工生物工程有限公司,10个SRAP正向引物和10个SRAP反向引物序列见表1。Eppendorf Master cycler梯度PCR仪(德国Eppendorf公司),Gel Doc XR +紫外凝胶成像分析仪(美国Bio-Rad公司),高速冷冻离心机(杭州纳德公司),Sub-Cell系统水平电泳槽(美国Bio-Rad公司)。

表1 三叶青SRAP标记分析的待选引物序列Tab.1 Primer sequence for SRAP analysis of T.hemsleyanum
本实验所采用的三叶青材料,其中编号zj1~zj6的采自浙江丽水,编号jx1~jx4的采自江西弋阳,经丽水农科院吉庆勇高级农艺师和浙江医药高等专科学校杨雄志教授鉴定为Tetrastigma hemsleyanum Diels et Gilg。
2 方法
2.1基因组DNA的提取与检测 三叶青基因组DNA提取采用改良CTAB法[8],经1%琼脂糖凝胶电泳和微量核酸蛋白检测仪检查总DNA浓度及其完整性,并用双蒸水稀释至50 ng/μL备用。
2.2SRAP-PCR扩增程序及反应体系 扩增程序为:95℃预变性5 min,(94℃40 s,40℃1 min,72℃1 min)5循环,(94℃40 s,50℃1 min,72℃1 min)35循环,72℃延伸10 min。PCR产物经含0.05%EB的2.2%琼脂糖凝胶电泳分离,电极缓冲液为1×TAE,电泳电压5 V/cm,紫外凝胶成像分析仪内观察、拍照。原初扩增反应体系为:25μL PCR反应,10×缓冲液2.5μL,2.5 mmol/L MgCl2,1U Taq酶,25 ng模板DNA,0.2 μmol/L引物,0.1 mmol/L dNTP。
2.3退火温度的筛选 先根据原初的PCR反应条件进行引物的初筛,选择能看到清晰条带的引物组合Me3和Em5对退火温度进行考察。
2.4SRAP-PCR反应体系的正交试验设计 采用L9(34)正交设计,对Mg2+、引物、dNTP和模板DNA进行四因素三水平筛选,见表2,每个处理3个重复,用Quantity one分析软件对实验结果按照特异性条带强弱进行处理,特异条带强、清晰度高、背景低的记为9分,与之相反最差的记分为1,其他的与其相比取整数值,对其从高到低依次打分[9-10]。
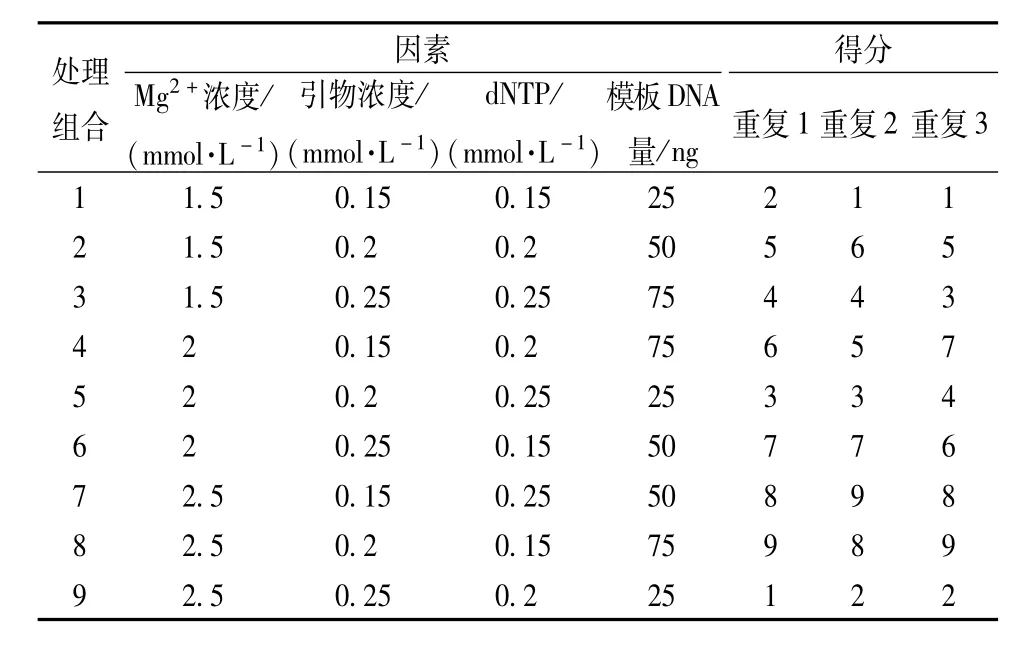
表2 SRAP-PCR反应L9(34)正交设计Tab.2 L9(34)orthogonal design for the factors and levels of SRAP-PCR reaction
2.5体系稳定性和多态性验证 利用以上筛选出来的优化扩增条件对10份三叶青材料对反应体系的稳定性和多态性进行验证,每个材料重复3次。
3 结果与分析
3.1退火温度筛选实验结果 退火温度过低可能引起引物与模板错配,非特异性产物扩增,温度过高引物不能与模板牢固结合,DNA扩增效率下降。由梯度PCR仪自动生成的8个不同退火温度对引物组合Me3和Em5扩增结果的影响见图1,从图中可以看出,虽然各温度均能扩增出条带,但条带数量及清晰度有明显区别,43~45.7℃时主要扩增出分子质量大的一些条带,而且条带较为弥散,53.8~56℃较高温度时主要扩增出分子质量小的条带,条带清晰,但副带逐渐减少,48.4~51℃时扩增出的条带数量最多而且条带清晰度较高,考虑较高退火温度有利于减少杂带的产生,因此,选择51℃为三叶青SRAP扩增最佳退火温度。
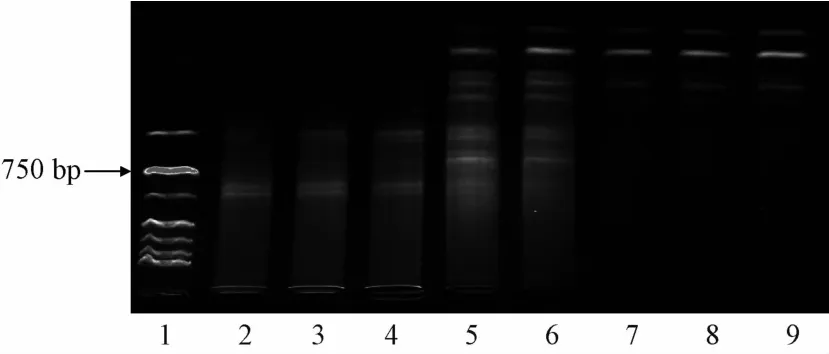
图1 退火温度对三叶青SRAP扩增的影响Fig.1 Effect of annealing temperature on T.hemsleyanum SRAP amp lification
3.2正交试验结果 三叶青SRAP-PCR正交试验结果见表2,表3和图2。利用SPSS 17.0将上述记分结果进行方差分析和多重比较分析,结果表明,Mg2+浓度、dNTP、引物浓度及模板DNA浓度均对扩增结果有显著的影响(P<0.05)。均方差显示各因素对结果影响的主次顺序为:DNA模板浓度>Mg2+浓度>引物浓度>dNTPs,进一步对各因素的不同水平进行多重比较,见表4,Mg2+浓度三个水平之间差异均达到显著水平,P值分别为0.000(1.5与2 mmol/L之间)、0.000(1.5与2.5 mmol/L之间)和0.003(2与2.5 mmol/L之间),结合表2中PCR结果均值可知2.5 mmol/L为最适合Mg2+浓度。引物浓度在0.25μmol/L与其它两个水平之间有显著差异,P值分别为0.001(0.15和0.25μmol/L之间)和0.000(0.2与0.25μmol/L之间)0.15和0.2μmol/L之间为0.069,没有显著差异,结合表4中不同处理水平结果均值可知引物0.15或0.2μmol/L均为较佳浓度,考虑成本确定引物最佳浓度为0.15μmol/L。0.15和0.25 mmol/L dNTP浓度之间没有显著差异(P值为0.139),结合表4中不同处理水平结果均值可知0.15 mmol/L为最适dNTP浓度。模板DNA浓度三个水平间均有显著差异,P值分别为0.000(25与50,25与75),0.032(50和75之间),结合表4中不同处理水平结果均值可知50 ng为最适模板用量。综上所述,Mg2+浓度2.5 mmol/L,引物浓度0.15μmol/L,dNTPs0.15mmol/L,DNA模板50 ng为三叶青SRAP-PCR的最佳反应体系。

图2 L9(34)正交设计SRAP扩增结果Fig.2 Electrophoresis of L9(34)orthogonal design
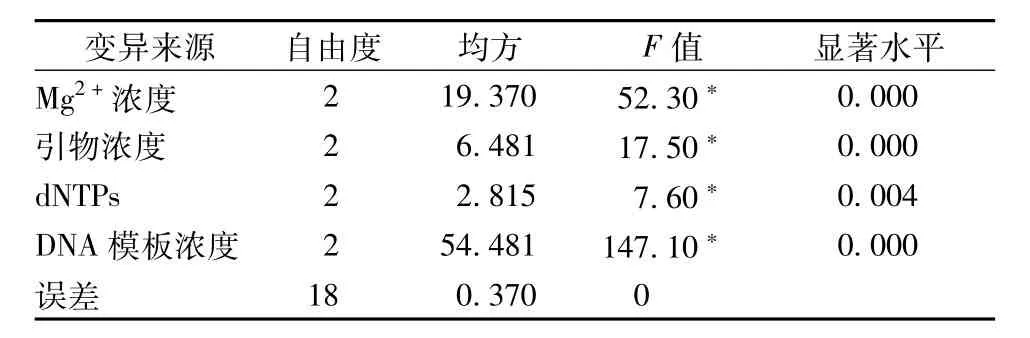
表3 正交试验中各因素方差分析Tab.3 Analysis of variance for factors of orthogonal design

表4 各因素不同处理水平结果均值差异显著性Tab.4 Significance among themeans of different factor levels
3.3引物筛选 在优化PCR反应体系的基础上,以扩增出的条带清晰度高,多态性好,重复性好为原则,从100对引物中筛选出8对引物组合(表5)。
3.4体系稳定性和多态性验证 从图3可见,引物组合Me3和Em5可以10份种质材料中扩增出清晰度高、多态性较高、重复性好的DNA条带。这表明经过优化后建立的SRAP-PCR反应体系稳定可靠。

图3 三叶青SRAP优化体系的稳定性检测图谱(M e3-Em5引物组合)Fig.3 SRAP-PCR p rofiles of 10 DNA sam p les from T.hemsleyanum w ith primer com bination M e3-Em5

表5 筛选出的三叶青SRAP标记分析的引物组合Tab.5 Prim er sequence screened for SRAP analysis of T.hemsleyanum
4 讨论
SRAP是近年来出现的一种新型分子标记技术,它既克服了RAPD重复性差的缺点,又克服了RFLP、AFLP成本昂贵、技术复杂的缺点,目前广泛用于物种DNA指纹图谱构建[11]、品种鉴别[12]、亲缘关系分析[13]、遗传多样性分析[14]及分子辅助遗传育种等。但作为一种基于PCR的技术,结果受到反应体系和扩增程序的影响,为提高其稳定性和可靠性,对其反应条件进行优化是非常必要的。
扩增程序的设置中退火温度的确定通常是至关重要的因素之一,退火温度过高严重影响扩增产物数量及条带数,而退火温度过低则可能增加模板与引物之间非特异性的结合。本研究采用单因子梯度实验的方法确定了所筛选出引物的最佳退火温度。多项研究[15-16]表明,PCR反应体系中各因素之间往往存在着交互效应,因此,本研究采用正交设计法对PCR反应体系中各影响因素进行了筛选。大多数实验[12,15]表明合适用量的Taq酶对PCR反应结果没有显著影响,且本研究对Taq酶用量做了初步梯度实验,未发现其对PCR结果有明显影响,因此,本次正交设计中未将其纳入影响因素的研究对象。正交试验的方差分析结果表明其余四个因素中DNA模板浓度对PCR扩增影响最大,DNA用量为25 ng时虽然主带清晰,但副带数量明显最少,DNA用量在75 ng时,条带数目虽然最多,但是背景模糊,条带清晰度不高,在适中水平50 ng时背景干扰低、谱带多态性高、主带清晰、副带明显。可能是当DNA用量过少时一些低拷贝的基因片段扩增量不足,而DNA用量过高时,非特异性条带的扩增增强,因此背景模糊,主带清晰度降低,与王新民在杉木上[15]的研究结果一致,然而这与怀地黄[11]、山葡萄[12]实验中得出的模板浓度对ISSR-PCR扩增结果的影响最不显著的结论不同,这可能是由于本实验中所采用的模板浓度恰在其扩增的阈值范围,也可能是因为所采用的植物基因组不同,与引物配对的区域和严格程度不同。Mg2+是保证Taq酶活性必需的激活剂,浓度过低会导致产物产量降低,过高则会引起非特异性扩增,适宜的浓度一般为0.5~2.5 mmol/L。本实验中,Mg2+浓度过低时,出现条带缺失、亮度减弱等现象,而Mg2+浓度较高时,虽未出现明显的非特异性条带,但背景明显模糊,扩增出的条带清晰度明显下降。引物浓度过低会影响产物形成,但过高容易形成引物二聚体或引起其他非特异性扩增,虽然本研究所选较适中的浓度范围内条带数量不足以产生明显变化,但条带的亮度和清晰度出现了一定程度的变化,引物浓度过低或过高都使条带较弥散模糊,可能是因为降低了模板与引物特异性的配对。
dNTP是PCR反应中靶序列扩增的原料,浓度过低不足以完成设定的循环数就提前终止反应,影响扩增结果,而浓度过高则可能导致PCR错配,从而出现非特异性扩增,同时浓度过高也会与Taq酶竞争Mg2+,造成酶活性降低,出现无扩增产物的现象[12]。本研究虽然dNTP的浓度对结果的影响也达到显著的水平,但其是四个因素中最次要的因素,它对PCR结果的影响仅在于条带亮度的区别,对条带的数量及背景的清晰度没有显著影响,与西洋杜鹃[14]的SRAP研究上所得出的结论一致。
确定了最佳反应条件后采用了10份样品对其进行验证,得到了清晰稳定的扩增图谱,虽然样品数量有限,且10份样品仅来源于浙江和江西两个种源地,但该图谱中所扩增出的10条带中,多态性条带仍有4条,多态性比率达到40%,因此,本实验优化的SRAP-PCR反应适合后续用于三叶青遗传多样性分析及遗传图谱的构建。
[1] Xu C J,Ding G Q,Fu JY,et al.Immunoregulatory effects of ethyl-acetate fraction of extracts from Tetrastigma Hemsleyanum Diels et.Gilg on immune functions of ICR mice[J].Biomed Enυiron Sci,2008,21:325-331.
[2] 王小莉,曾 娟,周 辉.三叶青提取物对肺癌细胞株A549的影响[J].肿瘤药学,2012,2(5):347-349.
[3] Dai Y J,Shen ZG,Liu Y,etal.Effectsof shade treatments on the photosynthetic capacity,chlorophyll fluorescence,and chlorophyll content of Tetrastigma hemsleyanum Diels et Gilg[J]. Enυiron Exp Bot,2009,65:177-182.
[4] 彭 昕,张 剑,何军邀,等.三叶青松散型和致密型愈伤组织悬浮培养及黄酮积累的比较研究[J].中草药,2012,43(3):577-580.
[5] Peng X,Zhou S L,He JY,et al.Influence of rare earth elements on metabolism and related enzyme activity and isozyme expression in Tetrastigma hemsleyanum cell suspension cultures[J].Biol Trace Elem Res,2013,152(1):82-90.
[6] 彭 昕,汪荣斌,何军邀,等.三叶青颗粒状愈伤组织悬浮培养系的建立及培养条件的优化[J].中成药,2012,34(5):961-964.
[7] Li G,Quiros C F.(2001)Squence-related amplified polymorphism(SRAP),A new marker system based on a simple PCR reaction:its application tomapping and gene tagging in Brassica[J].Theor Appl Genet,103:455-461.
[8] Wang M,Oppedijk B J,Lu X,etal.Apoptosis in barley aleurone during germination and its inhibition by abscisic acid[J]. Plant Mol Biol,1996,32(6):1125-1134.
[9] 孙清信,陈 坚,张 辉.紫云英ISSR引物的筛选及PCR反应体系的优化[J].植物遗传资源学报,2012,13(5):870-878.
[10] 廖 丽,郭巧生.夏枯草ISSR分子标记技术的建立与体系优化[J].中草药,2009,40(7):1131-1135.
[11] 谷凤平,周春娥,路淑霞,等.怀地黄SRAP分子标记体系的建立与DNA指纹图谱的构建[J].河南师范大学学报:自然科学版,2009,37(3):175-177.
[12] 金炳奎,宗成文,曹后男,等.山葡萄SRAP技术体系的建立及其在品种鉴定中的应用[J].吉林农业大学学报,2013,35(2):198-205.
[13] 李永平,康建坂,林 珲,等.10个佛手瓜栽培品种亲缘关系的SRAP分析[J].福建农林大学学报:自然科学版,2012,41(6):590-594.
[14] 吴月燕,陶巧静,李 波,等.西洋杜鹃SRAP体系优化及遗传多样性分析[J].浙江农林大学学报,2013,30(6):844-851.
[15] 王新民,郑仁华,陈金慧,等.杉木SRAP-PCR体系优化[J].南京林业大学学报:自然科学版,2014,38(1):15-20.
[16] 牛 田,张 林,王厚新,等.春兰SRAP-PCR反应体系的建立和优化[J].农学学报,2013,3(11):25-29.
Establishment and optim ization of SRAP reaction system for Tetrastigma hemsleyanum
JIQi-xiong1, PENG Xin1*, WU Xiao-jing2, YANG Xiong-zhi1
(1.Zhejiang Pharmaceutical College,Ningbo 315100,China;2.Taiji Group Zhejiang East Pharmaceutical Co.,Ltd,Shaoxing 312000,China)
AIM To establish the SRAP reaction system and PCR procedures for Tetrastigma hemsleyanum,collected from Zhejiang and Jiangxi Province,China.METHODS The orthogonal design was applied for optimizing seven factors in the SRAP-PCR reaction system,including Mg2+concentration,dNTP concentration,primer concentration,template DNA dosage,and Taq DNA polymerase dosage.The annealing temperature was chosen on the base of band number and resolution in gradient PCR apparatus.RESULTS The optimal reaction system for ISSR analysis comprised 2.5 mmol/L MgCl2,0.15 mmol/L dNTP,0.15μmol/L primers,50 ng of template DNA,and 1 U of Taq DNA polymerase in 25μL total volume.Proper annealing temperature was 51℃.Eight pairs of primerwhich had rich products and high polymorphism were selected.CONCLUSION SRAP-PCR reaction system for T.hemsleyanum is established and optimized in this study,which is supported using 10 germplasms,these results shows that the SRAP-PCR reaction system is stable and can be used for the genetic analysis of T.hemsleyanum.
Tetrastigma hemsleyanum;SRAP-PCR;orthogonal design
R282.5
A
1001-1528(2015)03-0562-05
10.3969/j.issn.1001-1528.2015.03.022
2014-04-02
2013年浙江省公益性技术资助项目(2013C32103);2013年浙江省教育厅高校科研项目(Y201330174)
纪其雄(1965—),男,硕士,讲师,研究方向为药学细胞工程。E-mail:ji_qixiong@126.com
彭 昕,副教授,研究方向为分子生物学。E-mail:pengx@mail.zjpc.net.cn
