灭多威的电化学性质及其在残留检测中的应用
2015-10-17夏高峰杨晓云徐汉虹
刘 佳, 夏高峰, 杨晓云*, 徐汉虹
(华南农业大学,天然农药与化学生物学教育部重点实验室,广东广州 510642)
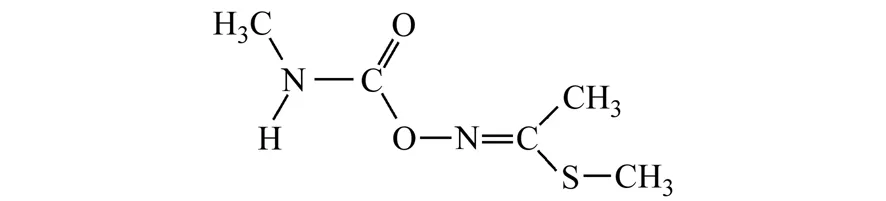
图1 灭多威的化学结构Fig.1 Chemical structure of methomyl
灭多威(Methomyl)是一种广谱性氨基甲酸酯类杀虫剂,化学名称为S-甲基-N[(甲基氨基甲酰)-O] 硫代乙酰胺,结构式见图1。灭多威具有触杀和胃毒作用,可有效防治棉花、烟草、果树及蔬菜上的鳞翅目、同翅目、鞘翅目等多种害虫,已广泛应用于农林业生产[1]。目前有关灭多威残留的分析方法主要有高效液相色谱法[2 - 4]和气相色谱法[5,6],而采用电化学方法检测其残留国内尚未见有关报道,国外已有相关文献报道了灭多威在乙醇-水溶液中的电化学行为[7]。
本文利用灭多威在磷酸盐缓冲溶液(PBS)中具有的还原性质,根据铂丝电极上的电化学信号,采用差分脉冲伏安(DPV)法可快速、灵敏检测其残留量,并采用该方法测定了蔬菜中灭多威的残留。
1 实验部分
1.1 主要仪器和试剂
μEA160C电化学分析仪(华南理工大学电化学分析教研室研制),采用三电极系统,铂电极为工作电极,AgCl/Ag电极为参比电极,铂丝电极为对电极。R-201型旋转蒸发仪(上海申顺生物科技有限公司)。310p-01 3 star pH计(美国,Thermo Orion)。
灭多威标准溶液(100 mg/L):称取灭多威标准品0.0102 g(纯度为98%,湖北沙隆达股份有限公司)于100 mL容量瓶中,用乙腈定容至刻度线,摇匀,于4 ℃冰箱中保存。磷酸盐缓冲溶液(PBS)分别配制浓度为0.0667 mol/L 的Na2HPO4和KH2PO4溶液,然后将两种溶液按不同比例混合,配制pH值分别为5.29、5.59、5.91、6.24、6.47、6.64、6.81、6.98、7.38、7.73、8.04的缓冲溶液,于4 ℃冰箱中保存。其余试剂均为分析纯。实验用水均为石英亚沸二次蒸馏水。
蔬菜购于华南农业大学农贸市场。
1.2 实验方法
分别取浓度为0.6~1.0 mg/L灭多威标准溶液,以及适量PBS于电解池内,采用三电极系统,对灭多威进行DPV法扫描,以100 mV/s的扫描速度,由0.4 V负扫到-0.3 V,记录DPV曲线,采集电流数据的电位区间为-400~400 mV,取样电位间隔为5 mV。
取0.1 mg/L的灭多威标准液于pH值为7.73的PBS中进行循环伏安(CV)扫描,以100 mV/s的扫描速度,由-0.6 V正向扫描到1.0 V,记录CV曲线。
2 结果与讨论
2.1 支持电解质的选择
用CV法分别研究了灭多威在0.5 mol/L的KOH、Na2HPO4、NaAc-HAc、PBS、NaCl、B-R等电解质溶液中的相对峰高和峰形。结果发现,在pH值为7.73的PBS中灭多威还原峰的灵敏度相对较高、峰形较好,故选择PBS为底液。
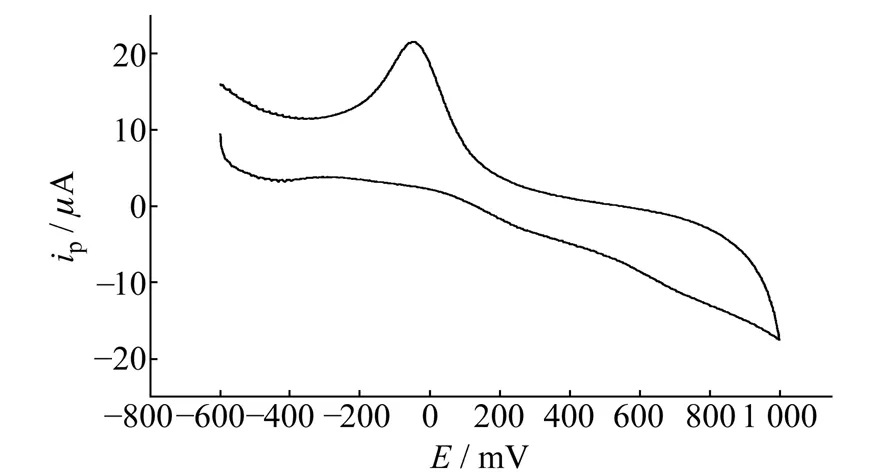
图2 灭多威的循环伏安图Fig.2 Cyclic voltammogram of methomyl cmethomyl=0.1 mg/L.
2.2 循环伏安曲线
在pH值为7.73的PBS中,对浓度为0.1 mg/L的灭多威在-0.6~1.0 V范围内连续进行CV扫描(图2)。可以看到,灭多威在-0.041 V处有良好的还原峰,其峰电流为22.99 μA,但无明显的氧化峰。说明灭多威在铂电极上的反应是一个不可逆的还原过程。
2.3 底液pH值的影响
当PBS的pH为弱酸性时,灭多威的峰电流随pH的增大而增大,当pH增至接近中性时,峰电流呈下降趋势,而在pH值为7.38和7.73的PBS中峰电流较大(图3)。由图4可知,峰电位则随底液pH值的增大而负移,并呈线性关系,其线性方程为:Ep(mV)=0.5924-0.0825pH(r=-0.9931)。为获得较高灵敏度和好的峰形,本实验选择底液PBS的pH=7.73。

图3 底液pH对灭多威峰电流的影响Fig.3 Effect of pH on peak current of methomyl cmethomyl=1.0 mg/L.

图4 底液pH对灭多威峰电位的影响Fig.4 Effect of pH on peak potential of methomyl cmethomyl=1.0 mg/L.
2.4 扫描速度的影响
采用CV法扫描,扫速范围为10~2 000 mV/s,灭多威浓度分别为0.1、1.0、10 mg/L。结果表明,在不同浓度而相同富集时间下,当浓度较大时,峰电流与扫描速度呈线性关系,而与扫描速度的平方根呈向上弯的曲线;当灭多威浓度较小时,峰电流与扫描速度同样呈线性关系,且峰电流与扫描速度的平方根呈向上弯的曲线。表明电极过程主要受吸附控制。实验最终选择扫速为100 mV/s。
2.5 灭多威的标准曲线及检测限

图5 灭多威的工作曲线;内插图为灭多威的DPV图Fig.5 The working curve of methomyl;Insert is differential pulse voltammogram of methomyl from bottom to top:0.6,0.7,0.8,0.9,1.0 mg/L.
利用DPV法对不同浓度灭多威进行了检测,发现其DPV峰电流(y)与与灭多威浓度(x)成正比,线性方程为:y=8.8985x-0.5876(r=0.9926),线性范围为0.6~1.0 mg/L,检测限为0.076 mg/L(图5)。
2.6 机理初探
根据峰电位EPC与扫速对数lgv线性关系式:-EPC(V)=0.0974lgv+0.1127;峰电位EPC与pH关系式:-EPC(V)=0.0825pH-0.5924。由EPC与lgv线性关系的斜率0.0974,根据不可逆吸附波:EPC(V)/lgv=2.303RT/αnF,求得αn=0.61。α=0.5,求得电子转移数n为1.22,即n≈1。依据能斯特方程:∂E/∂pH=0.0974m/n,n=1,可知参 加电极过程的质子数m=1.18,即有1个质子参加了反应。
2.7 实际样品测定
称取3份新鲜青菜菜叶各20 g,剪成约1 cm2的碎片后,用移液枪分别吸取0.1 mL 60 mg/L、70 mg/L、80 mg/L 灭多威溶液,将其喷洒于菜叶样品上,标记为1、2、3号样品。24 h后,分别将加标后各青菜样品置于100 mL具塞三角瓶中,加入70 mL乙腈振荡提取1 h,抽滤,收集滤液。将滤液移入100 mL具塞量筒中,加入5 g NaCl,剧烈振荡。静置分层30 min,弃去水相,用移液管取上层乙腈相,于温度40 ℃水浴槽上旋转蒸发至近干,收集浓缩液。在内径为0.8 cm玻璃层析柱中依次装填4 g无水Na2SO4、3 g硅胶、4 g无水Na2SO4。先用10 mL石油醚预淋,然后将所收集浓缩液转移至层析柱中,再用100 mL淋洗液(石油醚与丙酮体积比为8∶2)进行淋洗[8]。弃去前面40 mL,收集后60 mL淋洗液,再于40 ℃水浴槽上用旋转蒸发仪浓缩收集约0.5 mL,待测。
分别移取0.25 mL待测样品到小烧杯中,加入PBS稀释到5 mL,使其质量浓度分别为0.6、0.7、0.8 mg/L。然后采用DPV法扫描,得到电流响应值,代入DPV标准工作曲线得到灭多威实际测出量。结果发现加标回收率在83.88%~95.59%之间,平均回收率在87.85%~90.50%之间,相对标准偏差(RSD)为4.13%~6.36%,均符合农残分析要求。结果见表1。在同样的实验条件下进行测定,青菜空白样品中无明显响应电流值,未检出,说明青菜未被灭多威污染或灭多威残留量未超标。

表1 不同添加量下灭多威的回收率
2.8 干扰实验
在本实验条件下,浓度为0.1 mg/L的灭多威于-0.041 V处有良好的还原峰,而10倍浓度的乙酰甲胺磷、甲胺磷、甲基对硫磷、克百威、涕灭威在同条件下无信号,表明10倍浓度的上述农药均不干扰灭多威的测定。
青菜样品经过提取净化等前处理后,青菜基质中的糖类、蛋白质、色素、纤维素、维生素等杂质被大量除去。由于电化学的高度选择性,在本实验条件下,经过前处理后的样品中的无机离子均不干扰农药残留量的测定,样品中的微量糖类、蛋白质在铂电极上无还原性,也不干扰测定,微量的维生素在铂电极上具有还原性,但其峰位于-600 mV以后,对于该体系也不干扰,纤维素、色素几乎在前处理中被全部除去,也不干扰测定。
3 结论
利用电化学分析仪对灭多威农药进行直接电化学测定,实验表明灭多威电极反应具有不可逆性。采用DPV法检测灭多威,线性范围为0.6~1.0 mg/L,线性相关系数为0.9926,检测限达到0.076 mg/L。该方法可用于蔬菜中灭多威残留量的测定。
