L-半胱氨酸和镍分层修饰电极的制备及对黄岑苷的测定
2015-10-17汤优霞汪燕鸣孙登明
汤优霞, 汪燕鸣, 孙登明*
(淮北师范大学化学与材料科学学院,安徽淮北 235000)
黄芩苷(Baicalin)是从黄芩根中提取并分离出来的一种黄酮类化合物,它具有显著的生物活性和抗炎、解痉、抑菌及利尿作用,并且还有相对较强的抗癌反应等生理效能。黄芩苷在临床医学占有重要地位,主要用来治疗肝炎。此外黄芩苷还能吸收紫外线,清除氧自由基,抑制黑色素的形成,也是一种功能性很好的美容化妆品原料。因此研究其准确、简单和高灵敏度的测定方法具有重要意义。近年来,测定黄岑苷常见的方法有高效液相色谱(HPLC)法[1]、毛细管电泳(CE)法[2]、近红外(NIR)光谱法[3,4]、超高效液相色谱-串联质谱(UPLC-MS/MS)法[5,6]和液相色谱-串联质谱(LC-MS/MS)法[7,8]等。黄岑苷具有良好的电化学活性[9],但在未修饰电极上的过电位较大,灵敏度一般较低。化学修饰电极可减少过电位,提高测定的灵敏度和选择性[10,11],而通过金属掺杂可进一步提高测定的灵敏度,并通过掺杂的金属提高电极的导电性,减小背景电流等[12]。但掺杂的金属在测定过程中由于电位的变化,可导致修饰在电极表面的金属在测定过程中流失,影响测定的精密度和准确度。
本研究将两种具有催化活性的L-半胱氨酸和Ni通过分层修饰的方法,先将Ni修饰在电极表面,再将氨基酸聚合在Ni表面,制备了L-半胱氨酸和Ni分层修饰电极(PLC/Ni/GCE)。该修饰电极不仅保留了两者的催化活性,且由于Ni表面聚合了一层氨基酸,使Ni在测定过程中不会因为测定电位的变化而脱落,提高了电极的稳定性和测定的精密度。将该电极用于样品中黄岑苷的测定,获得了比较满意的结果。
1 实验部分
1.1 仪器与试剂
BAS电化学分析系统(美国,BAS公司);pHS-3C精密酸度计(上海康仪仪器有限公司);Zennium电化学工作站(德国,Zahner公司)。研究用三电极系统:PLC/Ni/GCE或玻碳电极(GCE)为工作电极,铂电极为辅助电极,Ag/AgCl电极为参比电极。
黄岑苷(纯度≥98%,上海纯优生物科技有限公司)溶液:5.0×10-3mol/L,使用时稀释至实验所需浓度,避光冷存;L-半胱氨酸溶液:5.0×10-3mol/L;Ni(NO3)2溶液:1.0×10-2mol/L;HNO3:1.5 mol/L;磷酸盐缓冲溶液(PBS,pH=2.5~9.0):用0.1 mol/L的NaOH、NaH2PO4、Na2HPO4、H3PO4溶液配制,在酸度计上校正。
1.2 L-半胱氨酸和Ni分层修饰电极的制备
将GCE按文献方法[13]预处理后,放入10 mL含2.0 mL 0.010 mol/L Ni(NO3)2和3.5 mL 1.5 mol/L HNO3的溶液中,采用三电极系统,设置电位范围为-0.4~-0.8 V,静置30 s,以100 mV/s扫描速率,循环伏安(CV)法扫描6圈,取出,用水淋洗,滤纸吸干,即制得Ni修饰电极(Ni/GCE)。将该电极作为工作电极放入含5.0 mL 5.0×10-3mol/L L-半胱氨酸溶液和5.0 mL pH=4.0的PBS的聚合溶液中,用三电极系统,在-0.9~2.4 V电位范围内,静置5 s,再以160 mV/s扫描速率,CV法扫描8圈,取出,用水淋洗,晾干,即制得L-半胱氨酸和Ni分层修饰电极(PLC/Ni/GCE)。
1.3 实验方法
于10 mL容量瓶中,加一定量的黄岑苷标准溶液,5.0 mL pH=2.5的PBS,用水稀释至刻度,摇匀,转移到电解池中,以PLC/Ni/GCE为工作电极,铂电极为辅助电极,Ag/AgCl电极为参比电极,在-0.2~0.9 V的电位范围内,静置90 s,利用差分脉冲伏安(DPV)法进行扫描,记录峰电位和峰电流。每次扫描实验结束后,把修饰电极放入到空白液中,扫至无峰,即可进行下一次实验测定。
2 结果与讨论
2.1 修饰电极的最佳聚合条件
Ni修饰电极采用循环伏安沉积法,Ni(NO3)2用量和酸度、循环电位区间、扫描圈数、扫描速率都对黄岑苷的灵敏度、线性范围有较大的影响。由于是将Ni沉积在电极表面,当沉积条件改变时会影响沉积在电极表面Ni的性质,影响Ni的催化效果。实验结果表明,Ni修饰在电极表面的最佳实验条件为:0.010 mol/L Ni(NO3)2的用量为2.0 mL,1.5 mol/L HNO3的用量为3.5 mL,扫描电位范围为-0.8~-0.4 V,扫描速率为100 mV/s,扫描6圈,静置时间为30 s。
分层修饰L-半胱氨酸时,聚合液的酸度、聚合电位区间、聚合圈数也影响测定黄岑苷的灵敏度和线性范围。实验结果表明,将Ni修饰电极放入含5.0 mL 5.0×10-3mol/L的L-半胱氨酸和5.0 mL pH=4.0 PBS的聚合液中,聚合电位为-0.9~2.4 V,扫描速率为160 mV/s,扫描8圈,静置时间为5 s时,分层聚合修饰电极对黄岑苷的响应电流最大。
2.2 修饰电极的表征
分别采用扫描电镜(SEM)和电化学阻抗技术对修饰电极进行了表征。图1是GCE、Ni/GCE和PLC/Ni/GCE的SEM图,从第二幅图可以看出,Ni均匀的修饰在电极表面,再将氨基酸修饰后,从第三幅图看出电极表面相对较为光滑,但可以看出聚L-半胱氨酸薄膜内部Ni颗粒的阴影,说明已按设计目标成功地将两者分层修饰在电极表面。

图1 GCE、Ni/GCE和PLC/Ni/GCE的扫描电镜(SEM)图Fig.1 SEM images of GCE,Ni/GCE and PLC/Ni/GCE
图2中的曲线a和b分别表示GCE和PLC/Ni/GCE在0.1 mol/L[Fe(CN)6]3-/4-的含0.1 mol/L KCl溶液中的阻抗谱。从图中可以清楚看出,PLC/Ni/GCE的Nyquist点是直线,说明电极表面是受扩散控制的,GCE有一个圆弧,这是由反应动力学控制。同时,GCE的阻抗大于PLC/Ni/GCE的阻抗,这是因为Ni和L-半胱氨酸分层修饰所起到的效果决定的,同时说明电极分层修饰后增大了电子的传递速率。
2.3 黄岑苷在修饰电极上的电化学行为
2.3.1黄岑苷的循环伏安特性图3表示浓度为5.0×10-5mol/L的黄岑苷在pH=2.5的PBS中,分别在GCE(1)、Ni/GCE(2)、PLC/GCE(3)和PLC/Ni/GCE(4)上的循环伏安图。由图3可知,在-0.4~1.0 V电位扫描区间,黄岑苷在GCE上相应的峰电流较小,而在Ni/GCE、PLC/GCE和PLC/Ni/GCE上其对应的峰电流较大。说明这三种修饰电极对黄岑苷都具有催化效果,且PLC/Ni/GCE的催化效果最好,氧化峰和还原峰的电流都达到最大值。在PLC/Ni/GCE上,黄岑苷的峰电位分别为Epa=0.498 V、Epc=0.414 V,△Ep=0.084 V。由此表明Ni和L-半胱氨酸分层修饰在GCE表面后,修饰电极对黄岑苷的催化作用和灵敏度得到了较大的增强。
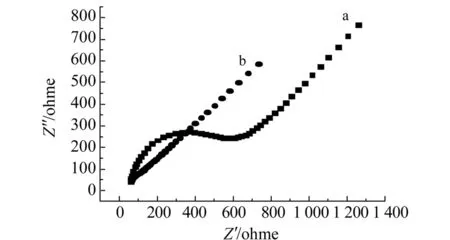
图2 GCE(a)和PLC/Ni/GCE(b)在0.1 mol/L[Fe(CN6)]3-/4-含0.1 mol/L KCl溶液中的Nyquist图Fig.2 Nyquist impedance plots of the bare GCE(a) and PLC/Ni/GCE(b) in 0.1 mol/L[Fe(CN)6]3-/4- solution containing 0.1 mol/L KCl
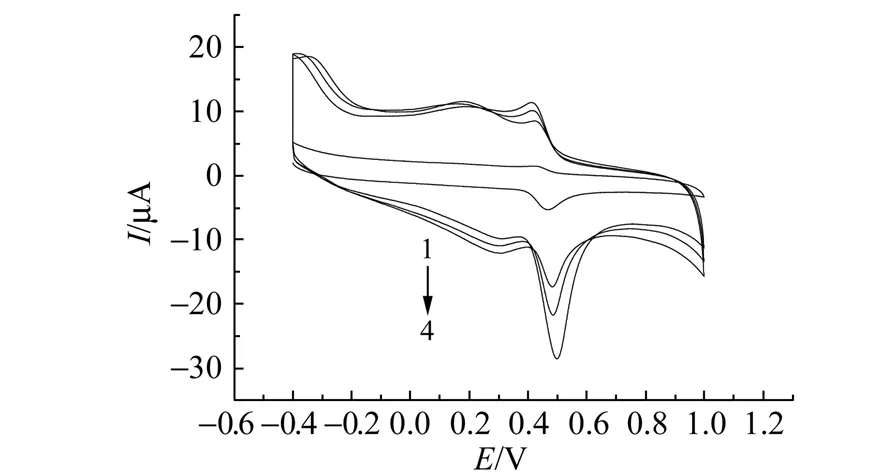
图3 黄岑苷在GCE(1)、Ni/GCE(2)、PLC/GCE(3)、和PLC/Ni/GCE(4)上的循环伏安图Fig.3 Cyclic voltammograms of baicalin at GCE(1),Ni/GCE(2),PLC/GCE(3) and PLC/Ni/GCE(4) PBS:pH=2.5;scan rate:60 mV/s.
2.3.2底液酸度的影响图4为改变底液酸度用CV法测得的结果,在pH=2.5~9.0的范围内,峰电位随着pH值的增大向负方向移动,并且与pH呈线性关系:Epa(V)=0.6745-0.06513pH,R=0.9964,斜率为65 mV/pH,斜率接近0.59 mV/pH。由此可以说明,在修饰电极上黄岑苷发生等电子等质子反应过程。当pH为2.5时,黄岑苷在PLC/Ni/GCE的响应电流达到最大值。

图4 (A)5.0×10-5 mol/L黄岑苷在PLC/Ni/GCE上随pH值变化的循环伏安图;(B)峰电位与pH值的关系曲线Fig.4 (A)Cyclic voltammograms of 5.0×10-5 mol/L baicalin at PLC/Ni/GCE with various pH;(B)The corresponding relationship curve between the peak potential and pH pH:1-14:2.5,3.0,3.5,4.0,4.5,5.0,5.5,6.0,6.5,7.0,7.5,8.0,8.5,9.0.

图5 (A)5.0×10-5 mol/L黄岑苷在不同扫速下的循环伏安图;(B)lgIpa对lgv关系曲线Fig.5 (A)Cylic voltammograms of 5.0×10-5 mol/L baicalin at PLC/Ni/GCE with various scan rates;(B)The corresponding relationship curve between lgIpa and lgv scan rate:a-o:0.02,0.04,0.06,0.08,0.10,0.12,0.14,0.16,0.18,0.20,0.24,0.28,0.32,0.36,0.40 V/s.
2.3.3扫描速率对黄岑苷电化学行为的影响图5为固定pH=2.5的PBS,仅改变扫描速率进行实验的CV图。从结果可知,在20~400 mV/s范围内,随着扫描速率逐渐增大,黄岑苷在PLC/Ni/GCE上的响应电流亦随之增大;但可逆性也随着扫描速率(v)的增大而变差。以lgI对lgv作图,线性回归方程为:lgIpa=-0.3522+0.9700lgv,r=0.9990,斜率值为0.9700,接近1。说明黄岑苷在PLC/Ni/GCE电极上的电化学行为受吸附控制。由吸附量公式[14]计算,在扫速为60 mV/s,pH=2.5底液中,对5.0×10-5mol/L 黄岑苷进行测定,得出黄岑苷在电极表面吸附量Γ为4.31×10-9mol/cm2。
扫速在100~400 mV/s范围内,Epa与lnv呈线性关系,线性方程为:Epa=0.1045+0.0721lnv,R=0.9908。根据文献报道[15],E~lnv方程中的斜率等于RT/anF。其中,电子传递系数a一般取理论值0.5,n为得失电子数,F为法拉第常数,R为气体常数,T为绝对温度,求得黄岑苷参与电极反应的实际得失电子数为0.71,接近1。
2.4 差分脉冲法测定黄岑苷的最佳条件
采用差分脉冲伏安(DPV)法对5.0×10-5mol/L的黄岑苷进行测定,实验结果表明,静置时间对黄岑苷的峰电流影响较大,随着静置时间的增大,峰电流也逐渐增大,当静置时间为90 s时,峰电流达到最大,之后趋于稳定,故选择静置时间为90 s。
采用DPV法对黄岑苷进行测定。仪器参数设置如下,扫速:60 mV/s;电位增量:0.006 V;脉冲振幅:0.05 V;脉冲宽度:0.06 s;脉冲间隔:0.2 s;静置时间:90 s。
2.5 黄岑苷工作曲线、检出限、精密度和稳定性
采用DPV法对黄岑苷进行测定,结果见表1。由表1可知,PLC/Ni/GCE有较好的灵敏度和较宽的线性范围。用PLC/Ni/GCE对5.0×10-5mol/L 黄岑苷进行20次平行实验,相对标准偏差(RSD)为2.2%。表明PLC/Ni/GCE对黄岑苷的测定具有良好的精密度。黄岑苷测定的峰电位和峰电流分别为:E1=0.498 V,Ipa1=-20.44 μA,PLC/Ni/GCE在室温下放置20 d,再次测定时,峰电位和峰电流分别为E2=0.497 V,Ipa2=-20.46 μA:说明PLC/Ni/GCE具有良好的稳定性。
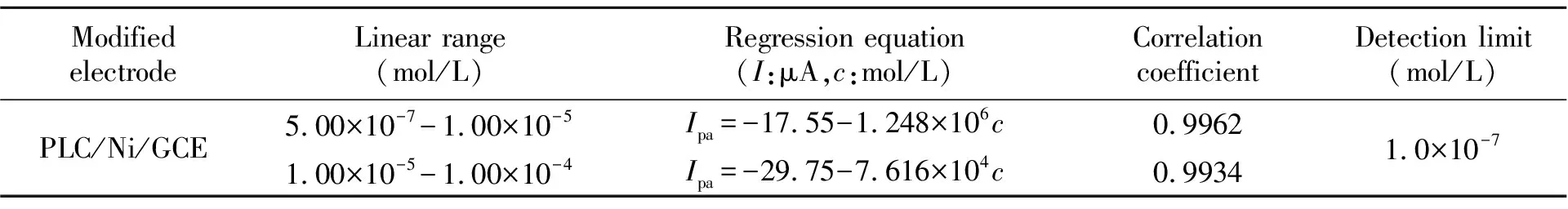
表1 PLC/Ni/GCE测定黄岑苷的结果
2.6 干扰实验

2.7 样品分析
取样品柴黄片,研碎后称取一定量,用0.1 mol/L NaOH溶液加热溶解后,用PBS调节酸度,移至100 mL容量瓶中定容,按实验方法取一定量的样品溶液进行测定,分析结果如表2所示。

表2 样品中黄岑苷的分析结果(n=6)
3 结论
本实验制备了L-半胱氨酸和镍分层修饰电极,通过考察黄岑苷在该修饰电极上的电化学行为,证明了该电极对黄岑苷有较强的催化作用,检测的灵敏度和精密度高,且电极稳定性好,有较好的应用前景。
