基于EPOR、HMGA2表达变化探讨康莱特防治进展期胃癌的临床研究
2015-10-17李华燕李斌黄建斌陈利民
李华燕 李斌 黄建斌 陈利民
(广东省江门市第二人民医院江门529050)
基于EPOR、HMGA2表达变化探讨康莱特防治进展期胃癌的临床研究
李华燕李斌黄建斌陈利民
(广东省江门市第二人民医院江门529050)
目的:观察胃癌患者治疗前后Karnofsky评分以及EPOR、HMGA2表达变化,探讨康莱特注射液防治胃癌的机制研究。方法:48例符合诊断标准、纳入标准、排除标准的胃癌患者按就诊顺序1∶1分为对照组与治疗组。对照组给予化疗药物治疗,治疗组给予康莱特注射液联合化疗药物治疗,两组均治疗2个疗程。应用Karnofsky评分记录两组患者治疗前后生活质量积分变化,应用免疫组化技术检测两组治疗前后EPOR、HMGA2表达变化。结果:全部病例完成临床观察,治疗组完全缓解0例、部分缓解8例、稳定10例、进展6例,总有效率为75.0%;对照组完全缓解0例、部分缓解7例、稳定8例、进展9例,总有效率为62.5%:两组总有效率比较差异有统计学意义(P<0.05)。治疗前,两组患者Karnofsky评分比较差异无统计学意义(P>0.05)。治疗后治疗组Karnofsky评分高于对照组,且治疗8周后两组比较差异具有统计学意义(P<0.05)。治疗组EPOR、HMGA2表达水平呈下降趋势,较治疗前差异有统计学意义。对照组EPOR、HMGA2表达水平较治疗前无明显变化。结论:康莱特注射液可能通过调控EPOR、HMGA2表达水平,提高患者生存质量,有效缓解其临床症状。
胃癌;促红细胞生成素受体;高迁移率族蛋白A2;康莱特
胃癌在我国发病率位于所有恶性肿瘤首位,年平均死亡率为25.53/100 000,而肿瘤的转移是治疗失败的主要原因[1]。上皮细胞间质化(Epithelial-Mesenchymal Transitions,EMT)是一种与肿瘤侵袭转移密切相关的一种生理现象,研究发现高迁移率族蛋白A2(High Mobility Group Protein A2,HMGA2)可促进肿瘤细胞EMT发生,增加肿瘤发生浸润、转移的能力[2~3]。促红细胞生成素(Erythropoietin,EPO)是一种糖蛋白造血细胞生长因子,主要由人体中的肾小管周围毛细血管床的间质细胞产生,EPO与促红细胞生成素受体(EPOR)结合调控红系干细胞增殖、分化、成熟,促进网织红细胞释放入血的生物学作用。Lin等[4]研究发现EPO/EPOR的表达在胃癌组织中呈上升趋势,与胃癌的生长、浸润及转移密切相关。目前化疗是进展期胃癌的主要治疗手段之一,由于进展期胃癌的预后与患者状况、病理类型、分期、肿瘤本身的生物学行为等多因素有关,应制定合理的综合治疗方案,以最大限度地改善患者的预后,延长患者的生存期[5]。近年来,康莱特注射液治疗进展期胃癌的临床疗效得到了广泛认同,能有效提高患者免疫力及降低不良反应[6]。笔者采用康莱特注射液联合化疗药物治疗胃癌,与单纯化疗药物治疗进行对照,通过观察主要效应指标Karnofsky评分变化及EPOR、HMGA2表达,探讨康莱特注射液防治胃癌转移的效用机制及临床疗效。
1 临床资料
1.1病例来源全部病例均为2012年1月~2014年9月江门市第二人民医院消化科住院患者48例。将患者按就诊顺序随机分为治疗组和对照组各24例。治疗组男11例,女13例;年龄最小43岁,最大69岁,平均(52.43±11.60)岁;平均病程(2.20± 1.61)年;其中Ⅲ期14例,Ⅳ期10例。对照组男12例,女12例;年龄最小42岁,最大67岁,平均(53.62±11.80)岁;平均病程(2.35±1.11)年;其中Ⅲ期13例,Ⅳ期11例。两组一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2西医诊断标准根据中华人民共和国卫生部2010年颁布的《胃癌诊断标准》及美国联合委员会(AJCC)2010年第七版胃癌TNM分期。
1.3纳入标准(1)符合胃癌诊断标准并具备病理诊断;(2)TNM分期为Ⅲ期及Ⅳ期患者;(3)年龄40~70岁;(4)入组前3个月内未接受放、化疗;(5)经患者及家属签署知情同意书。
1.4排除标准(1)无法配合治疗的患者;(2)伴随其他恶性肿瘤者;(3)孕妇及哺乳期妇女;(4)合并心、肝、肾严重损害或骨髓功能异常者。
2 研究方法
2.1研究设计采用开放随机平行对照方法,48例符合诊断标准、纳入标准的胃癌患者分为对照组、治疗组。对照组给予化疗药物:第1天紫杉醇135 mg/m2静脉滴注3 h,第1~5天顺铂20 mg/m2、5-氟尿嘧啶500~700 mg/m2静脉滴注。使用紫杉醇前12、6 h分别给予地塞米松8 mg口服,紫杉醇用药前半小时予地塞米松5 mg静脉推注、苯海拉明50 mg肌肉注射、西咪替丁300 mg静脉滴注预处理。治疗组在给予化疗药物同时联合应用康莱特100 ml静脉滴注。用药4周为1个疗程,连续治疗2个疗程后评价疗效。
2.2观察指标
2.2.1主要效应指标采用Karnofsky评分标准[7~9],评价生活质量评分的变化,治疗组和对照组分别在治疗前和治疗后各评定一次。100分能进行正常活动,无症状和体征;90分能进行正常活动,有轻微症状和体征;80分勉强可进行正常活动,有一些症状和体征;70分生活可自理,但不能维持正常生活或工作;60分有时需人扶助,但大多时间可自理;50分常需人照料;40分生活不能自理,需增加特殊照顾;30分生活严重不能自理;20分病重,需住院积极支持治疗;10分病危,临近死亡;0分死亡。治疗前后评分增加≥10分者为好转,增加或减少未超过10分者为稳定,评分减少超过10分者为恶化。
2.2.2次要效应指标应用免疫组化法检测胃黏膜组织中EPOR、HMGA2表达变化。
2.3检测方法按照免疫组化SP法染色试剂盒说明书进行操作。用已知阳性组织切片作为阳性对照以PBS液代替一抗为阴性对照。根据样本阳性细胞百分比和染色强度综合评分,10个随机高倍镜视野下无阳性细胞计0分,<25%计1分,25%~50%计2分,51%~75%计3分,>75%计4分。染色强度计分:未着色0分,淡黄色1分,棕黄色2分,棕褐色3分。根据样本阳性细胞百分比和染色强度计分之和的结果分为:0~3分为阴性或弱阳性,4分为阳性和强阳性。
2.4疗效评价标准根据主要效应指标Karnofsky评分指数评价,并参照WHO实体瘤疗效评价标准[10],分为完全缓解(CR)、部分缓解(PR)、稳定(SD)、进展(PD)进行判定。2个疗程后评价疗效,其中总有效率=(CR+PR+SD)例数/总例数×100%。
2.5统计学方法数据处理采用SPSS16.0统计学软件包处理,计量资料采用均数±标准差(±s)表示,组间比较采用t检验,计数资料采用X2检验,检验水准α=0.05,P<0.05为差异具有统计学意义。
3 研究结果
3.1两组临床疗效比较见表1。
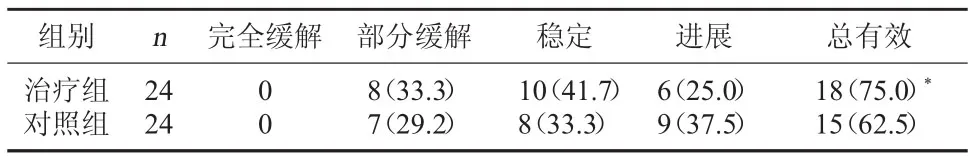
表1 两组临床疗效比较[例(%)]
3.2两组不同时期Karnofsky评分比较两组经过治疗后,治疗组Karnofsky评分高于对照组,且治疗8周后两组比较差异具有统计学意义。见表2。
3.3两组患者不良反应比较两组经过治疗后,治疗组胃肠道反应率为37.5%,白细胞减少发生率为29.2%,贫血发生率为20.8%,血小板减少发生率为25.0%,转氨酶升高发生率为16.7%,过敏反应发生率为0.0%;而对照组胃肠道反应率为62.5%,白细胞减少发生率为62.5%,贫血发生率为45.8%,血小板减少发生率为45.8%,转氨酶升高发生率为29.2%,过敏反应发生率为0.0%:两组比较,差异有统计学意义(P<0.05),治疗组不良事件反生率低于对照组。见表3。
表2 两组不同时期临床Karnofsky评分比较(分,±s)

表2 两组不同时期临床Karnofsky评分比较(分,±s)
注:治疗组:治疗后VS治疗前,t=10.258,P=0.024;对照组:治疗后VS治疗前,t=11.376,P=0.036。治疗后:治疗组VS对照组,治疗4周后比较,t= 1.234,P=0.238;治疗8周后比较,t=12.212,◇P=0.043。
组别n治疗前治疗4周后治疗8周后治疗组对照组24 24 41.32±6.2 42.64±5.1 59.65±5.5 55.45±4.3 65.13±5.2◇60.28±3.1

表3 两组患者不良反应比较(例)表1两组临床疗效比较
3.4两组治疗前后EPOR、HMGA2表达水平比较治疗组经过治疗后胃黏膜组织中EPOR、HMGA2阳性表达水平均明显下降(P<0.05);对照组胃黏膜组织中EPOR、HMGA2表达水平较治疗前无明显变化。见表4。
表4 两组治疗前后EPOR、HMGA2表达水平比较(%±s)

表4 两组治疗前后EPOR、HMGA2表达水平比较(%±s)
注:治疗组:治疗后VS治疗前,t=2.699,P=0.017;对照组:治疗后VS治疗前,t=0.637,P=0.537。
组别n时间EPORHMGA2治疗组对照组24 24治疗前治疗后治疗前治疗后3.60±0.32 2.01±0.11 2.33±0.12 2.20±0.15 3.07±0.26 2.10±0.25 2.45±0.30 2.32±0.31
4 讨论
胃癌的发病率及病死率非常高,其侵袭和转移是影响胃癌患者预后及死亡的重要原因。传统化疗是胃癌的主要治疗手段之一,但有效率低,不良反应大。晚期胃癌患者多伴有食欲不振、消瘦、食欲减退等恶病质情况,因此生存质量较低。本研究采用的康莱特注射液主要成分是从薏苡仁中提取的薏苡油。薏苡仁是禾本科植物的成熟种仁,性甘、淡、微寒,归脾、胃、肺经,具有渗湿利水、健脾止泻、舒筋、清热排脓之功效。有研究[11]表明康莱特注射液能够诱导肿瘤细胞凋亡,阻滞肿瘤细胞有丝分裂,杀伤癌细胞及提高免疫功能,同时还可减轻放疗、化疗的毒副作用,缓解疼痛,稳定病情,提高患者的生活质量,并在预防肿瘤的复发、转移中具有重要的意义。王灿等[12]通过循证医学分析也同样证实了康莱特联合化疗治疗胃癌的有效性。本研究发现康莱特注射液联合化疗治疗晚期胃癌,总有效率较单用化疗高,并且能改善患者生存质量,改善骨髓抑制,减少化疗所产生的不良反应和对抗恶病质的产生。
高迁移率族蛋白(HMGs)是一类染色质相关非组蛋白,HMG包括HMGA、HMGB和HMGN 3个家族,高迁移率族蛋白A2(HMGA2)是其中重要的成员之一,其主要参与DNA损伤修复、基因转录调控等,在胚胎时期常高表达与细胞生长、分化等过程相关,一般成体组织中基本低表达或不表达[13]。HMGA2在肿瘤血管生成的过程中起重要作用。HMGA2可以通过AT-hooks与DNA结合,继而改变染色质的结构,使之发生弯曲、拉伸、卷曲、成环或解链,从而调节靶基因的转录,因此又被称为构筑性转录因子。作为一种结构转录因子,可以对大量基因的转录和活化进行调节,特别是那些与细胞增殖和凋亡相关的基因[14]。Ohshima等[15]认为HMGA2与Let-7家族负向调控,与胃癌的侵袭性相关。查郎等[16]认为胃癌临床转移和进展能力的主要机制可能是通过HMGA2上调其下游的目标基因Snail、Twist和Slug等表达,作为E-cadherin基因转录的抑制物,导致表达E-cadherin下调,细胞间极性丧失而诱发EMT,使之具有更强的侵袭转移能力,进而加快肿瘤进展。
人类EPO基因定位于7号染色体长臂22区(7q22),由166个氨基酸残基组成。EPO促进红细胞生成的生物学效应是通过位于骨髓红系祖细胞表面的特异性EPO受体介导完成。EPO与EPOR结合后,EPOR形成二聚体,再通过信号传导途径调节红系的增生和分化。有研究表明EPO/EPOR信号通路可影响肿瘤血管内皮微环境而导致肿瘤血管生成[17]。Yasuda[18]等通过标记被转移胃癌细胞的裸鼠体内的EPO/EPOR通路,可发现胃癌肿瘤血管形成,与EPO/EPOR的表达量具有一定的相关性。EPOR可能和微血管密度有协同作用,可促进肿瘤血管生成,从而使肿瘤的生长、增殖、侵袭并转移。
本研究发现治疗组可降低EPOR、HMGA2表达水平,而对照组却无明显变化。由此推测康莱特注射液治疗胃癌的疗效及胃癌患者生活质量的机制可能通过调节EPOR表达水平来减少肿瘤血管生成,抑制肿瘤生长,同时还可通过调控HMGA2的表达来抑制胃癌上皮间质转化从而降低胃癌细胞的侵袭性。但EPOR与HMGA2的表达调控是否具有相关性仍需进一步研究。
[1]Lambert R,Guilloux A,Oshima A,et al.Incidence and mortality from stomach cancer in Japan,Slovenia and the United States[J].Int J Cancer,2002,97:811-818
[2]Wunderlich V,Bttger M.High mobility group proteins and cancer an emerging link[J].J Cancer Res Clin Oncol,1997,123:133-140
[3]Tallini G,Cin P.HMGI(Y)and HMGI-C dyregulation:a common occurrence in human tumors[J].Adv Anat Pathol,1999,6:237-246
[4]Wang L,Li HG,Xia ZS,et al.Prognostic significance of erythropoietin and erythropoietin receptor in gastric adenocarcinoma[J].World J Gastroenterol,2011,17(34):3933-3940
[5]张亮,王亚非.康莱特注射液联合化疗对晚期胃癌的疗效及对免疫功能的影响[J].南京医科大学学报(自然科学版),2010,30(11): 1657-1659
[6]姚小健.康莱特注射液联合化疗治疗老年胃癌临床观察[J].肿瘤基础与临床,2015,28(2):160-161
[7]梁进,毕清,杨润祥.多西他赛联合奥沙利铂治疗进展期胃癌的临床观察[J].实用癌症杂志,2007,22(5):501-502
[8]张昉,陈雅敏,荆超,等.改良DCF方案与FOLFOX 4方案治疗晚期胃癌的临床疗效[J].临床肿瘤学杂志,2014,19(3):231-234
[9]Parkin DM,Bray F,Ferlay J,et al.Global cancer statistics,2002[J].CA Cancer J Clin,2005,55(1):74-108
[10]陆彬彬,王朝霞,王莉,等.参蔑扶正注射液对胃癌术后DFC方案辅助治疗毒副反应影响的临床观察[J].现代肿瘤医学,2013,21(3): 599-600
[11]林锐.康莱特联合化疗治疗晚期胃癌[J].中国实用医药,2013,8(19):9-11
[12]王灿,王权,何曦冉.康莱特联合化疗对进展期胃癌临床疗效的Meta分析[J].现代中西医结合杂志,2011,20(30):3774-3777
[13]Cleynen I,Van de Ven WJ.The HMGA proteins:a myriad of functions(Review)[J].Int J Oncol,2008,32:289-305
[14]陈家庄,赖铭裕,韦丽秀.shRNA沉默干扰HMGA2基因对胃癌细胞株MKN-45的增殖与凋亡的影响[J].世界华人消化杂志,2012,20(3):187-192
[15]Ohshima K,Inoue K,Fujiwara A,et al.Let-7 micro RNA family is selectively secreted into the extra-cellular environment via exosomes in a metastatic gastric cancer cell line[J].PLoS One,2010,5:e13247
[16]查郎,王子卫,张能.HMGA2与胃癌上皮细胞间质转化的相关性及临床意义[J].生命科学研究,2011,15(1):61-65
[17]Ribatti D,Poliani PL,Longo V,et al.Erythropoietin/erythropoietin receptor system is involvedin angiogenesis in human neuroblastoma[J].Histopathology,2007,50:636-641
[18]Yasuda Y,Fujita Y,Matsuo T,et al.Erythropoietin regulates tumor growthofhumanmalignancies[J].Carcinogenesis,2003,24: 1021-1029
Clinical Study of Kanglaite Injection in Treating Advanced Gastric Cancer Based on the Changed-expression of EPOR and HMGA2
LI Hua-yan,LI Bin,HUANG Jian-bin,CHEN Li-min
(The Second Peoples'Hospital of Jiangmen City,Jiangmen529050)
Objective:To explore the mechanism of Kanglaite injection by the observation of the changed-expression of the EPOR and HMGA2 and the Karnofsky score in the advanced gastric cancer patients before and after treatment.Methods:48 Patients meet the diagnostic criteria,inclusion criteria and exclusion criteria of advanced gastric cancer were divided into the control group and the treatment group according to the order of treatment.The control group was given chemotherapy drug,and the treatment group was given Kanglaite injection combined with chemotherapy drug.The life quality score was recored according to Karnofsky score before and after treatment.The expression of HMGA2 and EPOR were detected by immunohistochemical technique.Results:All the patients were completed the clinical observation,the total efficiency of the treatment group was 75.0%,the total efficiency of the control group was 62.5%,there was a statistical significant between the two groups(P<0.05).Before treatment,there was no significant difference between the two group in Karnofsky scores(P>0.05).But,the Karnofsky score of the treatment group was higher than that of the control group after treatment,and there was statistical significance between the two groups after second courses of treatment(P<0.05).Before the treatment,the expression of HMGA2 and EPOR were in the increment.Then the expression of HMGA2 and EPOR were on the decline after the treatment(P<0.05).The expression of HMGA2 and EPOR in the control group had no significant change(P>0.05).Conclusion: Kanglaite injection can effectively remissive the clinical symptoms of gastric cancer and improve the life quality by regulating the expression of EPOR and HMGA2.
Gastric cancer;Eerythropoietin receptor;High mobility group protein A2;Kanglaite injection
R735.2
B
10.13638/j.issn.1671-4040.2015.12.002
2015-11-10)
