不同淹水梯度对芦苇实生苗生长和部分生理特性的影响
2015-10-17高芳磊郭宏宇马成仓
梁 贝,高芳磊,郭宏宇,马成仓
(天津师范大学a.生命科学学院,b.天津市动植物抗性重点实验室,天津300387)
不同淹水梯度对芦苇实生苗生长和部分生理特性的影响
梁 贝,高芳磊,郭宏宇,马成仓
(天津师范大学a.生命科学学院,b.天津市动植物抗性重点实验室,天津300387)
为了解芦苇实生苗对淹水胁迫的适应能力与适应机理,在实验室条件下设置不同的淹水梯度,经过短期持续淹水后测定芦苇实生苗的生物量、抗氧化酶(SOD、POD和CAT)活性、丙二醛(MDA)含量、可溶性蛋白含量和叶绿素含量等生长与生理指标.结果表明:淹水深度3~6cm内,芦苇实生苗除了MDA含量较低外,其生物量、抗氧化酶活性、可溶性蛋白含量和叶绿素含量均高于不淹水实验组(对照组);淹水深度9~12 cm内,生物量、抗氧化酶活性、可溶性蛋白含量和叶绿素含量均低于对照组,MDA含量较高.这说明小于6cm的短期持续淹水能够促进芦苇实生苗的生长,淹水超过9cm则不利于其生长.
芦苇实生苗;淹水胁迫;抗氧化酶;可溶性蛋白;生物量
七里海湿地是天津古海岸与湿地国家级自然保护区的重要组成部分.该湿地属典型的芦苇沼泽,分为东七里海和西七里海两部分,东七里海为水库和苇田,西七里海为芦苇沼泽.近年来,由于湿地资源被不合理地开发利用,如当地居民将大面积的芦苇沼泽改成鱼塘或虾池[1],土壤和水资源环境遭到污染破坏,使得七里海湿地的芦苇面积大幅度减少,由20世纪50年代的7 168 hm2下降到现在的3 600 hm2,湿生和水生植物群落均受到严重干扰[2].
湿地原有植被的恢复是湿地生态系统恢复的关键因素.在湿地生态系统中,水文条件是湿地存在的决定性因子,不同植物对于水位的要求不同,而湿地环境中的水位会经常变化,淹水会在很大程度上改变植物生长的环境条件,从而影响植株的生理特性[3].如Kreuzwieser等[4]研究发现,淹水深度对植物的影响程度大于淹水持续时间的影响;也有研究表明,随着淹水深度的增加,植物受到的伤害也逐渐增大[5].因此认为,不同淹水梯度会直接影响湿地植物的生长发育及其在生境中的分布,进而影响群落的稳定性、生物多样性和群落的演替与建成,最终影响整个湿地生态系统的功能和效益[6].湿地植物对淹水梯度的响应已成为湿地生态学的重要研究内容之一.
芦苇(Phragmites communis Trim.)是禾本科(Gramineae)芦苇属(Phragmites)多年生植物,可进行营养繁殖和有性繁殖.自然生境中芦苇主要通过根茎的无性繁殖进行种群数量增加和面积扩展,但有性繁殖在新栖息地的开拓及受损群落的补充方面具有重要作用[7].芦苇种子在当年的秋季成熟,通过风传播,次年的生长季初期在土壤水分条件较好和风蚀作用强烈地带萌发,幼苗长成成年植株后会形成新的芦苇种群斑块[8].以往关于不同淹水深度、周期及频率影响芦苇生长、生理和生态学特性的研究中,均是通过野外调查和室内控制实验,以自然环境中形成的芦苇植株或根状茎盆栽的芦苇为研究对象[9-13],关于淹水对芦苇实生苗的影响未见报道.克隆植物的实生苗与分蘖苗在生长特性和定居成功率方面都存在明显差异.徐伟伟等[14]研究发现,互花米草(Spartina alterniflora)无性分株幼苗开始生长的时间早于种子萌发期,刚萌发出的实生苗与无性分蘖苗形态差异较大,后者的基茎粗、叶较宽、根系较深且幼苗健壮.相同栽培条件下,野古草(Arundinella hirta)分蘖苗的根、茎、叶的生长状况好于实生苗,繁殖时间也比实生苗早.本课题组前期研究发现,同分蘖苗相比,芦苇实生苗的根、茎和叶更纤细,第1年的生长速率也远低于分蘖苗.为了解芦苇实生苗对淹水胁迫的抗性,确认适宜芦苇实生苗生长的水分条件,本课题组研究了不同深度淹水胁迫对芦苇实生苗生长和生理特性的影响,以此为利用芦苇实生苗进行湿地生态恢复提供实验依据.
1 材料和方法
1.1 供试材料与实验设计
2013年11月于天津市七里海湿地采集芦苇种子带回实验室风干后储藏,2014年2月将芦苇种子播种至蛭石中培养,定期浇灌自来水和1/2 Hoagland营养液.待芦苇幼苗长至高度为24~29 cm时,将其移栽到装有1 kg风干土、直径12 cm的塑料花盆内,每盆21株,土壤深度为9 cm.经过14 d的幼苗复壮后(苗高30~35 cm),进行淹水处理,共分5组:(1)对照组(CK)不淹水,每3 d浇水1次,土壤含水量为25.9% ~27.8%;(2)3 cm淹水,即土壤表面有3 cm淹水;(3)6 cm淹水;(4)9 cm淹水;(5)12 cm淹水.每处理重复3次,实验期间每天10:00观测水位变化.
在室内光照培养架上培养芦苇幼苗,光照强度为300 μmol/(m2·s1),光暗比为14∶10,培养温度为(28± 5)℃.淹水胁迫30 d后,在8∶00—9∶00之间选取植株上部健康且完全展开的叶片(顶端往下3~6片)进行生长和生理指标的测定,每一指标重复测定3次.最后收获芦苇植株,洗净后分离地上部和根部,105℃杀青10 min,80℃烘干至恒重,测定其干重.
1.2 测定指标及方法
SOD的测定采用氮蓝四唑染色法[15],以抑制NBT光化还原反应的50%为1个酶活性单位(U);POD活性的测定采用愈创木酚法,以每分钟△A470变化0.01的酶量为1个酶活性单位(U);CAT活性的测定采用紫外分光光度法,以每分钟△A240减少0.1的酶量为1个酶活性单位(U);MDA含量的测定采用硫代巴比妥酸氧化法[16];可溶性蛋白含量的测定采用考马斯亮蓝G-250染色法[15].叶绿素用体积分数为80%的丙酮提取,分光光度法测定[17].
1.3 数据处理
采用SPSS17.0软件进行数据分析.采用单因素方差分析(one-way ANOVA)和最小显著差数法(LSD)比较不同处理组间的差异(p<0.05).
2 结果与分析
2.1 不同淹水梯度下芦苇实生苗的生物量
不同淹水梯度下,芦苇实生苗的生物量如图1所示.

图1 不同淹水梯度下芦苇实生苗的生物量Fig.1 Biomass of P.communisms seedlings exposed to different submergence stresses
由图1可知,淹水30 d后,随着淹水深度的增加,芦苇实生苗的地上部、地下部及总生物量均是先升高,在淹水深度为3 cm时达到峰值,此后下降.地上部生物量方面,淹水深度为3 cm和6 cm时,芦苇的地上部生物量高于对照组,淹水深度超过9 cm时,数值则显著低于对照组,各组之间的差异具有统计学意义(p<0.05).地下部生物量方面,在淹水深度3 cm和6 cm时数值最大,2个实验组的地下部生物量数值相近,与对照组之间的差异没有统计学意义(p>0.05);淹水深度为9 cm和12 cm的2个实验组中,芦苇地下部生物量相近,均低于其他3个实验组,差异具有统计学意义(p<0.05).总生物量方面,淹水深度3 cm和6 cm的2个实验组中,芦苇的总生物量高于对照组,淹水深度超过9 cm时,总生物量低于对照组,5个实验组之间的差异均具有统计学意义(p<0.05).
2.2 不同淹水梯度下芦苇实生苗的抗氧化酶活性
不同淹水梯度下,芦苇实生苗叶片的SOD、POD和CAT的活性如图2所示.
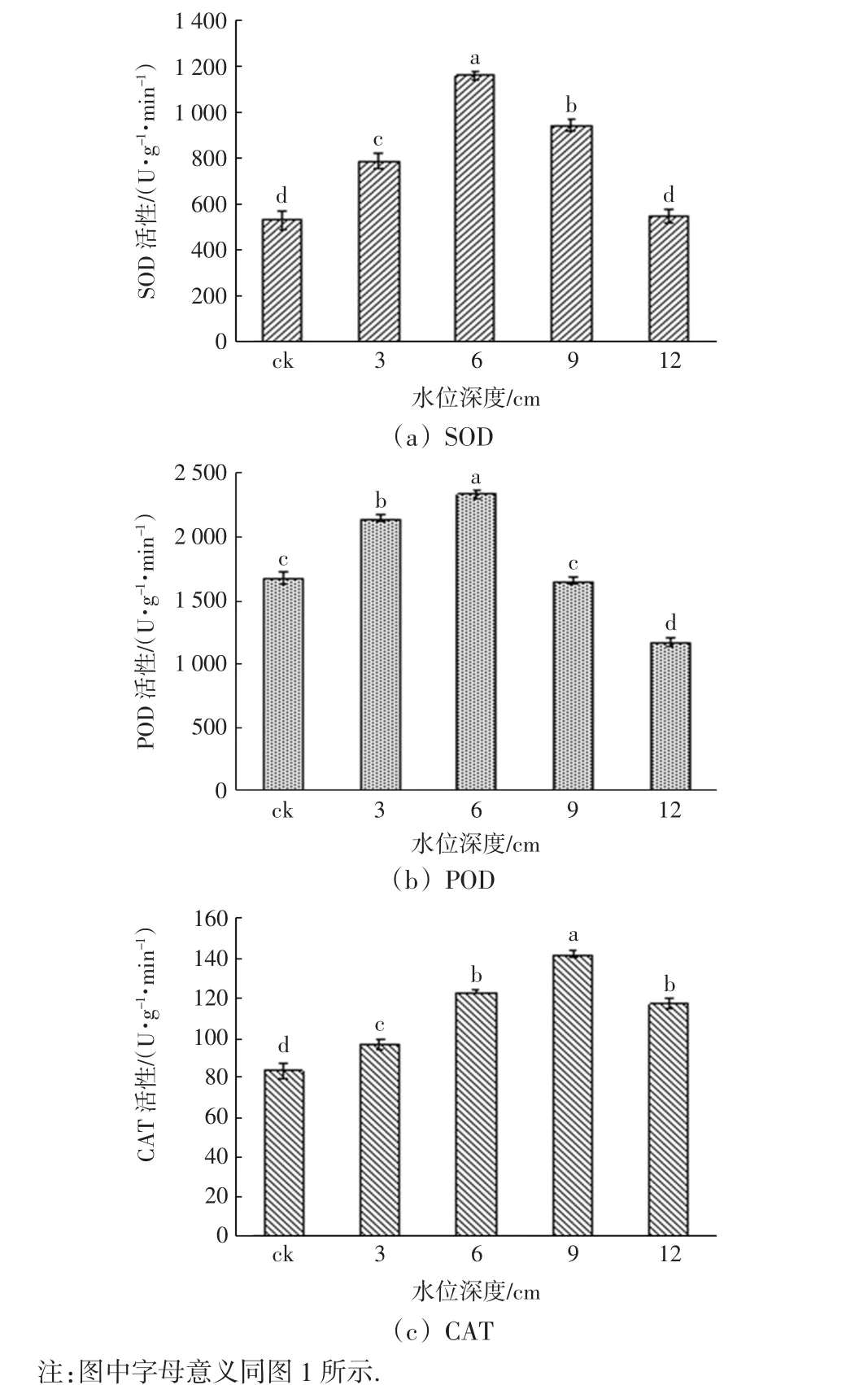
图2 不同淹水梯度下芦苇实生苗的SOD、POD和CAT活性Fig.2 SOD,POD and CAT activities of P.communis seedlings exposed to different submergence stress
从图2可以看出,随着淹水深度的增加,芦苇叶片SOD、POD和CAT活性均呈现先增加后降低的趋势.SOD活性方面,4个淹水实验组的数值均高于对照组,其中淹水6 cm实验组的数值最大,比对照组高出119%;其次是淹水9 cm的实验组,显著高于其余3个实验组;淹水3 cm实验组的SOD活性高于对照组和淹水12 cm的实验组;除了后2组数值相近外,其余各组之间的差异均具有统计学意义(p<0.05). POD活性中,仍是淹水6 cm实验组的数值最大,比对照组高39.3%;其次是淹水3 cm实验组;再次是对照组和淹水9 cm实验组,二者数值相近,均显著高于淹水12 cm实验组,差异具有统计学意义(p<0.05).CAT活性在淹水深度9 cm时达到最大,比不淹水高70.5%;其次是淹水6 cm和12 cm实验组,二者之间的差异没有统计学意义(p>0.05);再次是淹水3 cm实验组,显著高于对照组,差异具有统计学意义(p<0.05).
2.3 不同淹水梯度下芦苇实生苗的丙二醛含量
不同淹水梯度下,芦苇实生苗叶片的MDA含量如图3所示.从图3可以看出,淹水胁迫30 d后,随着淹水深度的增加,芦苇叶片MDA含量呈现先降低后上升的趋势.MDA含量在淹水深度3 cm时最小,淹水深度12 cm时,芦苇MDA含量高出对照组22.47%,差异具有统计学意义(p<0.05).
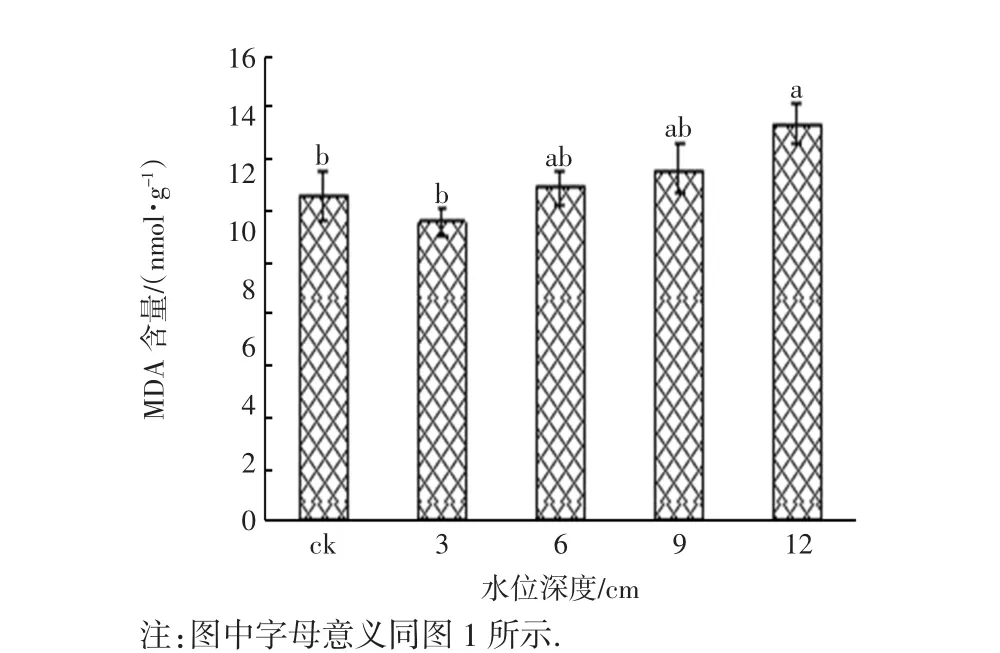
图3 不同淹水梯度下芦苇实生苗的MDA含量Fig.3 MDA contents of P.communis seedlings exposed to different submergence stresses
2.4 不同淹水梯度下芦苇实生苗的可溶性蛋白含量
不同淹水梯度下,芦苇实生苗叶片的可溶性蛋白含量如图4所示.从图4可以看出,淹水胁迫30 d后,随着淹水深度的增加,芦苇叶片可溶性蛋白含量呈现先上升后下降的趋势.可溶性蛋白含量在淹水深度3 cm时达到最大值,高出对照组6.54%,对照组、淹水深度3 cm和6 cm实验组的可溶性蛋白含量的差异不具有统计学意义(p>0.05);在淹水深度超过9 cm后,蛋白含量显著低于对照组,差异具有统计学意义(p<0.05).
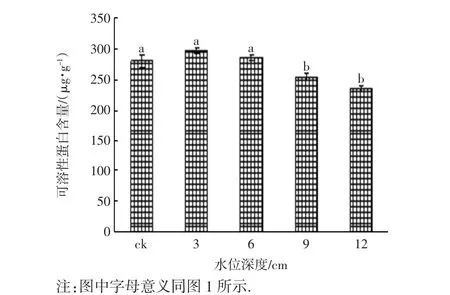
图4 不同淹水梯度下芦苇实生苗的可溶性蛋白含量Fig.4 Soluble protein contents of P.communis seedlings exposed to different submergence stresses
2.5 不同淹水梯度下芦苇叶片的叶绿素含量
不同淹水梯度下,芦苇实生苗叶片的叶绿素含量如图5所示.

图5 不同淹水梯度下芦苇实生苗的叶绿素含量Fig.5 Chlorophyll contents of P.communis seedlings exposed to different submergence stresses
由图5可以看出,随着淹水深度的增加,叶绿素a、b和总叶绿素含量均呈现先增加后降低的趋势,在淹水深度3 cm时达到峰值,分别比对照组提高了19.2%、12.7%和16.9%,同其他4个实验组之间的差异具有统计学意义(p<0.05).淹水深度6 cm和9 cm时,芦苇的叶绿素含量同对照组相近,差异不具有统计学意义(p>0.05);淹水深度12 cm时,芦苇的叶绿素含量显著低于其他4个实验组,差异具有统计学意义(p< 0.05).
3 讨论与结论
淹水会改变土壤的物理、化学及生物学特性,进而影响植物的生理生态性质.如淹水会造成植株缺氧而进行无氧呼吸,对营养物质的消耗增大;植物根部厌氧代谢产生的乙醇、乙醛等有害物质对细胞具有毒性,能够破坏蛋白质结构,导致细胞内氧自由基增加,保护酶活性下降,质膜透性增强,使植物细胞受到严重伤害.李玉昌等[18]研究发现,淹涝胁迫严重时水稻的蛋白质合成会受到抑制,蛋白分解增加.厌氧微生物也会产生对植物有害的物质.李萍萍等[19]研究发现,涝害会破坏植物体内的叶绿素,抗涝性越强的植物叶绿素含量变化越小.
耐淹植物受到水淹胁迫时能够产生积极的应对策略[20],体现为植株的生长和生理指标发生一系列有益的变化.植株受到淹水时根系供氧不足,ATP合成受到抑制,体内生成的活性氧和自由基增加,MDA含量的变化可反映活性氧和自由基对膜系统的伤害程度[21]. SOD、POD和CAT等抗氧化酶通过活性调控,能够有效地清除活性氧和自由基,使细胞免受毒害.
芦苇实生苗的淹水实验结果发现:在淹水深度3~ 6 cm范围内,叶片内3种抗氧化酶的活性均较高,MDA含量较低,即植物能够有效清除活性氧和自由基,同时芦苇幼苗的可溶性蛋白含量、叶绿素含量和植株生物量均高于未淹水的对照组.这说明适度淹水(3~6 cm)有利于芦苇实生苗的生长,与彭玉兰等[13]发现一定程度的淹水可以提高芦苇分蘖苗生物量的结果相似.超过9 cm的淹水处理下,芦苇实生苗的抗氧化酶活性下降,MDA含量上升,植株的可溶性蛋白含量、叶绿素含量和生物量积累均下降,即严重淹水会抑制芦苇实生苗的生长.
湿地生态系统会出现长期或季节性的积水,不同的湿地植物会通过调节生理机能和改变结构特征来适应环境的变化最终生存下来,维持种群的发展和更新.芦苇的克隆植株具有特殊的形态可塑性,可以通过增加间隔子的长度、分枝强度和分枝角度来扩大克隆植株在水平空间和垂直空间的觅食能力,因此芦苇无性繁殖产生的克隆植株会在一定范围内适应更深、更长时间的淹水,如崔保山等[11]研究发现30 cm水深条件下的芦苇密度和盖度最大.本研究中,小于6 cm的较低淹水深度对芦苇实生苗(30~35 cm)生长有促进作用,淹水深度过大(9~12 cm)则不利于芦苇幼苗生长,这说明芦苇实生苗和分蘖苗的耐淹水深度不同.本实验仅在室内盆栽条件下研究了淹水胁迫对芦苇实生苗部分生长和生理特性的影响,田间条件下芦苇实生苗对淹水深度、淹水频率和淹水持续时间等的响应尚需进一步研究.
[1]王祖伟,刘明舵,李兆江,等.七里海湿地生态系统退化与修复[J].水土保持研究,2005,12(5):244-248.
[2]陈清,高军,王中良,等.1984—2009年天津市典型芦苇沼泽变化特征及成因分析[J].湿地科学,2014,12(3):325-331.
[3] MIELKE M S,ALMEIDA A F,GOMES F P,et al.Leaf gas exchange,chlorophyll fluorescence and growth responses of Genipa Americana seedlings to soil flooding[J].Environmental and Experimental Botany,2003,50:221-231.
[4]KREUZWIESER J,PAPADOPOULOU E,RENNENBERG H.Interaction of flooding with carbon metabolism of forest trees[J].Plant Biology,2004,6(3):299-306.
[5]GILL C J.The flooding tolerance of woody species[J].Forest Abstract,1970,31(4):671-688.
[6]COOPS H,VAN DEN BRINK F W B,VAN DER VELDE G.Growth andmorphologicalresponsesoffourhelophytespeciesinanexperimental water-depth gradient[J].Aquatic Botany,1996,54(1):11-24.
[7] ERIKSSON A,ERIKSSON O.Seedling recruitment in semi-natural pastures:the effects of disturbance,seed size,phenology and seed bank[J].Nordic Journal of botany,1997,17(5):469-482.
[8]闫守刚,许清涛.流动沙丘与丘间低地过渡带上芦苇幼苗的出土和定居[J].林业科学,2012,48(9):50-55.
[9]BODENSTEINER L R,GABRIEL A O.Response of mid-water common reed stands to water level variations and winter conditions in Lake Poygan,Wisconsin,USA[J].Aquatic Botany,2003,76(1):49-64.
[10]古志钦,张利权,袁琳.互花米草与芦苇光合色素含量对淹水措施的响应[J].应用生态学报,2009,20(10):2365-2369.
[11]崔保山,赵欣胜,杨志峰,等.黄河三角洲芦苇种群特征对水深环境梯度的响应[J].生态学报,2006,26(5):1533-1541.
[12]冯大兰,刘芸,钟章成,等.三峡库区消落带芦苇(Phragmites communis(reed))的光合生理响应和叶绿素荧光特性[J].生态学报,2008,28(5):2013-2021.
[13]彭玉兰,涂卫国,包维凯,等.九寨沟自然保护区4种水深梯度下芦苇分株地上生物量的分配与生长[J].应用与环境生物学报,2008,14(2):153-157.
[14]徐伟伟,王国祥,刘金娥,等.苏北海滨湿地互花米草种子特征及实生苗生长[J].生态学报,2011,31(16):4560-4567.
[15]李合生.植物生理生化实验原理和技术[M].北京:高等教育出社,2000:167-169.
[16]王晶英,敖红,张杰.植物生理生化实验技术与原理[M].哈尔滨:东北林业大学出版社,2003:135-136.
[17]龚英,陆俊余,刘光姣,等.飞机草叶对水中Cr(Ⅵ)的处理效果研究[J].云南师范大学学报:自然科学版,2014,34(6):69-75.
[18]李玉昌,李阳生,李绍清.淹涝胁迫对水稻生长发育危害与耐淹性机理研究的进展[J].中国水稻科学,1998,12(增刊):70-73.
[19]李萍萍,蒋洁.不同程度淹水对几种景观牧草光合作用的影响[J].江苏农业科技,2006(4):180-183.
[20]谭淑端,朱明勇,张克荣.植物对淹水胁迫的响应与适应[J].生态学杂志,2009,28(9):1871-1877.
[21]GOURBAL B,SONUC N,BHATTACHARJEE H,et al.Drug uptake and modulation of drug resistance in Leishmania by an aquaglyceroporin[J].The Journal of Biological Chemistry,2004,279(30):31010-31017.
(责任编校 纪翠荣)
Influence of different submergence gradients on growth and some physiological characteristics of Phragmites communis seedlings
LIANG Bei,GAO Fanglei,GUO Hongyu,MA Chengcang
(a.CollegeofLifeSciences,b.Tianjin KeyLaboratoryofAnimalandPlantResistance,Tianjin NormalUniversity,Tianjin 300387,China)
To learn the adaptive ability and mechanisms of Phragmites communis Trim.seedlings to submergence stress,the seedlings were treated with different submergence gradients under laboratory conditions,and a short-term durative submergence on P.communis seedlings,several growth and physiological parameters were measured,including biomass,antioxidant enzymes(SOD,POD and CAT)activity,malondialdehyde(MDA)content,soluble protein content and chlorophyll content.The results showed that the biomass,antioxidant enzymes activity,soluble protein content and chlorophyll content of P.communins seedlings treated with 3-6 cm submergence depth were higher than those of the groups without submergence(CK),and MDA content was lower than that of CK.While treated with 9-12 cm submergence depth,the biomass,antioxidant enzymes activity,soluble protein content and chlorophyll content of seedlings were lower than those of CK,and MDA content was higher than that of CK.It can be concluded that less than 6 cm submerged treatment can promote the growth of P. communis seedlings,while more than 9 cm submerged treatment can inhibit the growth of P.communis seedlings.
Phragmites communis seedlings;submergence stress;antioxidant enzyme;soluble protein;biomass
1671-1114(2015)04-0062-05
Q945
A
2015-04-12
国家自然科学基金资助项目(31300357).
梁 贝(1989—),女,硕士研究生.
郭宏宇(1978—),男,副教授,主要从事植物生态学方面的研究.
