匹多莫德联合孟鲁司特对咳嗽变异性哮喘患儿细胞免疫功能的影响及疗效观察
2015-10-17王春燕
王春燕
温州医科大学附属义乌医院儿科,浙江义乌 322000
咳嗽变异性哮喘(cough variant asthma,CVA)是引起儿童慢性咳嗽的较常见病因,其症状常非典型,以慢性顽固性干咳为主要症状,临床上易发生误诊误治,导致部分患儿病情反复发作,发展成典型性哮喘[1-2]。孟鲁司特是最常用的非甾体类白三烯受体拮抗剂,已广泛应用于儿童CVA治疗中,但对部分病情顽固的患儿仍不能完全阻止其病情的进展,这可能与CVA患者免疫功能,尤其是细胞免疫低下密切有关[3-4]。匹多莫德是一种新型的口服免疫增强剂,可纠正T淋巴细胞亚群的紊乱,恢复CD4+/CD8+比值,其联合孟鲁司特治疗儿童CVA效果肯定,但其是否具有调节细胞免疫功能尚不十分明确[5-6]。本研究探讨了匹多莫德联合孟鲁司特对CVA患儿细胞免疫功能的影响及疗效观察。现报道如下:
1 资料与方法
1.1 一般资料
选取2013年1月~2014年4月在温州医科大学附属义乌医院(以下简称“我院”)儿科门诊就诊的CVA患儿84例。纳入标准:①均符合中华医学会儿科分会呼吸学组制订的《儿童哮喘诊断与防治指南》(2008版)[7]的相关诊断标准;②年龄5~11岁。排除标准:①先天性心肺疾病、儿童结核、气管异物、过敏性鼻炎、副鼻窦或原发性免疫功能缺陷等疾病;②治疗前1个月使用过白三烯受体拮抗剂、抗组胺药、支气管扩张剂、免疫增强剂和糖皮质激素等。采用随机数字表将患儿分为两组:联合组和对照组,各42例。两组患儿性别、年龄、病程等情况比较差异均无统计学意义(P>0.05),具有可比性。见表1。本方案经我院伦理委员会批准通过,纳入前所有患儿家属均签署知情同意书。

表1 两组患儿一般资料比较
1.2 治疗方法
两组患儿均按照全球哮喘防治创议(GINA)制订的方案进行治疗[8]。联合组患儿予以匹多莫德联合孟鲁司特,其中孟鲁司特钠咀嚼片(杭州默沙东制药有限公司,规格:5 mg×5 片,批号 120705)5 mg/次,1 次/d,连用3个月。匹多莫德颗粒(浙江仙琚制药股份有限公司,规格:0.4 g/2 g,批号 120914)0.4 mg/次,2 次/d,2周后改为0.4 g/d,共连用3个月。对照组患儿予以单纯的孟鲁司特治疗,剂量、方法与疗程与联合组相同。
1.3 观察指标
评估并比较两组患儿治疗前和治疗3个月后细胞免疫功能指标的变化,并比较其临床疗效及药物不良反应情况。
1.3.1 细胞免疫功能测定 采用T淋巴细胞亚群(CD4+、CD8+水平和CD4+/CD8+比值)评估其细胞免疫功能,采用碱性磷酸酶法(试剂盒购买自北京军事科学院)进行测定。
1.3.2 临床疗效评估 显效:治疗后患儿咳嗽1周内基本消失或即使偶有发作,也可自行缓解,3个月内症状无复发;有效:治疗后患儿咳嗽1周内较前减轻,2~4周内基本消失,或虽有咳嗽发作,但药物可迅速控制,3个月内无复发;无效:治疗后未达上述标准。总有效为显效加有效[9]。
1.4 统计学方法
2 结果
2.1 两组外周血T淋巴细胞亚群的变化比较
两组患儿治疗前CD4+、CD8+水平和CD4+/CD8+比值比较差异无统计学意义(P>0.05)。治疗3个月后,两组患儿CD4+水平和CD4+/CD8+比值较前均有不同程度上升(t=2.87、3.58、2.29、2.45,P < 0.05 或 P <0.01),CD8+水平较前均有不同程度下降(t=2.89、2.29,P<0.05或P<0.01),且联合组上升或下降幅度明显大于对照组(t=2.15、2.21、2.46,均 P < 0.05)。见表2。
表2 两组外周血T淋巴细胞亚群的变化比较(±s)
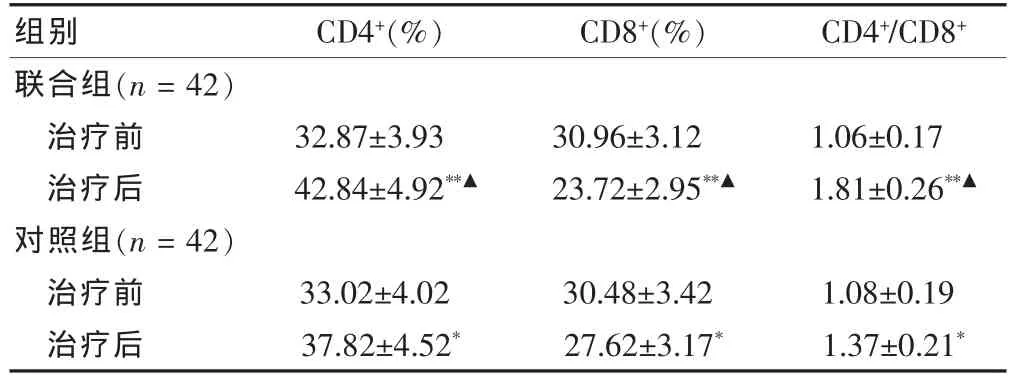
表2 两组外周血T淋巴细胞亚群的变化比较(±s)
注:与本组治疗前比较,*P<0.05,**P<0.01;与对照组治疗后比较,▲P<0.05
组别 CD4+(%) CD8+(%) CD4+/CD8+联合组(n=42)治疗前治疗后对照组(n=42)治疗前治疗后32.87±3.93 42.84±4.92**▲30.96±3.12 23.72±2.95**▲1.06±0.17 1.81±0.26**▲33.02±4.02 37.82±4.52*30.48±3.42 27.62±3.17*1.08±0.19 1.37±0.21*
2.2 两组治疗后效果比较
治疗3个月后,联合组患儿临床总有效率为95.24%,明显高于对照组的80.95%(χ2=4.09,P<0.05)。 见表3。
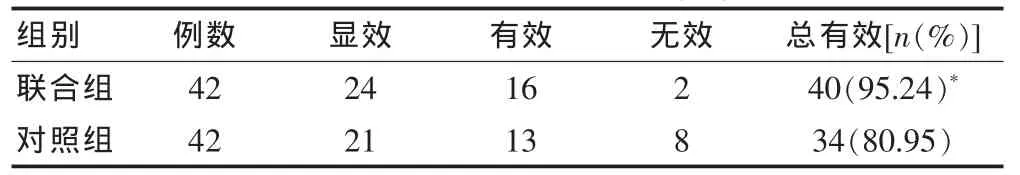
表3 两组治疗后效果比较(例)
2.3 两组治疗过程中不良反应发生率比较
对照组患儿治疗过程中发生药物不良反应3例,其中腹部不适2例、恶心1例;联合组患儿治疗过程中发生药物不良反应6例,其中恶心3例,头晕2例和皮疹1例,症状均较轻微,未影响患儿继续完成治疗方案。两组患儿不良反应发生率比较差异无统计学意义(χ2=0.50,P > 0.05)。
3 讨论
近年来随着空气污染的加重,儿童CVA的发病率和复发率呈明显上升趋势,对患儿身心健康影响较明显,甚至危及患儿生命[10-12]。孟鲁司特是目前治疗儿童CVA常用的药物,主要通过竞争性抑制呼吸道平滑肌上阻断半胱氨酸白三烯D4与其受体特异性结合,从而有效预防和抑制白三烯所致毛细血管通透性升高,使气道炎症分泌物减少;能抑制嗜酸性粒细胞浸润在气道的聚集和活化,控制气道局部炎症,抑制气道高反应的激发状态,并能抑制支气管痉挛,有利于气道通气,从而有利于CVA病情的控制[13-15]。孟鲁司特可使大多数患儿CVA症状得到良好的控制,但仍有部分CVA患儿免疫功能,尤其是患儿细胞免疫功能下降,呼吸道感染反复发作,药物难以有效地预防和抑制患儿病情,引起患儿病情的复发,治疗较棘手[16-18]。因此,增强CVA患儿的免疫功能,减少患儿呼吸道感染发作,是预防与治疗儿童CVA复发的重要途径[19-20]。
匹多莫德是意大利公司研发一种新型的唯一口服给药的二肽类免疫调节剂,其调节免疫功能的机制十分复杂,既有非特异性免疫增强效应,又有特异性免疫增强效应。匹多莫德的特异性免疫增强效应主要是在免疫反应中期主要通过刺激T淋巴细胞的分化和增生,纠正T淋巴细胞亚群比例紊乱使其逐渐恢复正常,激活机体细胞免疫系统,上调血清CD4+水平和CD4+/CD8+比值使逐渐恢复正常,增强机体细胞免疫力[21-23]。匹多莫德本身并没有直接的抗细菌及抗病毒作用,其抗感染力主要通过增强其非特异性免疫和特异性免疫效应起作用[24-25]。程建明等[26]研究发现孟鲁司特与匹多莫德联合治疗儿童CVA效果显著,不良反应轻,并能降低其中远期复发率,有利于患儿病情控制。本研究发现治疗3个月后,联合组患儿CD4+水平和CD4+/CD8+比值上升幅度及CD8+水平下降幅度明显大于对照组。提示匹多莫德联合孟鲁司特治疗CVA患儿能纠正患儿外周血T淋巴细胞亚群紊乱,上调血清CD4+水平和CD4+/CD8+比值,下调CD8+水平,激活并增强其细胞免疫功能。同时研究还发现联合组患儿的临床总有效率明显高于对照组,对照组和联合组患儿治疗过程中发生不良反应3例和6例,症状相对均较轻微。提示匹多莫德联合孟鲁司特治疗CVA患儿的效果明显优于单纯的孟鲁司特治疗,且安全性较佳。
总之,匹多莫德联合孟鲁司特治疗CVA患儿的效果显著,且安全性较佳,其作用机制可能与其能纠正患儿外周血T淋巴细胞亚群紊乱,上调血清CD4+水平和CD4+/CD8+比值,下调CD8+水平,激活并增强其细胞免疫功能密切相关[27]。
[1]张永明,林江涛.咳嗽变异性哮喘诊断和治疗新认识[J].中华结核和呼吸杂志,2012,35(1):62-64.
[2]Krishnan JA,Bender BG,Wamboldt FS,et al.Adherence to inhaled corticosteroids:an ancillary study of the childhood asthma management program clinical trial [J].J Allergy Clin Immunol,2012,129(1):112-118.
[3]薛满,马春利,梁宽,等.孟鲁司特钠治疗小儿咳嗽变异性哮喘的临床疗效及安全性研究[J].现代生物医学进展,2012,12(17):3317-3319.
[4]IlarrazaR,WuY,AdamkoDJ.Montelukastinhibitsleukotriene stimulation of human dendritic cells in vitro [J].Int Arch Allergy Immunol,2012,159(4):422-427.
[5]陈潮青,罗学虹,陈宜升,等.匹多莫德联合孟鲁司特治疗小儿反复发作性哮喘的疗效观察[J].中华全科医学,2013,11(8):1204-1205.
[6]钱旭波,叶小红,胡蓓玲,等.孟鲁司特联合匹多莫德治疗儿童支气管哮喘35例的疗效观察[J].浙江实用医学,2009,14(3):229-230,257.
[7]中华医学会儿科学会呼吸学组.儿童支气管哮喘诊断与防治指南[J].中华儿科杂志,2008,46(10):745-753.
[8]洪建国.2006年版全球哮喘防治创议[J].实用儿科临床杂志,2007,22(16):1278-1280.
[9]陈文杰,谢彦奇,杨慧娟.匹多莫德在治疗小儿哮喘中应用的疗效观察[J].中国实用医药,2012,7(15):182-183.
[10]Come JM,Marshall C,Smith S,et al.Frequency,seventy,and duration of rhinovirus infections in asthmatics and non-asthmatic individuals:a longitudinal cohort study[J].Lancet,2002,359(9309):831-834.
[11]Nakajima T,Nishimura Y,Nishiuma T,et al.Characteristics of patients with chronic cough who developed classic asthma during the course of cough variant asthma:a longitudinal study [J].Res piration,2005,72 (6):606-611.
[12]Shimoda T,Obase Y,Kishikawa R,et al.Comparison of central and peripheral airway inflammation between cough variant asthma and mild asthma by examination of hypertonic saline inhalation-induced sputum [J].J Allergy Clin Immunol,2007,119(1):S130.
[13]陈佳炳,吴洁文.白三烯及其受体与咳嗽变异性哮喘[J].中国实用内科杂志,2008,28(12):1086-1088.
[14]朱毅,陆丽华.孟鲁司特钠治疗小儿咳嗽变异性哮喘的疗效观察[J].中国临床医学,2009,16(2):259-260.
[15]Souza FC,Gobbato NB,Maciel RG,et al.Effects of corticosteroid,montelukast and iNOS inhibition on distal lung with chronic inflammation [J].Respir Physiol Neurobiol,2012,8(27):13-15.
[16]Tamaoki J,Yokohori N,Tagaya E,et al.Comparable effect of a leukotriene receptor antagonist and long-acting beta-adrenergic agonist in cough variant asthma[J].Allergy Asthma Proc,2010,31(5):78-84.
[17]Takemura M,Niimi A,Matsumoto H,et al.Clinical physiological and anti-inflammatory effect of montelukast in patients with cough variant asthma[J].Respiration,2012,83(4):308-315.
[18]徐佳莉.孟鲁司特治疗咳嗽变异性哮喘80例[J].中国医院药学杂志,2012,32(14):1137-1139.
[19]张莉,马礼兵,向旭东.CD4+T淋巴细胞在哮喘发病中的新认识[J].实用医学杂志,2011,27(4):704-706.
[20]叶伟,刘国强.咳嗽变异性哮喘与血清微量元素及免疫功能的关系[J].中外妇儿健康,2011,19(4):51-52.
[21]张淑芹,乐原.匹多莫德治疗儿童支气管哮喘疗效观察[J].山东医药,2010,50(8):74-75.
[22]翟凤馨,刘馨.匹多莫德对小儿支气管哮喘的临床疗效观察[J].中国生化药物杂志,2011,32(2):151-153.
[23]Riboldi P,Gerosa M,Meroni PL.Pidotimod:a reappraisal[J].Int J Immunopathol Pharmacol,2009,22(2):255-262.
[24]张蕾,王风圈.匹多莫德口服液辅助治疗儿童反复呼吸道感染临床疗效观察[J].中国现代药物应用,2010,4(19):151-152.
[25]孙凌新,杨晓松,张德洁,等.匹多莫德对哮喘患儿IL-16 及免疫功能的影响[J].临床儿科杂志,2011,29(8):777-779.
[26]程建明,朱晓强,林景辉.孟鲁司特钠和匹多莫德联合治疗咳嗽变异性哮喘50例疗效观察[J].现代中西医结合杂志,2008,17(23):3614-3615.
[27]张丽,安效先.中医药治疗儿童咳嗽变异性哮喘的研究进展[J].环球中医药,2013,6(3):230-235.
