乳腺包被性乳头状癌的超声特征初探
2015-10-17贾志莺张银华艾秀清马富成
贾志莺,张银华,艾秀清,马富成
(新疆医科大学附属肿瘤医院超声科,新疆 乌鲁木齐 830011)
乳腺包被性乳头状癌的超声特征初探
贾志莺,张银华,艾秀清,马富成
(新疆医科大学附属肿瘤医院超声科,新疆 乌鲁木齐830011)
目的:探讨乳腺包被性乳头状癌(EPC)的声像图特征。方法:回顾性分析经手术病理证实的25例乳腺EPC的声像图表现及病理特征。结果:25例患者中有16例≥60岁,占64%。声像图表现:14例肿块为实性,11例肿块为混合性,2例伴微钙化,3例伴肿块旁导管扩张,2例伴同侧腋下淋巴结转移,其中仅13例术前超声诊断为乳腺癌。结论:EPC有一定声像图特点,常规超声诊断EPC困难,确诊依赖手术。
乳腺肿瘤;超声检查,多普勒,彩色
乳腺包被性乳头状癌(Encapsulated papillary carcinoma,EPC)是一种特殊类型的乳腺恶性肿瘤,属于乳头状癌的变异型,定义为乳头状结构具有纤细的纤维血管轴被覆低至中等级别核的肿瘤上皮细胞,有纤维包膜包绕,大多数病例乳头内或肿瘤周边缺乏肌上皮[1]。EPC仅占乳腺恶性肿瘤的0.5%~1.0%[2],好发于老年女性,恶性程度相对较低,临床预后较好。由于EPC发病率低,相关超声报道较少见,现收集25例EPC,以探讨其声像图特征。
1 资料与方法
1.1研究对象
收集新疆医科大学附属肿瘤医院2010年2月—2013年11月期间住院手术的25例女性患者,均经我院病理证实为乳腺EPC,年龄29~83岁,中位年龄65岁。
1.2仪器与方法
采用Philips IU22及sequoia 512超声诊断仪,探头频率5~12 MHz。患者取平卧位,常规探查双侧腋下及锁骨区淋巴结。乳腺血流描述参考Adler分级。
2 结果
2.1年龄分布
25例女性乳腺EPC中,患者年龄≥60岁16例(64%),50~<60岁者4例(16%),<50岁者5例(20%)。
2.2病灶部位
共25个病灶,右乳12例,左乳13例。乳晕区7例,乳腺外周象限18例。
2.3病灶大小
超声测量病灶大小:<1 cm 1例(实性)、1~<2 cm 5例(3例实性,2例混合性)、2~<3 cm 8例(4例实性,4例混合性)、≥3 cm 11例(5例实性,6例混合性)。
2.4声像图表现
13例肿块声像图表现为实性,11例肿块表现为混合性,2例显示病灶同侧腋下淋巴结肿大。25个肿块的声像图表现:12例界限清,10例界限欠清,3例界限不清;9例边缘规整,14例边缘分叶状,2例边缘不规整;13例形态规则,7例形态欠规则,5例形态不规则;2例肿块内有微钙化,23例内无钙化;肿块内血流Adler分级0~Ⅰ级4例,Ⅱ~Ⅲ级21例;肿块周边有导管扩张3例,无导管扩张22例;肿块后方回声增强16例,后方回声无变化9例,无后方回声衰减。
2.5术前超声诊断
超声提示为乳腺癌13例,纤维腺瘤5例,导管内乳头状瘤1例,仅描述物理性质6例。
2.6病理结果
11例为乳腺EPC(术前超声诊断:2例乳腺癌,4例纤维腺瘤,4例未提示,1例导管内乳头状瘤),9例为EPC伴微小浸润或间质浸润(术前超声诊断:8例乳腺癌,1例未提示),5例为EPC伴浸润性导管癌(术前超声诊断:3例乳腺癌,1例纤维腺瘤,1例未提示)。
3 讨论
2003年WHO将乳腺EPC列入导管内乳头状肿瘤,可源自于乳头至终末导管小叶单位导管系统任何部位,是一种特殊组织学类型的乳腺恶性肿瘤。EPC可发生于乳腺的任何部位,好发于乳腺中央区,临床触诊常为界限清楚的肿块,有或无乳头溢液,就诊时肿块较大,影像检查不易确诊,需行手术,最后确诊依赖病理组织学及免疫组化。
当前对EPC的病理学认识还存在争议,因其显著的病理组织学特点是囊内乳头状癌的乳头状病变区域缺乏肌上皮细胞,表现为P63肌上皮(-)、CK5/6(-)[3],这与本组病例免疫组化结果一致,因此又有学者认为该肿瘤可能因为浸润性生长破坏了周围的肌上皮细胞,是原位和浸润性癌之间的一种癌“转型”形式。EPC从病理上分为纯型EPC和EPC伴浸润,亦可同时并存导管原位癌或浸润性癌[4-5],单纯EPC的预后非常好[6],只需手术局部切除即可,而EPC伴浸润表现为突破纤维性包膜浸润周围组织,常需外科完全切除,并根据病理结果进行分期。
本组病例从超声图像上可分为混合型和实性肿块型两类。混合型EPC声像图表现为界限较清楚的肿块,边缘分叶状,内有形状不规则、血流信号丰富的实性部分及透声较差的无回声区(图1),超声医师不易做出准确判断。混合型EPC声像图与大体标本所见相符,后者肉眼所见为囊内易碎肿块或附壁结节[3],若肿瘤组织生长到一定程度,堵塞了病变处导管,即引起该处导管的局限性积液,超声可表现为结节周边的无回声区,若肿瘤内部组织破碎、坏死、脱落就形成了结节内部无回声区。
实性肿块型EPC的声像图基本上表现为两种:典型的类似纤维腺瘤的图像(图2,超声常误诊为良性)和典型的乳腺癌图像(图3,超声常诊断为乳腺癌)。误诊为纤维腺瘤的5例肿块中有4例为实性,声像图表现为界限清楚、形态规则、纵横比小于1且伴侧壁声影,这些都与纤维腺瘤的超声特征极相似,是造成误诊的主要原因。其中4例病理结果为纯型EPC,低倍镜下显示结节周围有厚包膜围绕,组织学分级较低且未形成坏死溃疡,或者可以解释其超声图像表现。借鉴李伟伟等[7]回顾性地分析肿块型导管内癌的超声表现,发现其生长方式具有水平位生长和边界清晰等良性肿瘤的征象,这与不伴浸润的EPC形态非常相似。然而当EPC突破周围的纤维性包膜时,即可表现出界限不清,形态不规则等较典型的恶性征象,本组超声正确诊断为乳腺癌的13个病灶中有11例病理证实为EPC伴浸润,这也显示了边界不清、边缘不规则可能是最有助于EPC超声诊断的二维恶性表现。
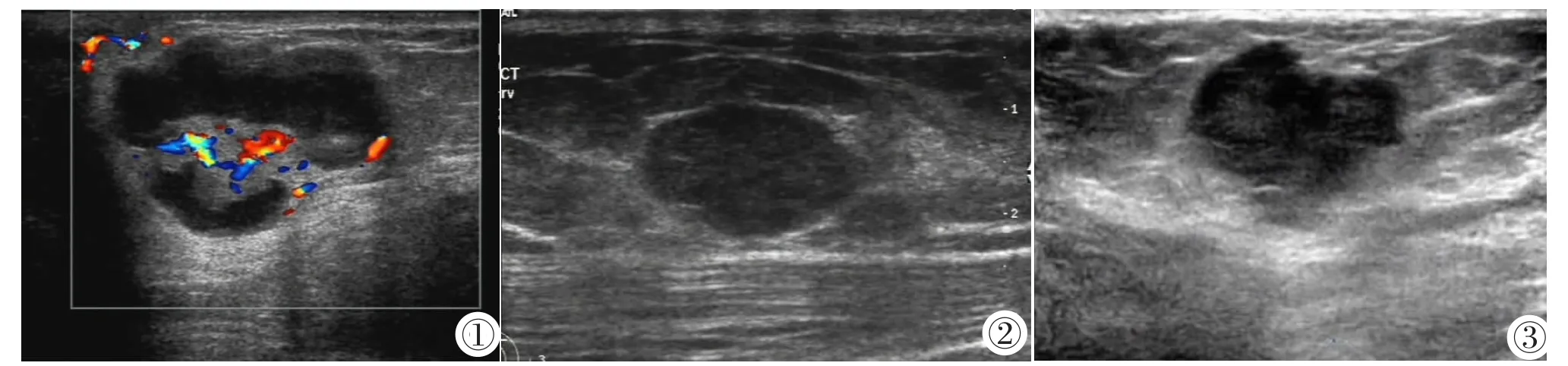
图1 女,70岁,左乳晕区2.8 cm×2.3 cm混合性回声肿块,术前超声考虑为导管内乳头状瘤,病理证实为EPC,囊壁间质可见浸润。 图2女,56岁,右乳内上象限2.3 cm×1.2 cm实性中低回声肿块,术前超声误诊为纤维腺瘤,病理证实为EPC。 图3 女,68岁,右乳外侧2.1 cm× 1.9 cm实性低回声肿物,术前超声诊断为乳腺癌,病理证实为EPC,局部有微小浸润。Figure 1.Female,70 years old,the ultrasonogram shows a mixed echoic mass about size of 2.8 cm×2.3 cm in the left areola of breast,which was diagnosed endoduct breast cancer before operation,and confirmed EPC with infiltration of the cyst wall by pathology. Figure 2. Female,56 years old,the ultrasonogram shows a solid middle-hypoechoic mass about size of 2.3 cm×1.2 cm in the upper inner quadrant of right breast,which was diagnosed fibroadenoma before operation,and confirmed EPC after operation. Figure 3. Female,68 years old,the ultrasonogram shows a solid hypoechoic mass about size of 2.1 cm×1.9 cm in the outside of right breast,which was diagnosed breast cancer before operation,and confirmed EPC with micro infiltration by pathology.
本组病例中仅2例出现钙化,这与乳腺浸润性导管癌及导管内癌常伴有微钙化的超声特点不符。乳腺癌内微钙化是组织内的营养不良性钙盐沉积,微钙化的出现可高度提示恶性,但本组病例钙化少有出现,可能与EPC生长缓慢有关。Akagi等[8]报道从发现肿块到明确诊断为EPC,一般经历5月的时间,这也提示与常见类型的乳腺癌相比,EPC的生长速度更慢。
乳腺EPC中以原位癌居多,常见与导管原位癌或其他类型浸润性癌并存[9],本组病例中仅2例合并腋下淋巴结转移,病理类型为EPC及浸润性导管癌,超声均检出腋下淋巴结肿大。21例(84%)EPC血流Adler分级Ⅱ~Ⅲ级,即使是不伴浸润的EPC亦能检出较丰富的血流信号,血流呈条形或杂乱走行,反映了恶性肿瘤富血管的供血特点。
EPC在常规超声诊断中尚需与以下乳腺肿块鉴别,乳腺浸润性导管癌的声像图多表现为典型的实性低回声占位,有界限不清、边缘毛刺状或蟹足状、内部微钙化、后方回声衰减等征象,诊断准确率高。导管内乳头状瘤好发于乳晕区,一般表现为扩张导管内的实性结节病变,也可表现为周围区域的结节,但形态规则,体积相对较小,患者常有乳头溢液等症状。
综上所述,EPC声像图特征不典型,尤其是实性肿块型无特征性表现,超声诊断困难,但仍有一定特点可循,现将本组病例的特点总结如下:①50岁以上妇女多见,病程缓慢,以乳腺肿块就诊,少有乳头溢液。②乳腺内混合性肿物,界限清,形态规则或边缘分叶状,壁厚、内壁不光滑,壁内侧有结节状或不规则团块状突起,实性部分血流信号多丰富。③乳腺内实性肿块型EPC伴有浸润者,可有形态不规则,界限不清等恶性征象,但后方无声衰减。不伴浸润者与纤维腺瘤难以鉴别。④肿物内少有钙化。⑤少数病例伴有腋下淋巴结肿大。
乳腺EPC的细胞核不典型性并不明显,因此乳腺肿瘤常用的穿刺组织学活检并不适用于EPC,常依靠手术切除活检及免疫组化才能明确诊断[5]。这也提示超声医师,对于年龄在50岁以上尤其是60岁以上的女性患者,发现乳腺肿块特别是混合性肿块具有上述声像图特征时,应建议其手术切除而不是穿刺活检。
[1]Hill CB,Yeh IT.Myoepithelial cell staining patterns of papillary breast lesions:from intraductal papillomas to invasive papillary carcinoma[J].Am J Clin Pathol,2005,123(1):36-44.
[2]Corkill ME,Sneige N,Fanning T,et al.Fine needle aspiration cytology and flow cytometry of encapsulated papillary carcinoma of breast[J].Am J Clin Pathol,1990,94(6):673-680.
[3]刘裔莎,魏兵,步宏,等.乳腺包裹性乳头状癌17例临床病理观察[J].临床与实验病理学杂志,2012,28(7):726-731.
[4]Collins LC,Carlo VP,Hwang H,et al.Encapsulated papillary carcinomas of the breast:a reevaluation using a panel of myoepithelial cell markers[J].Am J Surg Pathol,2006,30(8):1002-1007.
[5]杨文涛,喻林,陆洪芬,等.乳腺包被性乳头状癌的临床病理学分析[J].中华病理学杂志,2008,37(4):234-237.
[6]Inoue S,Kunitomo K,Okamoto H,et al.A case of male non-invasive encapsulated papillary carcinoma forming a tumor in the nipple duct[J].Breast Cancer,2003,10(1):85.
[7]李伟伟,陈牧云,陶玲玲,等.乳腺导管内癌超声诊断价值[J].中国超声医学杂志,2013,29(1):45-48.
[8]Akagi T,Kinoshita T,Shien T,et al.Clinical and pathological features of encapsulated papillary carcinoma of the breast[J].Surg Today,2009,39(1):5-8.
[9]丁锦华,吴伟主,甘勇莉.乳腺包被性乳头状癌的临床病理特征及预后分析[J].中国癌症杂志,2013,23(5):357-361.
Preliminary discussion about ultrasonic features of breast encapsulated papillary carcinoma
JIA Zhi-ying,ZHANG Yin-hua,AI Xiu-qing,MA Fu-cheng
(Department of Ultrasound,Affiliated Tumor Hospital of Xinjiang Medical University,Urumqi 830011,China)
R737.9;R445.1
B
1008-1062(2015)06-0438-03
2014-09-15;
2015-02-15
贾志莺(1976-),女,新疆乌鲁木齐人,副主任医师。
