牛奶α -乳白蛋白基因实时荧光定量PCR检测方法的建立
2015-10-16张亦凡张银志孙秀兰
贾 敏, 张亦凡, 张银志, 孙秀兰*,
( 1.江南大学食品学院,江苏无锡 214122;2.江南大学食品科学与技术国家重点实验室,江苏无锡 214122;3.陕西省汉中市产品质量监督检验所,陕西汉中 723000)
食物过敏是一个全球关注的公共卫生问题,据统计全世界约有1%~2%成人和5%~8%儿童对某些食物存在过敏反应[1 - 3]。联合国粮农组织(FAO,1995)报告指出90%以上的食物过敏反应由以下8大类常见食物诱发:牛奶、鸡蛋、花生、坚果、小麦、大豆、鱼和贝类[4]。牛奶是其中最常见的过敏原之一,牛奶过敏(CMA)是由于摄入乳或含有乳制品的食物而引起的异常免疫反应[5],在3岁以内儿童中引起广泛的不良反应,其发病率高达2%~7.5%[6,7]。牛奶蛋白含量丰富,理论而言天然牛奶含有的任何一种蛋白质都有潜在致敏性,但酪蛋白(Casein,CN)、β-乳球蛋白(Beta-lactoglobulin,β-Lg)及α-乳白蛋白(Alpha-lactalbumin,α-La)被认为是主要的牛奶过敏原[8,9]。α-乳白蛋白是由LALBA基因编码的一种蛋白质,是乳清蛋白中分子量最小的蛋白质,其分子量约为14 000 Da,单体由123个氨基酸残基构成,是牛乳中一种重要的乳清蛋白[10]。α-乳白蛋白耐热性较低,高温可降低其致敏性,但是仍然可诱发严重的过敏反应,被认为是一种重要的牛乳过敏原[11,12]。
目前,防止食物过敏的唯一有效手段是避免食入过敏原[13],因此对食物过敏原的检测至关重要。至今为止,对食物过敏原的检测方法主要针对致敏性蛋白和间接指示过敏原组分存在的DNA片段。免疫化学方法是目前最常用的过敏原检测方法,可直接检测出致敏性蛋白,但是其存在特异性抗体难获得,容易产生假阳性结果,加工过程酶、温度、压力对蛋白质的破坏影响检测等缺点[14,15]。DNA比较稳定,食品加工对其影响较小,因而基于DNA的常规PCR和实时荧光定量PCR可以作为蛋白检测的补充方法。关潇等人[16]建立了基于α-乳白蛋白基因的常规PCR定性检测方法,但还未见α-乳白蛋白基因的Taqman探针实时荧光PCR检测方法的相关报道。
本研究建立了Taqman探针实时荧光定量PCR方法,用于食品中牛奶主要过敏原α-乳白蛋白基因的检测,与常规PCR方法相比且具有灵敏、快速、简单、安全等优点。与直接检测致敏性蛋白的免疫分析方法相比,可大大降低复杂生物基质中交叉反应导致的假阳性结果,避免对大量抗体的需求,而DNA比蛋白稳定,受食品加工过程影响较小,故可通过对过敏原DNA片段的检测间接指示食物过敏原组分的存在。因此,本研究建立的实时荧光定量PCR检测方法可作为目前常用的免疫检测的有效补充,为食物牛奶过敏原的检测提供可靠的保障,可推广到实际食品中的牛奶过敏原检测。
1 实验部分
1.1 仪器与设备
伯乐C1000TM型PCR仪(美国,Bio-rad(伯乐)公司);SLAN®全自动实时荧光定量PCR仪(上海宏石医疗科技有限公司);DYY-8C琼脂糖凝胶电泳仪(北京六一制造厂);TU-1900型双光束紫外-可见分光光度计(北京普析通用仪器有限责任公司);凝胶成像仪(美国,Bio-rad(伯乐)公司)。
1.2 试剂与材料
pMD19T-vector,PCR胶回收试剂盒、DNA Ligation Kit、质粒DNA小量纯化试剂盒、 2X 热启动 PCR 试剂混合物,Takara公司。引物及探针:HPLC纯化,由上海生工生物工程有限公司合成;溴化乙锭(EB)、TBE缓冲液、琼脂糖,上海生工生物工程有限公司;Tris-饱和酚,氯仿、乙醇及异戊醇等其它分析纯试剂,购自国药集团化学试剂有限公司。感受态菌,氨苄青霉素,LB 培养基由上海博仕生物医学服务中心(水源生物)提供。
光明鲜牛奶,现代鲜牛奶,特仑苏鲜牛奶,复原乳(A),麦芽牛乳(B),高纤燕麦饮料(C),花生牛乳饮料(D),果粒奶优(E),均购自欧尚超市。
1.3 DNA的提取
参照文献方法[17,18]提取并稍加改动。提取市售鲜牛奶中的DNA:(1)取50 mL鲜牛奶于4个100 mL的离心管中, 4 ℃、12 000 r/min离心15 min,弃上清液,用棉球去除上层乳蛋白和乳脂;(2)加入10 mmol/L磷酸盐缓冲液(PBS),溶解沉淀,4 ℃、12 000 r/min离心10 min;(3)加入880 μL TEN(1 mL l mol/L Tris+0.2 mL 0.5 mol/L EDTA+58 g NaCl 定容至100 mL)和0.2 moI/L NaOH溶液120 μL,悬浮沉淀并震荡混匀30 s,95 ℃条件下水浴8 min 期间颠倒混匀几次,4 ℃、12 000 r/min离心10 min;(4)取上清液至灭菌离心管中,加入等体积的酚∶氯仿∶异戊醇=25∶24∶1,剧烈震荡2~3 min,4 ℃、12 000 r/min离心10 min;(5)取上清液,加入等体积的氯仿,混匀,12 000 r/min离心10 min;(6)上清液移入灭菌离心管中,加入等体积的预冷异丙醇,慢慢上下颠倒30 s,-20 ℃条件下放置30 min,12 000 r/min离心2 min,管底部有可见的白色DNA沉淀;(7)白色沉淀用70%乙醇洗涤2次,用N2吹干至无乙醇味;(8)加适量ddH2O溶解,测其浓度。
1.4 引物和探针设计
根据NCBI上已公布的牛奶过敏原α-乳白蛋白(α-La)基因(GenBank登录号:AF249896.1)的核酸序列,设计合成检测牛奶α-乳白蛋白成分的引物和Taqman-BHQ探针,PCR目标扩增片段长度为236 bp,序列见表1。
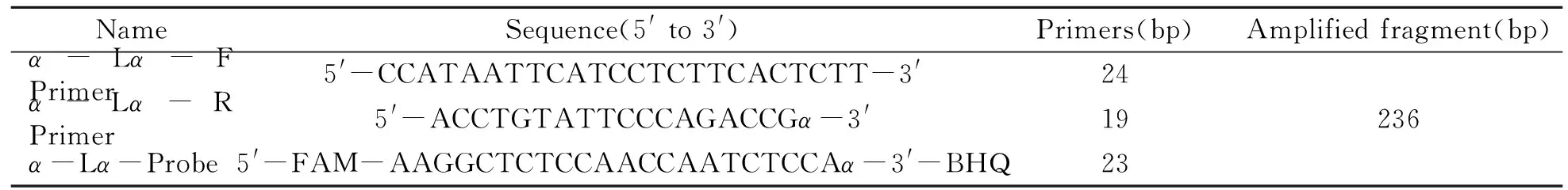
表1 PCR扩增用引物和探针序列
1.5 牛奶定性PCR扩增和电泳检测
用上述引物对3种不同来源牛奶的DNA进行扩增,每种样品都设置3种退火温度梯度(50、55、60 ℃),PCR扩增总体系30 μL,PCR Mixture 2×Mix 15 μL,上下游引物各 0.5 μL(10 mmol/L),DNA模板 2 μL,余下体积用灭菌超纯水补足至30 μL。同时设置阴性对照,即在30 μL PCR体系中用超纯水代替DNA模板。PCR扩增体系为,起始模板变性94 ℃,3 min;变性94 ℃,30 s;退火(50、55、60 ℃),30 s,延伸72 ℃,30 s,35个循环后72 ℃延伸10 min。
将上述PCR产物利用琼脂糖凝胶电泳进行检测:将3 μL 6×Loading Buffer与6 μL PCR产物混合,加入1.5%琼脂糖凝胶点样孔中,在TBE电泳缓冲液中进行电泳,以DNA Maker 3 000作为分子质量标准,100 V电泳45 min,在凝胶成像仪下观察结果。
1.6 目的基因与载体的连接、转化及鉴定
1.6.1连接按试剂盒说明进行PCR胶回收纯化,pMD18-T vecto进行连接,10 μL连接体系为:PCR回收片段 4 μL,pMD18-T vector 1 μL,T4ligase 1 μL,10×T4ligase buffer 1 μL,H2O 3 μL。16 ℃ 1 h,然后4 ℃放置过夜。
1.6.2转化将连接产物加入感受态菌中,冰浴20 min。42 ℃静止水浴90 s,再冰浴2 min。加入1 mL无抗性的LB,37 ℃,150 r/min,复苏40 min。12 000 r/min离心1 min,去掉1 mL上清,剩下的混匀涂带有蓝白斑筛选氨苄抗性的培养板。将培养板放到培养箱中,37 ℃放置过夜。
1.6.3酶切鉴定和测序挑取白色菌落进行小量培养,提取重组质粒,用BamHI 与HindIII 进行双酶切,酶切后经1.5%琼脂糖电泳鉴定,并将初步鉴定为阳性的菌落接种LBA培养基,37 ℃培养过夜后,将菌液送测序进一步确证。
1.7 实时荧光定量PCR
定量PCR的引物和探针序列见表1,将重组质粒pMD19T-La用HindIII单酶切成线性化的标准模板质粒并进行定量,转化为相应的拷贝数后按10倍倍比梯度稀释:第一管取割胶产物10 μL到90 μL标准品稀释液中,接下来都是10倍稀释,稀释成1.12×102~1.12×1011拷贝的标准品进行Taqman探针法实时荧光定量PCR扩增反应。定量PCR反应体系为:总体积为30 μL,其中含2×qPCR mix 15 μL,上下游引物各0.5 μL(10 μmol/L),探针1 μL(10 μmol/L),模板DNA 2 μL,灭菌超纯水11 μL。实时荧光定量PCR运行条件同定性PCR优化好的条件:94 ℃,3 min; 94 ℃,30 s;55 ℃,30 s, 72 ℃,30 s检测荧光信号,35个循环,72 ℃保温10 min。以初始模板量的对数值为横坐标,以循环阈值(Ct)为纵坐标绘制标准曲线。
1.8 实际样品检测
为对本研究建立的Taqman探针实时荧光定量PCR方法的实际应用性进行考察,对5种市售实际样品进行检测。利用上述改进的牛奶基因组DNA提取方法对5种市售液体样品进行基因组DNA提取,以提取的基因组DNA为模板进行实时荧光定量PCR扩增。利用标准曲线计算其α-乳白蛋白过敏原基因拷贝数,利用检测限来判断液体样品是否含有牛奶α-乳白蛋白过敏原。
2 结果与分析
2.1 牛奶基因组DNA的提取
经测定提取的基因组DNA的OD260/OD280均在1.7左右, DNA纯度较好,浓度较高,可用于后续PCR扩增试验。样品基因组DNA测定结果见表2。
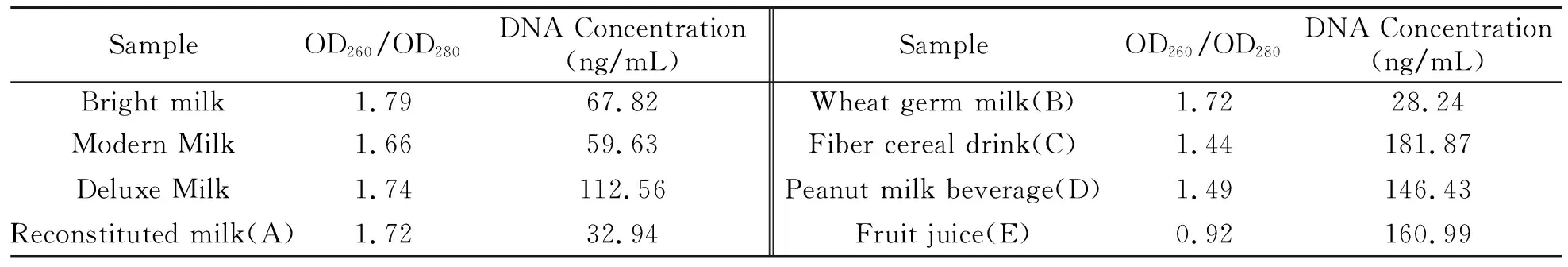
表2 样本基因组DNA测定值
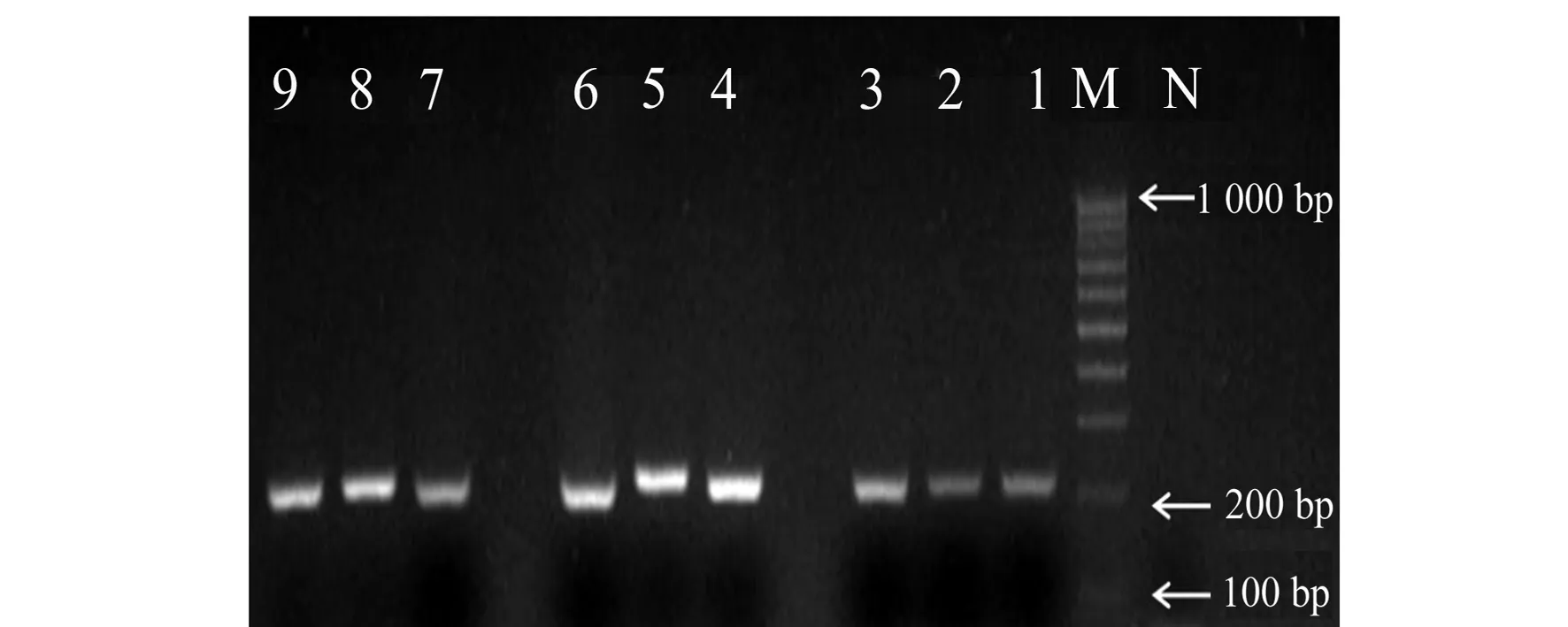
图1 不同牛奶基因组DNA及退火温度的定性PCR产物Fig.1 PCR products from extracted genomic DNA of three commercial milk with different annealing temperatureM.DNA Maker DL1000;1-3.Bright milk,annealing temperature(50,55,60 ℃);4-5.Modern milk,annealing temperature(50,55,60 ℃);6-9.Deluxe milk,annealing temperature(50,55,60 ℃);N:Negative control.
2.2 PCR定性分析
分别以提取的光明、现代、特仑苏鲜牛奶基因组DNA为模板进行定性PCR检测, PCR的电泳结果(图1)表明,通过本研究设计的引物可从商业牛奶基因组DNA中扩增出牛的α-乳白蛋白的预期条带,不同的退火温度相差不大,我们选用55 ℃进行后续定量的扩增实验。根据此结果将扩增得到的PCR条带进行割胶回收做T/A克隆构建pMD19T-La载体。
2.3 重组质粒的酶切鉴定和测序鉴定
将回收α-La基因片段PCR产物连接到pMD19T载体上,提取重组子质粒,进行BamHI与HindIII酶切鉴定,阳性重组质粒所得插人片段约为236 bp,与PCR扩增产物大小一致。进一步将克隆的PCR产物构建质粒pMD19T-La进行DNA序列测定,测序结果通过NCBI上的blast进行同源性比对。结果表明克隆的序列与GenBank中已登录的牛的α-乳白蛋白基因序列一致。说明本实验克隆的序列为牛奶α-乳白蛋白基因序列。标准模板测序结果如图2所示。
2.4 实时荧光定量PCR标准曲线
将重组质粒pMD19T-La用HindIII进行单酶切,回收线性化的质粒作为标准品,并进行定量。将质粒标准品10倍倍比稀释成10个浓度作为扩增模板,每个梯度重复3次测定。实验结果表明在1.12×108~1.12×103拷贝数范围内,Ct值与模板DNA分子的起始拷贝数的对数值呈良好的线性关系(图3),以基因拷贝数的对数值为横坐标,以相应的Ct值为纵坐标作图,标准曲线回归方程为:y=-4.1289x+50.9768(R2=0.9994)。式中:y为循环阈值(Cycle Threshold,Ct);x为质粒DNA拷贝数对数值,通过标准曲线方程和样品的Ct值便可计算出样品中所测组分DNA的含量。

图2 标准模板α -乳白蛋白基因片段DNA测序结果Fig.2 DNA sequence analysis of α -La allergen gene fragment as a standard template
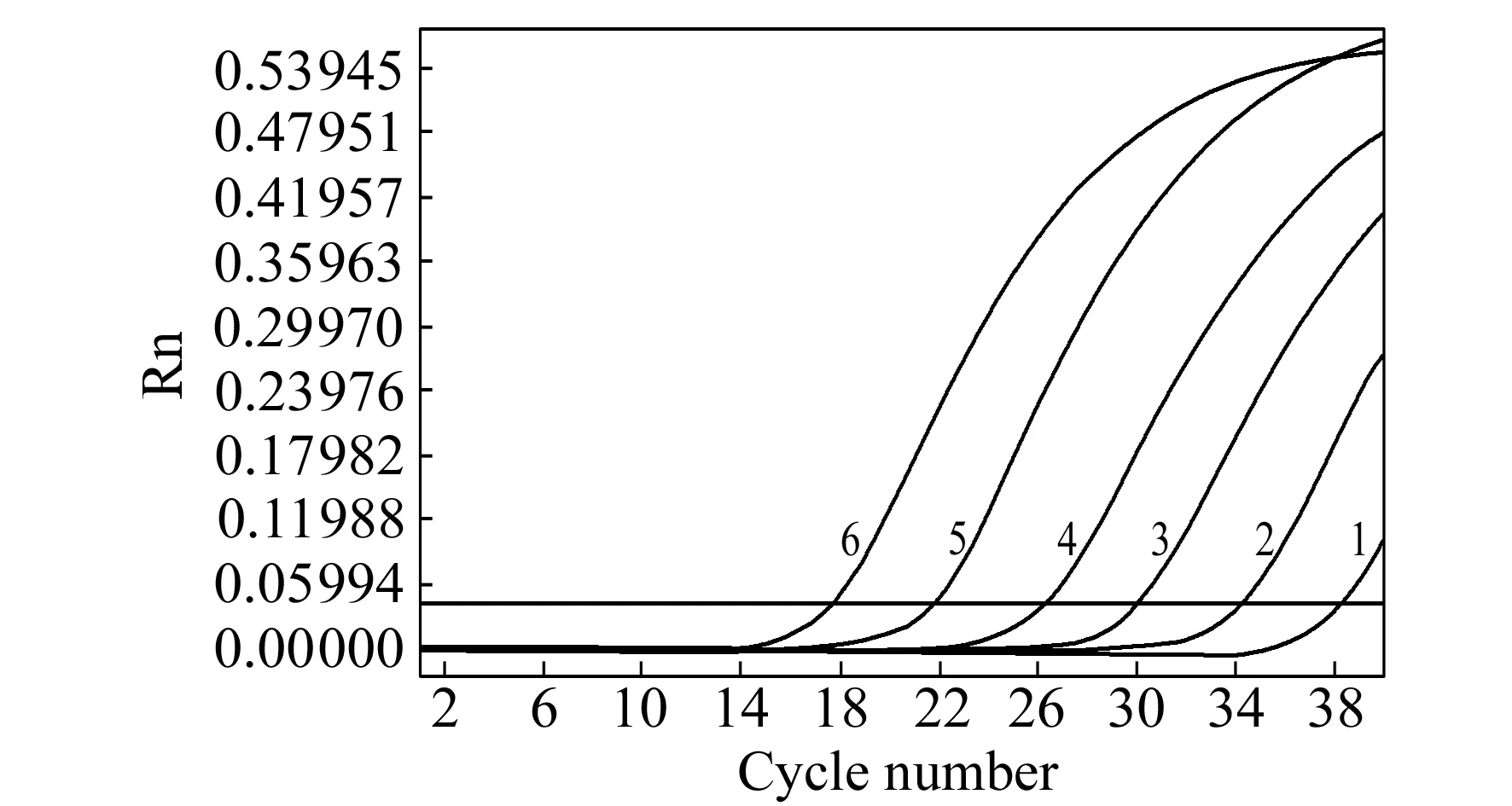
图3 标准模板质粒pMD19T-La DNA 系列梯度的扩增曲线Fig.3 Establishment of amplification curve for detection of α -La DNA template by real-time PCR1-6:template concentration:1.12×103,1.12×104,1.12×105,1.12×106,1.12×107,1.12×108 copies.

图4 PCR扩增特异性Fig.4 Specificity of PCR amplificationM.DNA Maker DL1000;1.soybean;2.milk;3.peanut;4.shrimp;5.wheat;6.sesame.
2.5 方法学评价
2.5.1检测限为考察实际样品α-乳白蛋白的残留量,对该方法的检出限进行分析。将上述光明鲜牛奶进行梯度稀释,提取DNA含量进行实时荧光定量PCR扩增,计算出每毫升液体样品可检测出的最低起始DNA模板拷贝数,以此来判断实际样品的牛奶过敏原DNA含量。对各个梯度的光明鲜牛奶稀释液进行基因组DNA提取,超纯水溶解后以提取的基因组DNA为模板进行Taqman实时荧光定量PCR检测,利用标准曲线计算对应的基因拷贝数。结果分析得出每毫升液体样品可检测到的α-乳白蛋白基因最低拷贝数为1 000,即检测限为1 000 copies/mL。
2.5.2特异性分析为考察所建立的Taqman探针荧光定量PCR检测法是否能特异性针对牛奶α-乳白蛋白基因,以鲜牛奶基因组DNA为阳性对照,提取大豆,花生,河虾,小麦,芝麻常见食物过敏原基因组DNA,PCR扩增后进行2%琼脂糖凝胶电泳。结果显示仅鲜牛奶基因组DNA扩增出目的片段,其他5种常见基因组DNA扩增均成阴性,见图4。说明建立的实时荧光定量PCR具有较好的特异性。
2.5.3重复性分析同一质粒样本选择浓度1.12×104、1.12×106、1.12×108copies进行组内和组间重复性分析。批内:每一浓度样品各一份同时进行3次平行测定分析组内重复性;组间:每一浓度样品各一份6 d内对3个浓度的标准品分别单独进行3次Taqman 实时荧光定量PCR测定,结果如表3所示,组内Ct的变异系数(CV)均在2%以内,组间CV均少于5%,说明建立的牛奶α-乳白蛋白Taqman实时荧光定量PCR检测方法稳定性较好。
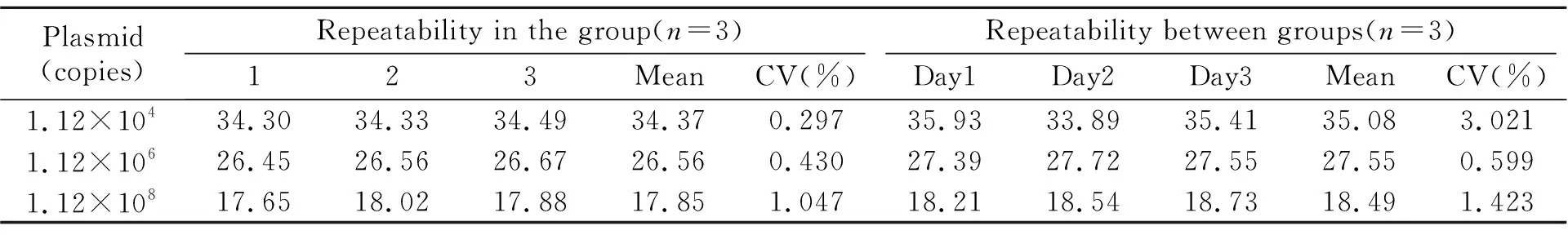
表3 组内、组间重复性结果
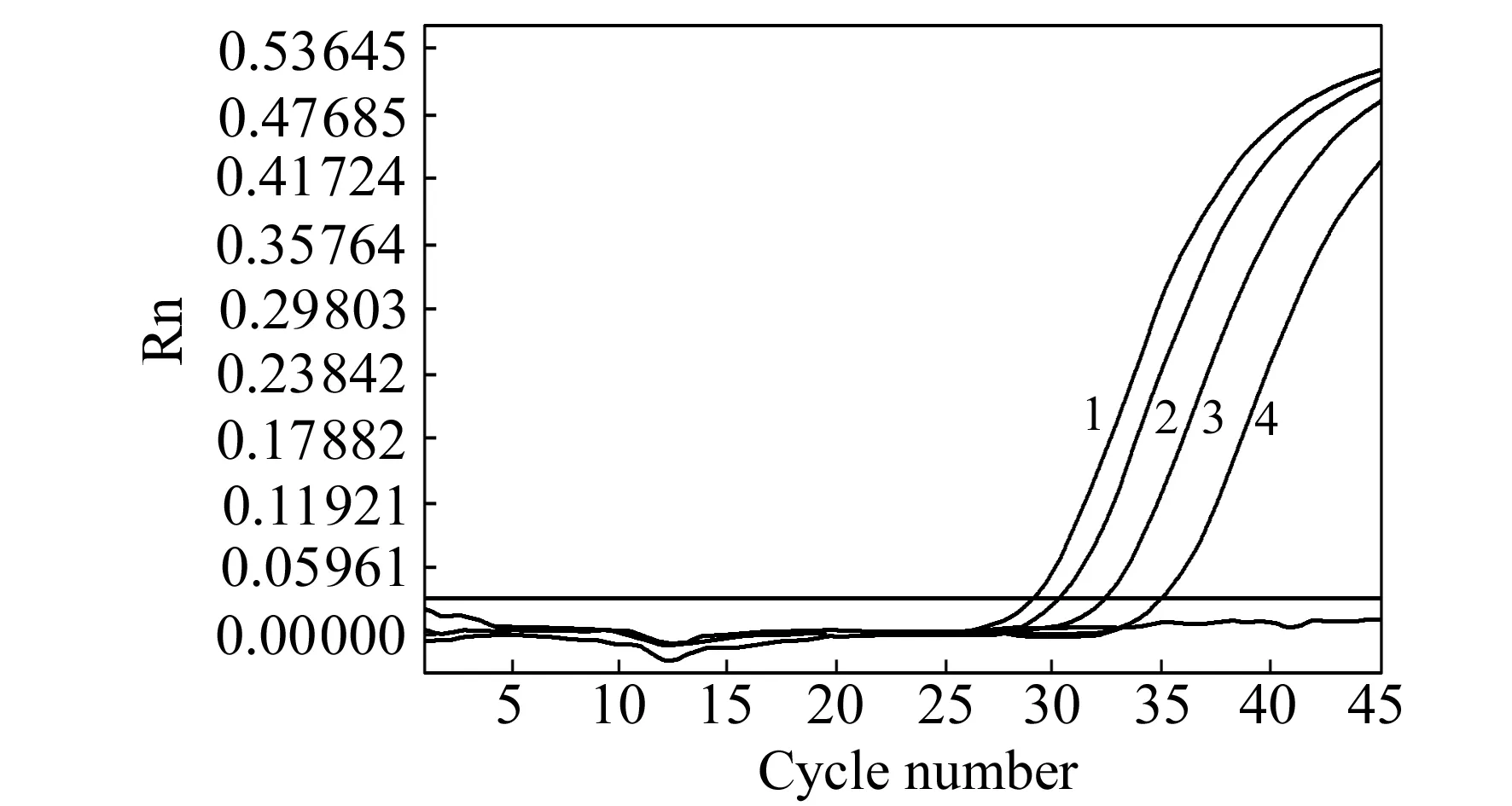
图5 市售食品中牛奶过敏原α -乳白蛋白的实时荧光PCR检测图Fig.5 Detection of real-time PCR for α -La from commercial samples1.Reconstituted milk;2.Wheat germ milk;3.Fiber cereal drink;4.Peanut milk beverage.
2.6 实际样品检测
利用本研究建立的荧光定量PCR方法对5种商业液体样品中的牛奶主要过敏原α-乳白蛋白基因进行检测。利用改进的CTAB法对5种样品的基因组DNA进行提取,进行实时PCR扩增,结果如图5所示。待检食品其中4种均出现明显的扩增曲线,且Ct值≤35,则判断样品中检出过敏原α-乳白蛋白成分,与标签一致。E品牌果粒奶优无扩增曲线,牛奶α-乳白蛋白成分检测为阴性,推测该饮料中虽然含有牛奶制品但量极少以至于过敏原α-乳白蛋白DNA含量极低,未能进行PCR扩增。利用标准曲线计算食品中牛奶α-乳白蛋白的基因DNA拷贝数,结果如表4所示。

表4 市售食品中牛奶过敏原α -乳白蛋白的检测结果
Postive:≥1 000 copies/mL;Negative:≤1 000 copies/mL.
3 结论
本研究设计了特异性引物和探针,对目标基因α-乳白蛋白的一段DNA序列进行荧光定量PCR扩增,构建重组质粒标准品,建立标准曲线。结果表明,该质粒作为标准模板建立的标准曲线线性关系良好,在1.12×108~1.12×103拷贝数范围内,Ct值与质粒拷贝数的对数值呈线性关系,通过标准曲线,可对目的基因浓度进行准确定量。用本研究设计的引物和探针对几种常见的食物过敏原进行扩增,结果显示该检测方法特异性针对α-乳白蛋白,同时该方法对液体样品的检测限达到1 000 copies/mL。利用本研究建立的荧光定量PCR对5种市售液体样品进行检测,4种样品出现明显的扩增曲线,通过标准曲线分析,可得出每种样品中α-乳白蛋白的水平,1种检测结果为阴性,未检测到α-乳白蛋白目的基因,推测其α-乳白蛋白含量较低,不能进行有效扩增。
