卤代烃消去反应实验中强碱醇溶液的变色与配制
2015-10-15陆燕海
摘要:关于卤代烃消去实验中强碱性醇溶液的配制问题,对碱的选择、KOH乙醇溶液易变色及其配制优化等进行了探索,得出结论:(1)在乙醇中KOH溶解性比NaOH好,碱性更强,有助于卤代烃按E2机理消去生成烯;(2)在碱性环境中,乙醇氧化生成的乙醛会缩合成有色物质,导致碱乙醇溶液放置变黄;(3)相比乙醇作溶剂,乙二醇更适宜用于配制饱和KOH溶液。
关键词:卤代烃;消去反应;亲核取代;KOH乙醇溶液;实验探究
文章编号:1005–6629(2015)8–0067–04 中图分类号:G633.8 文献标识码:B
卤代烃的消去反应是重要的化学课堂教学演示实验,现行3套高中化学新教材都编有此教学内容。为改善实验效果、提高演示成功率,许多一线同行对该实验进行了广泛、深入的研究,苏教版《有机化学基础》教材从2006年至今也已历三次修改而日臻完善。可在组内备课讨论时,大家还提出了一些很有研究意义、值得探讨的问题,如为什么选择KOH而不是NaOH作为反应用碱;为什么KOH乙醇溶液放置会变为(棕)黄色;溶解KOH时是否一定要用乙醇,改用其他醇作溶剂久置是否也会变色……等等。本文旨在探讨以上问题的基础上,对强碱醇溶液的变色和配制等谈一些粗浅的认识与体会,供同行们教学时参考。
1 卤代烃消去反应用碱的选择
卤代烃失去卤化氢的反应一般都是按E2反应机理来进行的。要让卤代烃消去生成烯,必须在强碱(或醇钠、氨基钠等)的醇溶液中共热实现。不同的中学化学教材在卤代烃消去反应实验与条件等问题上有着各自的处理方式。以下是几种常用教材对该内容的编排情况。
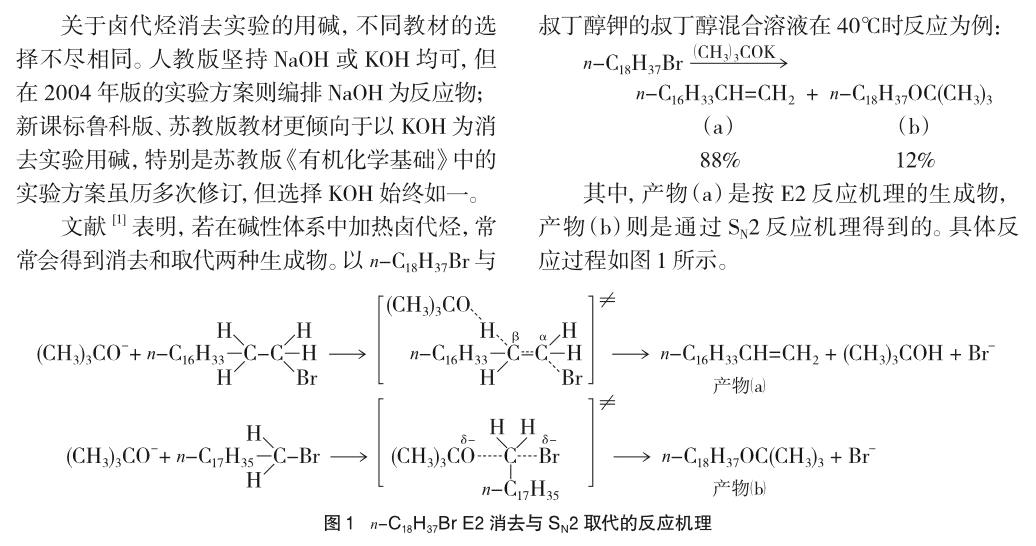
对照以上两种产物的生成机理,不难发现两者区别主要在于,E2机理中试剂进攻β-H,继而将β-H夺走,促使卤原子离去;而在SN2反应机理中,试剂进攻的则是α-C,并与之形成化学键后导致卤原子的脱落。在反应体系中,上述两个过程并存,并相互竞争。显然,若试剂亲核能力越强、碱性越弱、体积越小时,反应越趋向于SN2方向发生;当试剂的碱性越强、浓度越大、体积越大、反应温度越高时则更有利于E2反应的进行。
查得常温下NaOH和KOH在乙醇中的溶解度分别为17.3g、39.0g[2]。也有学者实验测定了NaOH和KOH在乙醇中沸腾状态下的溶解度数据,结果如表2[3]。很明显,KOH在乙醇中的溶解性比NaOH要大得多,碱性也更强,因此选择KOH作为实验用碱,对卤代烃按E2机理发生消去会更有利。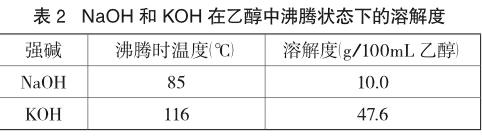
对比实验也表明,卤代烃与饱和KOH乙醇溶液共热生成烯的实验效果的确略胜于NaOH乙醇溶液。此外,若我们将金属钠与乙醇反应后的溶液(实际为乙醇钠溶液)进行实验,有助于增强试剂碱性,保持溶剂较小极性,从而提高卤代烃消去的比例,检验产物烯烃的实验现象明显。还有必要指明的是,常见卤代烃无论与饱和NaOH乙醇溶液还是饱和KOH乙醇溶液(包括乙醇钠)共热,按 E2机理生成烯的产率虽各有差别,但一般都不会超过15%,主要还是按SN2机理发生取代反应生成醚和醇,即消去反应在上述体系中所占比例仍然很小,只是次要反应。
2 KOH乙醇溶液变色现象探讨
为了教师实验方便准备,饱和KOH乙醇溶液一般都是课前提前配制的。但KOH乙醇溶液在放置过程中较快就会变(棕)黄色,在教学时不仅容易分散学生注意力,教师也可能身陷“说不清”的尴尬境地。为此,对KOH乙醇溶液返黄现象的原因及影响因素进行了实证探索。
2.1 影响因素探索
实验1 KOH浓度对试剂变色的影响
室温(14℃)下,配制饱和KOH乙醇溶液并分装于6支试管中。其中,试管1补加两片固体KOH,试管2保持不变,剩余4支用无水乙醇按相应体积比稀释得到不同浓度的KOH乙醇溶液。将上述样品分别静置保存,观察并对比各溶液的变色情况,现象见表3。
结论:相同条件下,KOH乙醇溶液的浓度越大,溶液变黄速度就越快;溶液浓度越小,变黄速度越慢。随着时间的延长,溶液的颜色从淡黄色、黄色会逐渐加深为棕黄色、棕色(甚至棕褐色)。
实验2 环境温度对试剂变色的影响
用4支18mm×180mm试管各取6mL饱和KOH乙醇溶液,并补加一片KOH固体以加快变色速率,缩短实验时间。然后塞上橡胶塞,分别置于0℃、20℃、40℃和60℃的水浴中。基于节能及便于实验操作的考虑,统一在水浴控温5h后对比观察各溶液变色的深浅。结果表明,实验后的溶液不同程度地分别从无色变为浅黄色、黄色、棕黄色和棕色。
结论:同等条件下,环境温度越高,饱和KOH乙醇溶液的变色程度越深。
实验3 光照对试剂变色的影响
将两支小试管各取6mL饱和KOH乙醇溶液,然后塞上橡胶塞,一支外裹黑色包装纸置于暗室中,另外一支持续日光灯下照射。放置过夜,对比观察两试管溶液颜色的变化情况。两试管溶液均从无色变为黄色,对照下差别并不明显。
结论:相同条件下,光照对饱和KOH乙醇溶液的变色速度无显著影响。
实验4 氧气对试剂变色的影响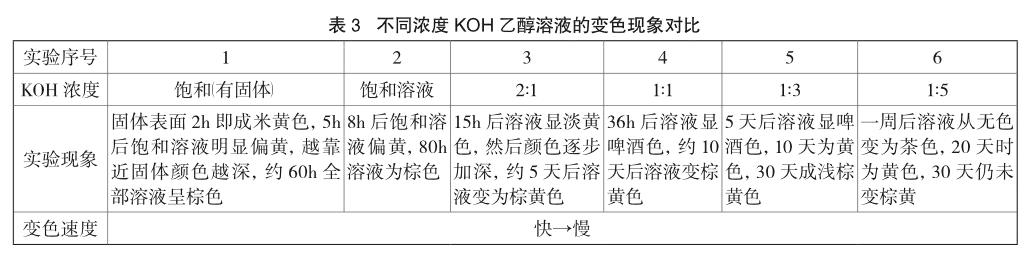
取两支18mm×180mm的试管,一支试管中加入6mL饱和KOH乙醇溶液并通纯氧,再用橡胶塞塞紧,另一支试管加满饱和KOH乙醇溶液后塞紧,放置观察。前者8h已明显变黄,30h溶液变为棕色,而后者20h溶液才明显变黄。控制相同时间对照两种溶液颜色的变化,前者都深于后者。若拔下橡胶塞,明显能感受到前者试管拔动时要比通常的试管塞要困难些(说明变色时吸收氧气导致体系压强减小)。
结论:相同条件下,有氧环境中的饱和KOH乙醇溶液变色速度更快,说明氧气参与了反应,加速了溶液的变色过程。
2.2 变色现象分析
通常条件下,在KOH浓度大、保存温度高和有氧环境时,其乙醇溶液的变色就快。由于在强碱性、乙醇溶液的极端环境下,微生物难以生存,参与有机物的自然生化降解几乎不可能存在。回顾乙醛、葡萄糖等有机物在碱性条件下变色的教学经历[4,5],笔者认为乙醇被氧气氧化生成活性更好的乙醛,并在碱性环境中使之进而缩合成有色物质是可信的。
乙醇在空气中氧化的第一步产物是乙醛。由于乙醛中存在α-H,受到醛基吸电子诱导效应影响,碱性环境中增加了酸性解离程度,形成负离子。按共振论观点,该负离子存在(I)和(II)的共振杂化体,能继续与其他乙醛分子发生羟醛缩合生成2-羟基丁醛,反应机理如图2所示。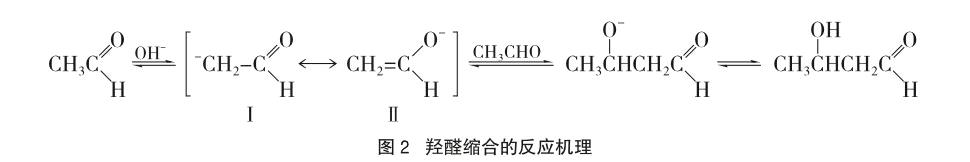
生成的β-羟基醛发生分子内脱水得到α,β-不饱和醛,可继续与乙醛或自身缩合,如此反应可得分子量更大、存在共轭结构的有色分子,可能的转化过程[6]可简示为: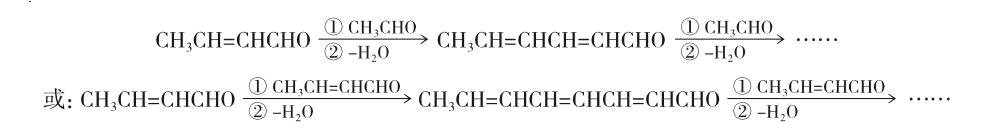
因乙醛及缩合产物等均有醛基结构,可将变色后饱和KOH乙醇溶液用菲林反应实验加以验证:用试管取一定量实验1中久置变色后的饱和 KOH乙醇溶液,滴加3~4滴CuSO4溶液,得天蓝色沉淀,在50℃水浴中加热,观察到悬浊液中固体有弱阳性的颜色变化,即试样中存在少量含醛基物质。
3 KOH醇溶液配制的优化研究
为减少KOH醇溶液的变色对学生学习的干扰,又不至影响教师演示卤代烃消去的实验效果,有必要对KOH醇溶液的配制方法作进一步优化。基于KOH的强碱性、良好的溶解性及实验室常见药品等优势,确定KOH作为实验用碱,而关于醇溶剂则选择甲醇、乙醇、乙二醇和丙三醇等四种中学实验室常见醇。
查得,常温下KOH在甲醇和乙醇中的溶解度分别为55.0g和31.0g[7]。因乙二醇和丙三醇的数据文献未见,故进行实测。在确定一定量KOH固体下,在两个锥形瓶中分别加乙二醇(或丙三醇)并水浴控温,充分振荡至恰好溶解,求得KOH在乙二醇、丙三醇中的溶解度约为52.3g、15.7g。可见,丙三醇作溶剂KOH的溶解能力较差,又是粘稠液体,不便于实验操作。综合考量,选择甲醇、乙醇和乙二醇作为研究对象进一步对碱醇溶液的变色情况及用于卤代烃消去实验的效果进行探索。
实验5 饱和KOH醇溶液的变色实验
在盛有KOH固体的烧杯中加入一定量的甲醇,充分搅拌(固体不完全溶解)后静置,取上层清液于试剂瓶中。如此方法,配得饱和的KOH乙醇溶液和乙二醇溶液。在通常条件下,放置并观察溶液的变色情况,见表4。
实验6 用于卤代烃消去实验的对比
按图3装置所示,向试管中注入5mL 1-溴丙烷(沸点70.9℃)和10mL饱和KOH乙醇溶液,小试管中装3mL 0.01%高锰酸钾溶液,均匀加热并计时,高锰酸钾溶液紫红色完全褪去共耗时 5.3min。然后再分别更换成饱和KOH的甲醇溶液、饱和KOH的乙二醇溶液,重复以上操作,测得褪色时间分别是3.1min、3.6min。
在醇分子中,若羟基相连基团供电越多,氧原子上电子云密度升高越明显,越不利于羟基中氢原子的解离。可知,在空气中甲醇、乙二醇相对乙醇理论上更易成醛,但生成物进一步缩合成更大有色分子的行为则是受阻的,并且强碱性环境中无α-H的醛也相对易发生歧化。因此,用甲醇和乙二醇配得的饱和KOH溶液在较长时间内(静置20天)仍可保持无色状态。
已知,甲醇、乙醇和乙二醇的沸点分别为64.5℃、78.4℃和197.3℃。在实验条件下,甲醇和乙醇都易挥发,不仅反应温度提不高,而且实验中的水洗操作难将醇蒸气除尽,与高锰酸钾反应,导致其褪色时间缩短,从而干扰产物烯烃的检验。此外,甲醇经消化道、呼吸道或皮肤摄入都会产生毒性反应,甲醇蒸气会损害人的呼吸道粘膜和视力[9]。与之相比,乙二醇则不存在以上弊端。
综上所述,选用乙二醇配制饱和KOH溶液用于卤代烃消去实验,无论从试剂保存角度、反应温度可控范围,还是从演示实验效果等因素考量,相对乙醇(或甲醇)而言都是更好的选择。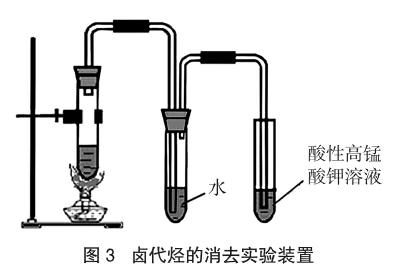
参考文献:
[1]刑其毅.基础有机化学(第三版)[M].北京:高等教育出版社,2005:272~273.
[2][7]印永嘉.大学化学手册[M].济南:山东科学技术出版社,1985:271~272.
[3]秦丙昌,张贺飞,陈传站.溴乙烷与氢氧化钠或氢氧化钾乙醇溶液反应的研究[J].化学教学,2002,(6):13~15.
[4][6]陆燕海,陈丽.不同种类氧化铜氧化乙醛的实验研究[J].化学教学,2010,(5):10~11.
[5]陆燕海.葡萄糖溶液放置变色现象的探究[J].化学教学,2012,(12):51~53.
[8]高鸿宾.有机化学(第四版)[M].北京:高等教育出版社,2005:335.
[9] http//baike.baidu.com/link?url=qBFQKfaV-8nkBkE1AaJQjl8YXNEUoaPPG7QFBFQtKFsHQAxy8vn9-ZvIae7zPnz5RindQ_e5vUFzH_ASHRyHna.
