一株多环芳烃降解菌吉2及其降解能力
2015-10-15齐义彬李红曹美娜崔庆锋俞理董汉平
齐义彬,李红,曹美娜,崔庆锋,俞理,董汉平
一株多环芳烃降解菌吉2及其降解能力
齐义彬1,李红2,曹美娜3,崔庆锋4,俞理4,董汉平4
(1中国科学院渗流流体力学研究所,河北廊坊065007;2新疆油田实验检测研究院采收率研究所,新疆克拉玛依834008;3南开大学生命科学学院,天津300071;4中国石油勘探开发研究院廊坊分院,河北廊坊065007)
从中原油田毛8区块油田采出液中分离得到一株多环芳烃(PAHs)降解菌吉2,根据形态观察、生理生化、16S rRNA基因、管家基因和DNA-DNA同源性分析判断,吉2属于一株新种。研究发现,该菌能在萘和芘为唯一碳源的无机盐培养基中生长,也能够降解萘、菲、蒽和芘的混合PAHs。7 d对这4种PAHs的降解率分别达到了61.4%、86.6%、69.9%和18.6%。吉2对原油有很好的降解及降黏作用,7 d原油的降解速率达到了134 mg·d-1,黏度降低了29.3%。傅里叶变换红外光谱、族组分和气相色谱-质谱分析显示吉2能够优先利用原油中含PAHs的芳香烃和胶质等组分,原油中萘系列、菲系列、噻吩系列、芴系列、䓛系列、C21-三芳甾醇、芘和苯并(a)芘的相对含量都有一定程度的降低。实验结果表明吉2具有修复PAHs和原油污染的水体或土壤环境的能力,为微生物修复PAHs污染和原油污染提供了一种可行的途径。
原油;多环芳烃;微杆菌属;降解
引 言
多环芳烃(PAHs)指由2个或2个以上苯环稠合而成的一类广泛存在于环境中的芳香化合物[1]。PAHs是一种普遍存在的环境污染物,由于它具有广泛存在性、持续性、难降解性等性质,因此被许多环境学家重视而深入研究[2]。PAHs随着分子量的增加,其生物毒性和基因毒性都逐渐增强,在食物链中生物放大效应也越来越明显[3]。最近的研究表明,水生动物患癌性疾病的概率与底泥沉积物中PAHs的浓度密切相关[4]。由于PAHs具有毒性、致癌性和广泛存在性等特点,美国环境保护署(EPA)将16种PAHs列为优先污染物[5]。
PAHs可以通过许多方式释放到环境中,包括蒸发、光氧化、化学氧化、生物富集和吸附在土壤颗粒[6-7]。环境中PAHs污染物浓度在逐年增加,已威胁到人类的身体健康,在自然界自净能力的基础上,人类应该通过各种方式促进积累在环境中的PAHs快速转化降解,修复被PAHs污染的环境[8-9]。相比于传统修复的方法,生物降解修复由于具有诸多优点,已被开发为一种高效去除PAHs的技术[10-11]。生物降解PAHs主要是通过引入降解微生物提高污染物的生物降解速度和程度[12]。目前,大多数研究集中在发现具有降解PAHs能力的细菌,但是已报道的降解微生物大多属于分枝杆菌属、白腐菌属、鞘氨醇单胞菌属、假单胞菌属、芽孢杆菌属以及解环菌属等[13-15],新的高效降解菌株的筛选和研究相对不足;PAHs降解的研究大部分利用单一多环芳烃如萘或芘作为碳源去表征菌株的降解PAHs的能力[16-17]。而实际情况是,原油污染是环境中PAHs的主要来源,石油工业及其相关地域是环境中PAHs污染物的主要聚集区[18],可以说,菌株在原油中降解能力的测定才是表征菌株环境修复能力的重要体现。
因此,本文的核心内容是筛选具备降解原油中PAHs的新菌种并评价其降解能力。利用石油胶质为碳源筛选PAHs降解菌,对菌株分类鉴定,分析其降解PAHs和去除原油中PAHs能力。
1 实验材料和方法
1.1 实验材料
1.1.1 实验油水样 采集样品包括原油和采出水来自于中原油田毛8区块A井,渗透率为0.699mm2,油藏温度为35℃,采出水矿化度为6199.2 mg·L-1,水质为NaHCO3型。原油脱水脱气后,在35℃下黏度为1036 mPa·s,胶质和沥青质的含量为41.79%。
1.1.2 培养基 无机盐培养基(g·L-1):K2HPO41.0, KH2PO41.0,NaNO34.0,MgSO40.5,(NH4)2SO42.0, 酵母粉0.2,pH 6.8~7.2, 121℃灭菌30 min。LB培养基(g·L-1):酵母粉5,蛋白胨10,NaCl 5,pH 6.8~7.2, 121℃灭菌30 min。加入2%琼脂粉制成LB平板。
1.1.3 实验菌株DSM 12966和DSM 13468,两株菌均为标准化模式菌株。由德国ZALF中心提供。
1.2 实验方法
1.2.1 原油中胶质提取 将一定体积的A井原油溶解于15倍体积的正庚烷中,1000 r·min-1离心10 min,沉淀物质即为沥青质。将上清液取出,并按照2 g·ml-1原油加入细孔硅胶,用搅拌器充分搅拌,1000 r·min-1离心5 min分离硅胶,然后用苯冲洗吸附了胶质的硅胶,直到冲洗液为浅黄色。最后用含7%甲醇的二氯甲烷溶液冲洗,直到冲洗液接近无色。将苯冲洗液及含甲醇的二氯甲烷冲洗液合并,用旋转蒸发器蒸出溶剂,真空干燥,剩余的黑色物质即为石油胶质[19]。石油胶质是由不同高分子化合物组成的混合物,其中的化合物大部分属于PAHs[20],可用于筛选PAHs降解菌。
1.2.2 富集培养及PAHs降解菌的筛选 配制以2 g石油胶质为唯一碳源的100 ml无机盐培养基并接种10 ml A井水样,35℃摇床振荡培养7 d直至胶质乳化,将5%富集培养基接种到新鲜的含2%胶质的无机盐培养基中,重复驯化3次。将0.1 ml的富集培养基用无菌水稀释到10-5、10-6、10-7。取100ml涂覆到LB平板上,35℃培养。挑选菌落形态和大小不同的单菌落,并对它们的乳化胶质的能力进行单独测定,选取乳化能力最佳的菌株。
1.2.3 菌株培养 将筛选菌株接种到100 ml无机盐培养基+2 g石油胶质中,发酵时间为72 h,培养温度为35℃,接种量为5%,150 r·min-1振荡培养。
1.2.4 DNA提取 将待DNA同源性分析的菌株在无机盐培养基中培养至对数中后期(12 h),5000 r·min-14℃离心10 min收集菌体,参照文献[21]的方法提取微生物基因组。DNA纯度要求260:280:230=1.0:0.515:0.450,浓度要求260>2.0。
1.2.5 16S rRNA基因种属鉴定 采用引物8F(5′-AGA GTT TGA TCC TGG CTC AG-3′)和引物1541R(5′-AAGGAGGTGATCCA GCC-3′),扩增其16S rRNA 基因,并连接到EASY-T3载体上,转化到DH5α感受态细胞中,将插入片段大小正确(约1.5 kb)的阳性克隆送到上海美吉生物科技有限公司测序。PCR条件为:94℃,5 min;94℃,45 s;55℃,45 s;72℃90 s;30个循环;72℃,10 min,4℃保存。
1.2.6 DNA-DNA同源性分析 用超声波破碎法把DNA样品破碎成为2×105~5×105之间小片段。用0.1×SSC准确配制成260=1.5~2.0范围内的某一吸光值。参照文献[22]利用吸光度法测定菌株DNA之间的同源性。
1.2.7 管家基因、、、扩增及测序 参照文献[23]中设计的引物与PCR方法,扩增、、、基因。PCR 反应体积为50ml, PCR 产物经1%琼脂糖凝胶电泳, 利用胶回收试剂盒纯化PCR 产物。回收PCR产物送到上海美吉生物科技有限公司测序。
1.2.8 微生物PAHs降解能力的测定方法 评价微生物降解单一PAHs(萘和芘)以及PAHs混合物(萘、菲、蒽和芘)的能力。将2 ml吉2发酵液接种到以单一PAHs(萘和芘,浓度为500 mg·L−1)为唯一碳源的100 ml无机盐培养基中。恒温摇床150 r·min-135℃振荡培养。分别在0、3、7、10、14 d测定PAHs的浓度,用分光光度计600条件下测定微生物菌体的光密度。将2 ml微生物发酵液接种以PAHs混合物(萘、菲、蒽和芘,每种PAH的浓度为500 mg·L−1)为碳源的100 ml无机盐培养基中[24]。以上实验以不接种微生物的无机盐培养基恒温摇床150 r·min-135℃振荡培养7 d作为对照。用乙酸乙酯提取降解后培养基中的PAHs并用GC-FID对剩余量进行定量分析[25]。由于实验用的PAHs会有一定的风化作用,因此实验中微生物的降解率为去除对照组风化比例后的降解百分比。
1.2.9 微生物对原油的降解和降黏能力的测定方法
将微生物发酵液以5%的接种量接种于含2 g原油的100 ml发酵培养基中,35℃,150 r·min-1振荡培养7 d,转移摇瓶内的所有原油和培养基到预先称重的250 ml离心杯中,8000 r·min-1离心10 min后,除去培养基和菌体。40℃温箱烘干到恒重并称重,根据离心杯的质量变化计算原油降解速率[26]。50 ml微生物发酵液与50 g中原油田A井原油混合后[27], 35℃,150 r·min-1振荡培养7 d,将振荡培养后的发酵体系8000 r·min-1离心10 min收集原油并电脱水干燥。采用Brookfield LVDV-Ⅲ提桶黏度计测量黏度。
1.2.10 原油的傅里叶红外光、族组分和气相色谱质谱分析 将微生物降解前后的A井原油电脱水后,取5 mg原油与KBr一起研磨压片,采用FTS-40傅里叶红外光谱[28]仪扫描,扫描波数为400~4000 cm-1。根据硅胶-氧化铝双吸附法(SY/T5119-2008)分析微生物降解前后原油中族组分含量的变化[29]。根据原油和沉积有机质烃类气相色谱分析方法(SY/T 5779—2008)分析微生物降解前后PAHs相对含量变化[30]。色谱条件:安捷伦7890-5975c气相色谱质谱联用仪(安捷伦,圣克拉拉,加州,美国);色谱柱:HP-5MS 弹性石英毛细柱(60 m×0.25 mm×0.25 m);载气为氦气(纯度为99.999%);载气流速,1 ml·min-1;进样口:300℃。程序升温:初温柱温50℃保持1 min,再以15℃·min-1升至120℃,以3℃·min-1升至300℃,保持25 min。质谱:EI 源,绝对电压1047 V;全扫描。
1.2.11 核苷酸序列NCBI登记信息 将文中测序基因序列提交到GenBank数据库中,其登陆编号如下:16S rRNA(KJ627769),(KM457100),(KM457098),(KM457099),(KM457101)。
2 结果与分析
2.1 菌株的描述与种属鉴定
经分离纯化获得一株能够降解PAHs的菌株,编号为吉2。在LB平板上,吉2菌落表面扁平、不透明、边缘整齐、黄色。吉2菌体革兰染色呈阳性,杆状,大小为(1.0~4.0)mm×(0.4~0.8)mm。最适生长温度为35℃。
将测序得到的16S rRNA以及管家基因、、、与NCBI数据库中进行比对,选取与基因序列同源性最高的模式菌株的标准序列,通过Neighbor-Joining算法构建各基因系统发育树。其结果如图1所示。
吉2与DSM 12966和DSM 13468的16S rRNA相似度均为99%,但是吉2管家基因、、、与各模式菌株的管家基因的最高相似度均低于91%(图1)。DNA-DNA同源性分析表明吉2与DSM 12966 DNA同源性为39.8%,与DSM 13468 DNA同源性为43.7%。根据国际细菌学分类委员会的建议DNA-DNA同源性≥70%为确定新种的最低标准[31]。吉2属于一株新种。
2.2 PAHs为唯一碳源的微生物降解
sp.nov吉2能够以萘和芘为唯一碳源进行生长。以萘和芘为唯一碳源的生长曲线和对萘和芘的降解率如图2所示。从图中可以看出,吉2在培养第3 d时萘降解率达到了59.5%,培养7 d时降解率达到63.1%。由于萘具有挥发性,此时对照组7 d萘的风化比例达到37.9%。吉2也能够降解4环的PAH芘,14 d芘的降解率为46.5%,对照组风化比例为5.0%。
吉2也能够利用PAHs混合物(萘、菲、蒽和芘)作为唯一碳源。其降解PAHs混合物的效果如表1所示。吉2对这4种PAHs具有不同的降解能力。3 d萘的降解率达到了56.7%以上,7 d萘降解率达到了61.4%,7 d对菲、蒽、芘的降解率也分别达到了86.6%、69.9%和18.6%。可以发现,PAHs分子结构越复杂,吉2的降解率越低。
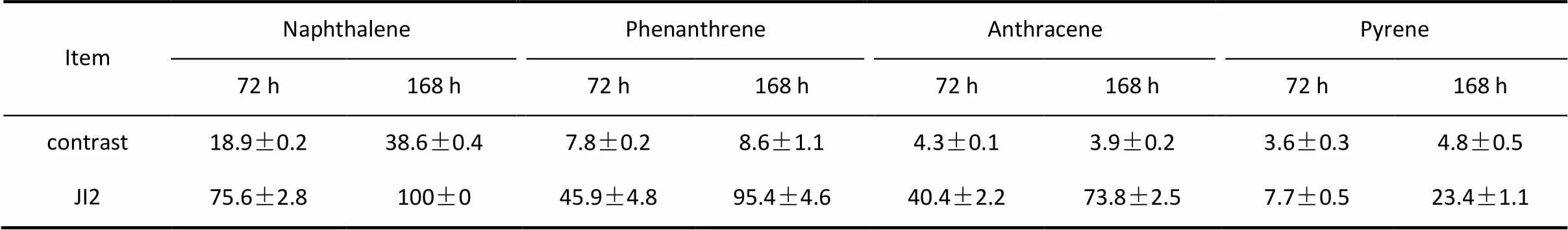
表1 吉2在无机盐培养基中对PAHs混合物(萘、菲、蒽和芘)的降解率Table 1 Naphthalene, phenanthrene, anthracene and pyrene removal rate in inorganic salt culture medium inoculated with Microbacterium sp. JI 2/%
2.3 微生物对原油中PAHs的降解
菌株吉2对原油有很好的降解及降黏作用,7 d后原油的降解速率为134 mg·d-1,黏度降低了29.3%。傅里叶红外光谱(IR)分析降解前后原油如图3所示,由于原油不同组分中相同官能基团的吸收特征会重叠在相同波数段上,各吸收峰与单一原油组分的对应解释是十分困难的,只能从吸收峰的变化对应官能基团量的变化解释降解效果。降解后,一个大而宽的吸收峰出现在3405.38 cm-1处,这是分子间O—H氢键的特征吸收峰。说明原油组分的氧化降解程度的提高。一个在1652.01 cm-1附近的吸收峰明显增高,这是苯环的特征吸收峰,表明部分PAHs被降解成单一苯环及其衍生物。此外一系列吸收峰出现在700~1300 cm-1,说明在原油降解的过程中出现了如羟基和甲基等新的官能团[32-33]。
降解前后原油族组分分析结果如图4所示。为确保分析结果的可靠性,所有原油族组分分析的回收率均在90%以上。结果表明,吉2降解后原油中芳香烃的含量从26.4%降低到19.93%。胶质的含量也降低了2.57%。然而饱和烃的含量却没有明显变化,这说明吉2能够降解原油中的芳香烃和胶质。由于胶质和芳香烃的含量与原油的黏度相关[34],这与降解后原油黏度降低相吻合。同时,也说明该菌株具有特殊的碳源底物偏好性,相比于饱和烃优先降解芳香烃等PAHs。
吉2降解后原油中芳香烃的气相色谱-质谱分析如图5所示,结果表明,原油中萘系列、菲系列、噻吩系列、芴系列、䓛系列、C21-三芳甾醇、芘和苯并(a)芘的相对含量有所降低。说明吉2对原油中PAHs具有较强的降解作用。
3 讨 论
3.1 高效PAHs降解菌株的筛选
筛选具备降解PAHs能力的高效菌种一直是该领域的研究重点[35]。在本文中,以石油胶质为唯一的碳源从油田采出水中筛选到一株能够以PAHs为碳源生长的菌株吉2,16S rRNA基因系统发育分析认为该菌属于,而之前的研究中关于该属PAHs降解能力的报道很少。吉2是一株高效PAHs降解菌,在无机盐培养基中7 d对萘、菲、蒽和芘的降解率分别达到了61.4%、86.6%、69.9%和18.6%。而且管家基因和DNA同源性分析认为吉2属于一株新种。深入研究该菌降解途径,可能为微生物修复PAHs污染提供了新的可行途径。
3.2 降解原油污染环境中的PAHs
石油工业的快速发展也引起了石油污染的蔓延,尤其是对土壤及水体的污染。近年来,石油己经成为土壤环境和水体环境的主要污染物之一。Toledo等[36]认为环境中的PAHs主要是由石油、煤炭、纸张、作物秸秆等不完全燃烧以及在还原状态下热分解而产生的,特别是化石燃料的燃烧是环境中PAHs的主要来源。Juhasz等[37]认为原油污染土壤和水体中含有高浓度的PAHs。因此对原油污染环境中PAHs的降解是减少PAHs污染的一个重要部分。然而在通常情况下,微生物降解烃类按照从易到难的顺序:短链正构烷烃>长链正构烷烃>长链异构烷烃>环烷烃>芳香烃>杂环碳氢化合物>沥青质[38]。本文结果表明sp.nov吉2能够降解原油中的芳香烃和胶质。
4 结 论
(1)以石油胶质为唯一碳源从中原油田油井采出水中筛选到一株能够降解PAHs的菌株吉2。16S rRNA,管家基因和DNA同源性分析认为吉2 属于一株新种。
(2)吉2能够在以萘和芘为碳源的无机盐培养基中生长,利用萘和芘为唯一的碳源和能源。7 d对萘的降解率达到了63.1%,14 d对芘的降解率达到了46.5%。吉2在无机盐培养基中也能够降解萘、菲、蒽和芘的混合PAHs,7 d对这4种PAHs的降解率达到了61.4%、86.6%、69.9%和18.6%。
(3)菌株吉2对原油有很好的降解及降黏作用,7 d原油的降解速率达到了134 mg·d-1,黏度降低了29.3%。傅里叶红外﹑族组分和气相色谱-质谱分析吉2能够优先利用原油中含PAHs的芳香烃和胶质等组分。原油中萘系列、菲系列、噻吩系列、芴系列、䓛系列、C21-三芳甾醇、芘和苯并(a)芘的相对含量都有不同程度的降低。
(4)吉2能同时降解水体中多种PAHs,也能降解原油中多种PAHs,为生物修复PAHs污染物和环境原油污染提供了一种可行的途径。
References
[1] Gu Z P, Feng J L, Han W L, Li L, Wu M H, Fu J M, Sheng G. Diurnal variations of polycyclic aromatic hydrocarbons associated with PM2.5 in Shanghai, China [J]., 2010, 22(3): 389-396
[2] Chen B L, Wang Y S, Hu D F. Biosorption and biodegradation of polycyclic aromatic hydrocarbons in aqueous solutions by a consortium of white-rot fungi [J]., 2010, 179: 845-851
[3] Hu Yanjun (胡艳军), Guan Zhichao (管志超), Zheng Xiaoyan (郑小艳). Analysis on polycyclic aromatic hydrocarbons in pyrolysis oil from municipal wastewater sewage sludge [J].(化工学报), 2013, 64(6): 2227-2231
[4] Quan X C, Tang Q, He M C, Yang Z F, Lin C Y, Guo W. Biodegradation of polycyclic aromatic hydrocarbons in sediments from the Daliao River watershed, China [J]., 2009, 21: 865-871
[5] Guo C L, Zhou H W, Wong Y S, Tam N F Y. Isolation of PAH-degrading bacteria from mangrove sediments and their biodegradation potential [J]., 2005, 51: 1054-1061
[6] Ding J, Cong J, Zhou J, Gao S X. Polycyclic aromatic hydrocarbon biodegradation and extracellular enzyme secretion in agitated and stationary cultures of[J]., 2008, 20: 88-93
[7] Zhao H P, Wang L, Ren J R, Li Z, Li M, Gao H W. Isolation and characterization of phenanthrene-degrading strainssp. ZP1 andsp. ZP5 [J]., 2008, 152: 1293-1300
[8] Ji Aimin (姬爱民), Zhang Shuting (张书廷), Xu Hui (徐晖), Li Haiying (李海英), Zhang Huanxin (张焕鑫). Composition and fuel characters of gasoline-like fraction in the pyrolysis oil of sludge [J].(染料化学学报), 2011, 39 (3): 194-197
[9] Anjali J, Fulekar M H. Biodegradation of phenanthrene using adapted microbial consortium isolated from petrochemical contaminated environment [J]., 2011, 187: 333-340
[10] Haritash A K, Kaushik C P. Biodegradation aspects of polycyclic aromatic hydrocarbons (PAHs): a review [J]., 2009, 169: 1-15
[11] Muckian L M, Grant R J, Clipson N J W, Doyle E M. Bacterial community dynamics during bioremediation of phenanthrene- and fluoranthene-amended soil [J]., 2009, 63: 52-56
[12] Shao Z Z, Cui Z S, Dong C M, Lai Q L, Chen L. Analysis of a PAH-degrading bacterial population in subsurface sediments on the Mid-Atlantic Ridge [J]., 2010, 157: 724-730
[13] Zhang Z Z, Gai L X, Hou Z W, Yang C Y, Ma C Q, Wang Z G, Sun B P, He X F, Xu H Z. Characterization and biotechnological potential of petroleum-degrading bacteria isolated from oil-contaminated soils [J]., 2010, 101: 8452-8456
[14] Gao P K, Li G Q, Dai X C, Dai L B, Wang H B, Zhao L X, Chen Y H, Ma T. Nutrients and oxygen alter reservoir biochemical characters and enhance oil recovery during biostimulation [J]., 2013, 55: 987-993
[15] Jacques R J S, Okeke B C, Fatima M B, Aline S T, Maria C R P, Flavio A O C. Microbial consortium bioaugmentation of a polycyclic aromatic hydrocarbons contaminated soil [J]., 2008, 99: 2637-2643
[16] Tony H, Sanro T, Kazutaka I. Biodegradation of chrysene, an aromatic hydrocarbon bysp. S133 in liquid medium [J]., 2009, 164: 911-917
[17] Lin Y, Cai L X. PAH-degrading microbial consortium and its pyrene-degrading plasmids from mangrove sediment samples in Huian, China [J]., 2008, 57: 703-706
[18] Young M K, Chi K A, Seung H W, Gyoo Y J, Jong M P. Synergic degradation of phenanthrene by consortia of newly isolated bacterial strains [J]., 2009, 144: 293-298
[19] Chen Yuxiang (陈玉祥), Chen Jun (陈军), Pan Chengsong (潘成松), Li Gang (李刚),Xiao Xiqing (肖喜庆),. Influence of asphaltenes and resins on the stability of heavy crude emulsions [J].(应用化工), 2009, 38 (2): 194-200
[20] Li Xiaobin (李晓斌), Sun Yujiao (孙寓姣), Wang Hongqi (王红旗), Ding Aizhong (丁爱中). Analysis of PAH-degrading bacteria from contaminated soil at a coking plant [J].(化工学报), 2010, 61(2): 477-483
[21] Zhao Lingxia (赵玲侠), Gao Peike (高配科), Cao Meina (曹美娜), Gao Mengli (高梦黎), Li Guoqiang (李国强), Zhu Xudong (朱旭东), Ma Ting (马挺). Research on population structure and distribution characteristic of indigenous microorganism in post-polymer-flooding oil reservoir [J].(环境科学), 2012, 33(2): 289-296
[22] Yan Aimin (阎爱民), Chen Wenxin (陈文新). DNA-DNA hybridization analysis of three new rhizobia groups [J].(中国农业大学学报), 2000, 5(1): 14-20
[23] Richert K, Brambilla E, Stackebrandt E. The phylogenetic significance of peptidoglycan types: molecular analysis of the generaandbased upon sequence comparison of,,andand 16S rRNA genes [J]., 2007, 30: 102-108
[24] Qi Yibin (齐义彬), Cao Meina (曹美娜), Huang Lixin (黄立信), Yu Li (俞理), Xiu Jianlong (修建龙). Mechanism of crude oil viscosity reduction and degradation by thermophilic hydrocarbon-degrading bacteria combination [J].(科学技术与工程), 2014, 14(24): 18-22
[25] Guo Chuling, Guo C L, Zhou H W, Wong Y S, Tam N F Y. Biodegradation ability and dioxgenase genes of PAH-degradingandstrains isolated from mangrove sediments [J]., 2010, 64: 419-426
[26] Qi Yibin (齐义彬), Wang Dawei (王大威), Wu Mengmeng (吴萌萌), Lü Xin (吕鑫), Li Guoqiang (李国强), Ma Ting (马挺). Effect of resins degradation and biological emulsification in decreasing heavy oil viscosity [J].(石油学报), 2012, 33(4): 670-675
[27] Gao Peike (高配科), Wang Yansen (王燕森), Zhang Hongzuo (张宏祚), Pan Xiaoxuan (潘晓轩), Li Guoqiang (李国强), Ma Ting (马挺). Mechanism of crude oil viscosity reduction by two thermophilic hydrocarbon-degrading bacteria [J].(化工学报), 2013, 64 (11): 4240-4245
[28] Moh M H, Cheman Y B, Voort F R, Abdullah W J W. Determination of peroxide value in thermally oxidized crude palm oil by near infrared spectroscopy [J]., 1999, 76: 19-23
[29] SY/T 5119—2008[R]
[30] SY/T 5779—2008[R]
[31] Zhu C J, Sun G P, Chen X J, Guo J, Xu M Y.sp. nov., an endospore-forming bacterium with a filament-to-rod cell cycle [J]., 2014, 64: 3644-3649
[32] Chen B L, Wang Y S, Hu D F. Biosorption and biodegradation of polycyclic aromatic hydrocarbons in aqueous solutions by a consortium of white-rot fungi [J]., 2010, 179: 845-851
[33] Jain P S, Bari S B, Surana S J. Isolation of stigmasterol and γ-sitosterol from petroleum ether extract of woody stem of abelmischus manihot [J]., 2009: 1767-1773
[34] Gao Xin (高鑫), Cai Tingting (蔡婷婷), Zhu Lijun (朱丽君), Zhou Yulu (周玉露), Xiang Yuzhi (项玉芝), Xia Daohong (夏道宏). Content distribution and existing form of Fe in crude and residual oil [J].:(石油学报:石油加工), 2014, 30 (2): 256-261
[35] Zhao Heping, Wu Q S, Wang L, Zhao X T, Gao H W. Degradation of phenanthrene by bacterial strain isolated from soil in oil refinery fields in Shanghai, China [J]., 2009, 164: 863-869
[36] Toledo F L, Calvo C, Rodelas B J. Selection and identification of bacteria isolated from waste crude oil with polycyclic aromatic hydrocarbons removal capacities[J]., 2006, 29: 244-252
[37] Juhasz A L, Ravendra N. Bioremediation of high molecular weight polycyclic aromatic hydrocarbons: a review of the microbial degradation of benzo[a]pyrene [J]., 2000, 45: 57-88
[38] She Y H, Shu F C, Zhang F, Wang Z L, Kong S Q, Yu L J. The enhancement of heavy crude oil recovery using bacteria degrading polycyclic aromatic hydrocarbons//2010 First International Conference on Cellular, Molecular Biology, Biophysics and Bioengineering (CMBB)[C].2010
A PAH-degrading strain JI 2and its biodegradation potential ability
QI Yibin1,LI Hong2,CAO Meina3,CUI Qingfeng4,YU Li4,DONG Hanping4
(Institute of Porous Flow & Fluid MechanicsCNPC & Chinese Academy of SciencesLangfangHebeiChina;Research Institute of Detection Experimental of Xinjiang OilfieldKaramayXinjiangChina;School of Life SciencesNankai UniversityTianjinChina;Langfang BranchResearch Institute of Petroleum Exploration and DevelopmentLangfangHebeiChina
A PAH-degrading strain JI 2 was isolated from oilfield produced water in Mao 8 block of Zhongyuan Oilfield. According to analysis of morphological observation, physiological and biochemical test, 16S rRNA gene, house-keeping genes and DNA-DNAhybridization, JI 2 was considered to represent a novel species of the genus. The strain could not only grow in inorganicsalt culture medium and utilize naphthalene and pyrene as the sole carbon source, but also degrade mixed naphthalene, phenanthrene,anthracene and pyrene. The four PAHs degradationrates could reach61.4%, 86.6%, 69.9% and 18.6%, respectively after 7 d. The viscosity of crude oil treated with JI 2 decreased by 29.3% and degradation rate was 134 mg·d-1. Fourier transform infrared spectra, group composition and GC-MS analysis of the crude oil treated with JI 2 showed that the strain tended to utilizePAHs in aromatic hydrocarbons andresins in crude oil.The relative contents of naphthalene series, phenanthrenseries, thiophene series, fluorene series and chrysene series, C21-triaromatic steroid, pyrene, and benz(a)pyrene decreased after degradation. JI 2 had the capacity to remediatewaterandsoil environment contaminated by PAHs and oil, and provided a feasibleway for bioremediation ofPAHs and oil pollution.
crude oil;polycyclic aromatic hydrocarbons;;degradation
2014-09-10.
YU Li, yuli69@petrochina.com.cn
10.11949/j.issn.0438-1157.20141365
Q 939.97;Q 938.1
A
0438—1157(2015)03—1072—08
国家高技术研究发展计划项目(2013AA064402)。
2014-09-10收到初稿,2014-11-21收到修改稿。
联系人:俞理。第一作者:齐义彬(1985—),男,博士研究生。
supported by the National High Technology Research and Development Program of China (2013AA064402).
