金属氧化物与微生物相互作用及其在能源环境领域的应用
2015-10-15李超超方星亮陈杰羊家威成少安
李超超,方星亮,陈杰,羊家威,成少安
金属氧化物与微生物相互作用及其在能源环境领域的应用
李超超,方星亮,陈杰,羊家威,成少安
(浙江大学能源清洁利用国家重点实验室,浙江杭州 310027)
近年来,随着太阳能被引入微生物燃料电池领域,微生物电化学-光电化学协同产电、产燃料或净化环境的技术成为研究热点。太阳能转化的常用媒介是金属氧化物,探究其与微生物间的相互作用对认清协同机理、提高体系效率等方面有重大意义。综述了不同类型的金属氧化物-微生物相互作用的研究工作,包括微生物-金属氧化物间物理吸附作用、微生物对金属氧化物的矿化和风化作用、微生物-金属氧化物协同产电产燃料系统、金属氧化物光催化杀菌以及光电-微生物电化学协同治理有机污染物或重金属污染,提出了更高效的微生物电化学-光电化学体系的构建方法,为微生物-光催化材料协同体系的实际应用提供帮助。
金属氧化物;微生物;催化作用;金属氧化物与微生物相互作用;生物燃料;纳米材料
引 言
随着光电化学-微生物电化学体系的发展,金属氧化物和微生物在能源与环境领域中的相互作用越来越受到人们的重视。金属氧化物与微生物的相互作用可归类为物理作用和化学作用。在物理作用方面,主要研究了两者间的初始吸附过程,以及吸附过程对两者的影响。化学作用方面,主要包括微生物风化作用、微生物矿化作用、光催化杀菌作用以及微生物-半导体金属氧化物协同下的光电化学-微生物电化学作用,部分涉及产电、燃料制备或污染治理的内容将是未来重点研究方向。光照对金属氧化物-微生物相互作用可能造成的影响也是本文的关注重点。
微生物和金属氧化物间的物理吸附是两者相互作用的基础[1]。其吸附过程主要包含细胞向固相表面迁移、初始吸附、进一步紧密结合以及微生物在矿物表面定殖并形成微菌落或生物膜4个步骤[2]。初始吸附是微生物与金属氧化物物理相互作用的关键步骤。
许多微生物在生命代谢过程中能够溶解、转化或合成金属氧化物,微生物通过这种作用补充生命活动所必需的矿物质,同时利用氧化还原过程中释放的能量[3]。在非光驱动条件下,微生物对金属氧化物的化学作用主要包含风化作用和矿化作用。微生物对矿物既可直接形成机械破坏或溶蚀也可通过代谢酸产物、胞外聚合物、生物膜、酶、氧化还原作用等途径间接溶解或转化金属氧化物,实现生物化学风化[4]。矿化作用是微生物在其特定部位,在一定的物理化学条件下,通过自身有机物质的调控和诱导,与金属离子相互作用形成金属氧化物,矿化作用是微生物自身生长的载体和能量、营养的来源[5]。光照对微生物风化作用和微生物矿化作用均有一定影响。
在光照条件下,金属氧化物半导体通常发生光催化作用杀死微生物。但Lu等[6]研究发现:部分化能自养型微生物能接收光催化反应产生的光电子还原金属氧化物,从而获得能量实现自身生长。这一研究成果揭示了在太阳能-化学能-生物能之间存在能量的传递链,表明在自然界中金属氧化物与微生物存在协同作用[7]。这种微生物催化与半导体矿物光催化协同体系,可以实现对土壤有机污染物的氧化降解,实现土壤的自净化[8],或者实现更高效的产电和燃料制备。本文对微生物与金属氧化物之间的物理吸附、风化、矿化作用以及制约和协同作用的机理和应用进行综述。
1 微生物-金属氧化物物理吸附作用
微生物与金属氧化物的相互作用始于两者间的初始吸附,这种初始吸附取决于范德华力、静电力、疏水相互作用、空间位阻效应及氢键等多种作用力的共同作用,与矿物表面性质及环境条件也有一定关系。微生物初始吸附理论主要有表面自由能热力学理论、德亚盖因-兰多-弗伟-奥弗比克理论(DLVO theory)和表面复合物理论等[9]。
1.1 表面自由能热力学理论
热力学理论假定相互作用实体的表面发生物理接触,吸附过程是可逆的,并达到热力学平衡,当微生物与固相表面发生吸附反应时,界面自由能趋于最小。基于表面自由能理论,若忽略空间位阻的影响,则微生物-金属氧化物作用界面的吸附总自由能可视为由金属氧化物-微生物界面的表面张力、微生物-液相界面的表面张力和金属氧化物-液相界面的表面张力的共同作用实现[10]。
Chen等[11]研究发现,轻链球菌和干酪乳杆菌与石英砂(SiO2)间均可发生吸附反应,当用铁氧化物(FeO)覆盖石英砂表面,其界面吸附自由能更加偏离零值。在表面自由能理论模型指导下,利用铁氧化物覆盖石英砂,测得菌种和石英砂间的吸附反应更容易发生。
1.2 DLVO理论
DLVO理论是一种关于胶体稳定性的理论,该理论认为溶胶在一定条件下能否稳定存在取决于胶粒之间相互作用的位能,而总位能等于范德华吸引位能和双电层引起的静电排斥位能之和。两种位能对应的作用力为范德华力和静电相互作用力,对胶体的稳定性起决定作用。
将DLVO理论引入微生物吸附问题时,认为微生物细胞游离于土壤溶液并形成菌胶体悬液,此时微生物与金属氧化物表面间的吸附行为与空间位阻无关,符合胶体动力学规律,总吸附作用是两者间范德华力和静电力作用平衡的结果[12]。Lyklema 等[13]认为只有当界面间距超过1 nm时,DLVO理论才适用。通常,范德华力由哈梅克常数决定。材料不同,哈梅克常数改变,吸附界面的总Gibbs自由能随界面间距的变化趋势存在3种可能情况[13](图1)。而静电排斥力随溶液离子强度增强而减小,当溶液中离子强度增加,吸附界面的Gibbs自由能随界面间距的变化趋势逐渐由曲线1向曲线3转变[14]。

图1 DLVO理论下微生物与金属氧化物吸附界面Gibbs自由能随界面间距变化趋势
DLVO理论只考虑静电作用和范德华力的影响,应用存在一定的缺陷。后来,引入了空间斥力位能、水化相互作用排斥位能、疏水相互作用吸引能和磁吸引势能等对DLVO进行了修正,形成了扩展的DLVO理论[15]。
Shashikala等[16]利用扩展DLVO理论研究了多粘芽孢杆菌在赤铁矿和石英表面的吸附差异性,并确定多粘芽孢杆菌吸附于赤铁矿表面的最佳pH为2~8。Farahat等[17]利用扩展DLVO模型对大肠杆菌在石英、刚玉和赤铁矿表面的附着情况进行了建模和实验研究,指出在酸性环境下,理论总相互作用位能为负,有利于微生物在金属氧化物表面的吸附,并设计实验证实了这一观点。
1.3 表面复合物理论
化学平衡表面复合物模型认为:由于细菌表面含有羟基、羧基、磷酸基等基团,矿物表面也含有羟基等基团,这些基团在一定条件下,可以解离出H+,发生特异性结合,形成表面复合物。若这种结合可逆,根据解离平衡常数和不同实验条件下细菌的吸附量等参数,可以拟合出细菌与矿物间吸附的最佳反应模型,以此对吸附反应进行预测和模拟。Upritchard等[18]通过全反射红外光谱分析确认大肠杆菌能分泌一种苯酚铁载体肠菌素,这种肠菌素能在二氧化钛、勃姆石(AlOOH)和铬的氧化物-氢氧化物表面形成共价键并实现附着。在表面复合物理论指导下,通过对微生物分泌物和金属氧化物形成表面复合物反应的规律的探寻,有望形成针对性的微生物-金属氧化物表面附着方法。肠菌素和TiO2间的结合见图2。

图2 大肠杆菌分泌肠菌素与TiO2以共价键形成吸附[18]
1.4 物理吸附过程的影响因素
金属氧化物对细胞和生物分子的吸附,受矿物和细胞的结构、表面性质(如表面疏水性、表面电位等)和环境条件的影响,而表面性质又依赖于环境条件如溶液pH、离子强度等。Jr等[19]发现细菌的鞭毛在细菌在矿物上的吸附过程中也起重要作用,如鞭毛蛋白能显著促进海藻西瓦氏菌在无定形氧化铁、针铁矿及赤铁矿表面的吸附。Ams等[20]比较了枯草杆菌和门多萨假单胞菌在铁氧化物表面的吸附情况,发现呈现革兰阳性的枯草杆菌的吸附量大于革兰阴性的门多萨假单胞菌,表明细胞壁结构差异对细菌在矿物表面的吸附也产生影响。
1.5 应用
探究金属氧化物和微生物间的物理作用,是研究微生物在金属氧化物表面吸附作用的前提。Babin等[21]发现在土壤中加入铁、铝等的氧化物和氢氧化物,微生物群落结构得到极大增强。其原因是由于高比表面积的金属氧化物为细菌提供了大量吸附位点。该发现侧面验证了使用金属氧化物作为微生物燃料电池电极材料的可行性。
同时,利用金属氧化物与微生物间的附着与导电特性,可以改进微生物电化学体系的性能。目前相关研究多集中于微生物电极的金属氧化物修饰。这种金属氧化物的修饰可促进微生物在电极表面的黏附、生长,从而提高微生物电化学体系的产电性能。在微生物电化学体系中,阳极材料是产电菌的载体,不仅影响底物的降解过程,也影响电子由微生物传递到电极的过程,对系统的产电能力至关重要。殷瑶[22]通过溶胶凝胶法制备了具有萤石结构的纳米CeO2颗粒,并运用溶胶浸渍法对电极材料进行二氧化铈掺杂修饰。研究发现:纳米二氧化铈不仅能够促进细胞色素C的直接电子传递过程,而且能提高细胞色素C电化学反应的可逆性并降低阳极的活化过电位,从而有效减小阳极电荷转移内阻,阳极性能得到显著提高。另外,利用铁、锰的氧化物修饰生物阴极燃料电池的阴极载体材料,也有助于提高燃料电池的产电性能。Rhoads等[23]利用Mn(Ⅳ)和Mn(Ⅱ)氧化还原转化过程构建具有空气生物阴极的MFC,研究发现MnO2首先从阴极得到电子还原为MnOOH,随后MnOOH再得到一个电子还原为Mn(Ⅱ),锰氧化细菌(MOB)将Mn(Ⅱ)的两个电子传递给氧,并实现MnO2的再生。Shantaram等[24]利用Mn(Ⅱ)参与空气-生物阴极的反应,MFC最高电压达到2.1 V,可为无线传感器提供电能。Clauwaert等[25]用电沉积法制备了锰氧化物修饰的石墨毡作为生物阴极,构建的管式MFC能有效缩短启动时间约30%,最大功率密度为40~132 mW·m-2。在分析阴极对阳极电势影响的研究中也发现,分别以醋酸盐、甘油、氨基酸等为底物,锰修饰后生物阴极的产电性能均优于铁氰化钾阴极,证明锰氧化物是较理想的生物阴极修饰材料[26]。同时,在铁锰联合修饰生物阴极中,发现铁离子对锰离子的生物氧化过程具有催化或者促进作用[25]。唐致远等[27]研究发现,以化学掺杂Fe3+的MnO2作为电极材料,提高了MnO2电极的放电性和循环性。
2 微生物风化金属氧化物
微生物风化是微生物通过机械和化学作用来溶解岩石或矿床,溶出的离子被微生物吸收供自身生长,其示意图见图3[28]。生物风化(bioweathering)可用于生物采矿(biomineralization),即利用微生物从矿石或精矿中提取和凝练贵金属和其他金属[29]。
真菌对矿物的浸出作用机理主要包括酸解、络合作用、还原作用和生物富集作用。人们对黑曲霉在低品位金属氧化物矿石的滤出与开采方面的应用进行了广泛研究,发现黑曲霉能产生柠檬酸、草酸等多种有机酸,协助溶解金属氧化物[30]。Mulligan等[31]证实黑曲霉能在低品位氧化物矿中浸出铜、锌、镍、铁等离子。Marcin等[32]发现褐伞残孔菌能够分泌草酸分解铜、铝、锌、镉及锰等的氧化物。而苏格兰白僵菌()、简青霉菌()以及红根须腹菌()能溶解UO3和U3O8等铀氧化物,石楠柔膜菌()和龙介虫担子菌()可以溶解利用U3O8[33]。
Ward等[34]在光暗间歇供应(16 h光照/8 h黑暗)的条件下,将蓝藻置于黑云母(含氧化硅、氧化镁、氧化铝等成分)上进行培养,发现该模式下蓝藻对黑云母的生物风化作用有所加强。这与光照促进光合细菌的生长繁殖有关。光照是否能促进酸性分泌物的生成和释放还有待研究。
3 微生物矿化金属氧化物
无机元素通过微生物的作用从环境中选择性地沉积在特定有机质上形成矿物而矿化。微生物矿化可分为微生物诱导矿化和微生物控制矿化,其示意图见图4[35]。

图4 微生物矿化形成金属氧化物示意图
3.1 微生物诱导矿化金属氧化物
微生物诱导矿化由微生物的生理活动引起周围环境的物理化学条件改变所致,矿物晶体通常成型于细胞外,无特定取向和特定形态。
Banfield等[36]发现铁氧化细菌能经诱导形成生物矿物羟基氧化铁(FeOOH)。细菌细胞表面的细丝状聚合物作为空间定位模板,诱导四方纤铁矿(β2-FeOOH)围绕其沉积,形成矿化细丝。海藻胶质是调控FeOOH形成的关键因素[37]。
3.2 微生物控制矿化金属氧化物
微生物控制矿化是由生物的生理活动引起,并在空间、构造和化学3方面受生物控制的矿化过程。与诱导矿化不同,该过程发生在细胞内部(如脂质泡囊内),所成矿物具有特定结构形态。
矿化产物种类繁多,其中的金属氧化物产物主要为铁、锰、铝、钛等的氧化物及氢氧化物。趋磁细菌是“生物控制矿化”的典型生物[38],能从环境中吸收Fe2+或Fe3+,并由铁蛋白加工生成磁铁矿[39]。铁细菌酶化作用生成针铁矿、赤铁矿等铁氧化物的机理已被Mamet等[40]证实,其矿化机制包括胞外聚合物上的二价铁矿物沉淀和胞内碳酸盐微晶和针铁矿的矿化成型。枯草芽孢杆菌、乳杆菌菌株和黄曲霉能在胞内矿化合成TiO2[41-43]。Hansel等[44]发现一种常见的子囊丝状菌()在细胞分化过程中能分泌胞外过氧化物,将Mn(II)氧化形成锰氧化物。该现象在菱锰矿中也有发现[45]。Santelli等[46]探究了4种不同的二价锰氧化子囊菌,食线虫真菌菌株DS2psM2a2,棘壳孢菌属菌种DS3sAY3a,壳多胞菌属菌种SRC1lsM3a以及笔直顶孢霉 菌菌株DS1bioAY4a(strainDS2psM2a2,sp.DS3sAY3a,sp. SRC1lsM3a,strain DS1bioAY4a)的矿化机理,发现不同菌属的成矿部位有差异,菌种的选择对锰氧化物的大小、形态和结构有影响。
3.3 光照下的微生物矿化金属氧化物
光照能对微生物的矿化作用起到促进作用,提升矿化的效率、速率或品质。
Hilton等[47]利用铁细菌矿化原理,通过使用铁蛋白作为光催化剂,在光照下催化还原金(Ⅲ)生产金(0)纳米粒子。事实证明,光照有利于减小金(0)纳米粒子的粒径:非光照条件下生成的纳米颗粒粒径为15~30 nm,而光照条件下生产的纳米颗粒粒径为5~10 nm。这是因为光能激发了铁蛋白中铁离子中电子的高能化,提升了铁蛋白的还原性。这预示着光激发对铁蛋白矿化合成铁/锰氧化物也应具有一定促进作用。
Peng等[48]发现,温泉中存在的蓝藻等部分光合细菌具有矿化合成氧化硅及铁、铝的氧化物/碳酸盐的能力。光照对光合细菌矿化合成金属氧化物具有催化作用,这主要是因为光照促进了光合细菌的生长繁殖和光合作用,有利于矿化作用的进行。
4 金属氧化物光催化杀菌
金属氧化物如TiO2、ZnO、Ag2O、Fe2O3、Cu2O、In2O3、WO3、PbO、V2O5、SnO2、Bi2O3、Nb2O3、FeTiO3、Fe2TiO3、SrTiO3、BaTiO3、CaTiO3、KTaO3等具有光催化性能。在光的照射下,这些金属氧化物材料将光能转化为化学能,并促进有机物的合成与分解。光催化原理为:半导体粒子受到大于禁带宽度能量的光子照射后,电子从价带跃迁到导带,产生了电子-空穴对。在溶液环境中,电子与空穴会在电场作用下分离并迁移到粒子表面。空穴具有强氧化性,夺取吸附在半导体表面上的有机物或溶剂中的电子;电子受体被半导体表面上的电子还原。光生电子和空穴能与水及氧反应生成具有强氧化能力的、或等自由基,这些自由基能破坏微生物如大肠杆菌结构中的脂质和蛋白质[49],达到抗菌、消毒、脱臭的作用。
4.1 金属氧化物光催化杀菌机理
金属氧化物光催化杀菌有直接作用和间接作用两种机理。直接作用机理认为光生电子和空穴直接与细胞的组成成分反应,导致细菌功能单元失活而令细胞死亡。如光激发TiO2产生的空穴直接与大肠杆菌的辅酶A作用形成二聚体,导致辅酶A失活。间接作用机理认为光生电子或空穴与水或水中的溶解氧反应形成高活性的氢氧自由基(·OH)和过氧化氢自由基(HO2·)等,这些自由基破坏有机物中的CC、CH、CN、CO、NH等键,降解有机物,分解微生物细胞及其组分中生物大分子[50],破坏细胞结构[51]。另外, 光催化剂对细胞表面直接和间接的破坏都会导致细胞膜通透性的增加,使纳米颗粒进入细胞内部并累积,破坏胞内生命活动,也能导致微生物死亡[52]。
4.2 金属氧化物光催化杀菌应用
金属氧化物光催化剂因具有稳定性好、光催化活性强、对人体无害等优点,目前在食品包装消毒[53]、鞋类杀菌除臭[54]等得到广泛应用。
研究表明,TiO2光催化剂在紫外线的照射下,能够将水中的酵母菌、大肠杆菌、乳酸杆菌和葡萄球菌等病原微生物杀死[55]。可见光照射下,纳米Cu2O对M13噬菌体、大肠杆菌()、克雷伯氏肺炎菌()、金黄葡萄球菌()、粘质沙雷氏菌()分别具有89.54%、84.10%、94.20%、89.82%、100%的灭活率。Cu2O-TiO2纳米复合材料在光照下对铜绿微囊藻()、阿氏项圈藻()、薄肌眼虫藻()、莱茵衣藻()有显著杀灭作用,对舟型螺旋藻()的生长有明显的抑制作用[56]。而纳米ZnO颗粒对大肠杆菌和金黄色葡萄球菌杀灭效果明显[57],也能有效杀死枯草芽孢黑色变种[58]。Baek等[59]也发现NiO、Sb2O3及ZnO的纳米颗粒对大肠杆菌、枯草芽孢杆菌和金黄葡萄球菌具有杀灭效果。
4.3 金属氧化物光催化杀菌性能的影响因素
影响金属氧化物光催化杀菌的因素多且复杂。赵艳凝等[60]发现光照条件(包括光强、光谱范围等)对光催化杀菌效果有很大影响。Suresh等[61]发现环境条件(如MnO能抑制ZnO、TiO2等的光催化杀菌作用)、光催化材料形态和尺寸、光催化剂表面修饰程度以及材料颗粒的阵列方式等对杀菌效果有显著影响。热处理温度和pH等也是重要的影响因 素[62]。此外,金属氧化物的结构和表面积也影响光催化活性和杀菌效果[63]。Simon-Deckers等[64]的研究发现:纳米金属氧化物的生物毒性取决于其化学成分、表面电荷和颗粒形貌,与晶型无关。Tong等[65]研究了不同尺寸和形貌的TiO2颗粒对大肠杆菌和嗜水气单胞菌的光催化毒性,发现纳米管和纳米片的TiO2毒性弱于纳米棒和纳米颗粒的TiO2。当TiO2颗粒为长形时,其光杀菌性能强于短形和球形颗粒[66]。除此以外,金属氧化物的种类也影响光杀菌性能[67],如ZnO纳米颗粒的光杀菌性能强于TiO2。
5 微生物-金属氧化物协同作用
自然界中微生物的代谢形式主要有光合自养型、化能自养型和异养型。在富含锰、铁氧化物等光半导体的土壤中,光半导体和非光能自养型微生物存在协同作用[6]。在光照下,当瞬间光能强过导带与价带间的带隙时,金属氧化物光半导体形成光生电子-空穴对,发生光催化反应,产生的光电子被某些非光合自养型微生物吸收,微生物还原环境中的Fe3+,产生的能量供给微生物自身生长,同时,吸附在金属氧化物表面的菌体或代谢产物也会改变矿物表面的氧化还原电位。研究表明[6]微生物的生长与光子能量和光子数量密切相关,微生物生长与矿物的吸收光谱相吻合。化能自养型嗜酸氧化亚铁硫杆菌()以及异养型粪产碱杆菌()能利用金红石(TiO2)和针铁矿[α-FeO(OH)]受光激发的光生电子并促进自身生长繁殖,其生长繁殖速率与光照强度、光谱范围有关。光生电子促进嗜酸氧化亚铁硫杆菌的生长还受到周围环境中Fe2+浓度(还原作用产生)的影响[68]。天然半导体褐铁矿的光催化作用也能有效促进化能自养微生物嗜酸氧化亚铁硫杆菌的生长。此外,光催化反应还导致土壤生物群落结构的变化[69]。光能-生物能之间的转化效率为0.013%~0.190%。
基于金属氧化物半导体光催化促进微生物生长的认识,鲁安怀等[70]提出了一种全新的地表半导体矿物光催化-微生物耦合作用的环境效应,将地球早期生命活动的可能途径描述为:在早期地球还原性环境中,光生空穴极有可能被周围还原性物质所捕获,高能量的光电子则易于被早期生命细胞所利用。这种天然半导体矿物光催化作用在早期生命起源过程中扮演着保护及提供能量的重要作用,并且这一作用机制至今仍在地球表层系统中发挥着重要的作用。
微生物可通过生物催化作用降解有机污染物;而具有可见光催化性能的天然半导体矿物也可用于处理有机/无机污染物[71]。将微生物催化与半导体矿物光催化耦合可显著提高有机污染物的降解效率。丁竑瑞等[72]将具有可见光催化活性的天然氧化物半导体矿物金红石与厌氧微生物菌群耦合构建微生物-金红石电化学体系,研究甲基橙降解发现:甲基橙在光照下的降解率为73.4%,无光条件下的降解率为47.4%,而体系断路时降解率仅为18.0%。
金属氧化物光触媒与微生物的交互作用也应用于对海洋微生物燃料电池的改进。Motoda等[73]采用TiO2修饰海洋微生物燃料电池的不锈钢阳极表面,发现当阳极暴露在紫外线下,电池电流比未包覆的提高了2倍,并且避免了金属的腐蚀。随后,Uematsu等[74]研究了二氧化钛纯度对上述体系的性能影响,发现当采用纯度95.2%的TiO2包覆海洋生物燃料电池的阳极时,阳极发生局部腐蚀,使光催化效应降低。
同时,光电池-微生物燃料电池耦合系统用于可持续产氢或有机污染物高效降解也有报道[75-76]。Qian等[77]将生物膜包覆的赤铁矿纳米线电极作为阳极,首次构建了光催化剂与微生物直接接触的微生物燃料电池,并利用光照提升了输出电流,显示了光触媒和微生物的直接协同作用,利用太阳能和回收的生物能,同时实现废水治理、发电和燃料生产。在微生物燃料电池基础上,构建了酸矿污水燃料电池(AMD-FC)系统。该系统能通过微生物催化作用,治理酸性污水并发电,同时将污水中的Fe2+氧化成纳米球形颗粒的铁氧化物进行回收[78]。
6 总结和展望
在能源与环境领域,以半导体金属氧化物为媒介,将太阳能的转化利用引入到微生物燃料电池体系的过程中,涉及的微生物和金属氧化物相互作用种类繁多。
微生物对金属氧化物产生矿化作用和风化作用,并对光照有一定响应。微生物对金属氧化物的风化效果主要取决于水分、温度、pH等环境因素,微生物矿化作用除了环境因素影响外,还受到环境中相关离子浓度的制约。微生物对金属氧化物的风化作用及矿化作用都具有高选择性、受环境影响小和便于控制等特点。目前,微生物矿化金属氧化物的研究大多集中将微生物矿化与金属氧化物材料制备相结合,利用微生物低成本和可控性的特点生产高纯度的、特定结构的和具有高价值的金属氧化物材料。微生物风化作用的影响因素包括土壤pH、矿物富集程度、土壤营养物质等,目前利用黑曲霉等真菌从低品位矿物中提取金属获得较广泛应用。
某些金属氧化物能够促进微生物的附着和生长。利用金属氧化物修饰MFC或MEC电极,有助于提升系统产电、产燃料性能。金属氧化物包含部分半导体材料和光半导体材料能与某些非光合细菌协同作用,在光照下光电子能促进化能自养型微生物生长繁殖。光催化反应与微生物电化学反应相结合有助于二氧化碳还原成有机物,这为大气碳捕集提供了新途径。因此,金属氧化物光电极与微生物电极耦合形成光电化学-微生物电化学协同体系,可以实现微生物-金属氧化物相互促进下的产电、制备生物质燃料、有机污染物脱除或重金属还原等功能。协同体系的形式主要包括光电池-MFC耦合、光电极-微生物电极耦合以及光催化剂和微生物在同一电极上的协同(表1)。
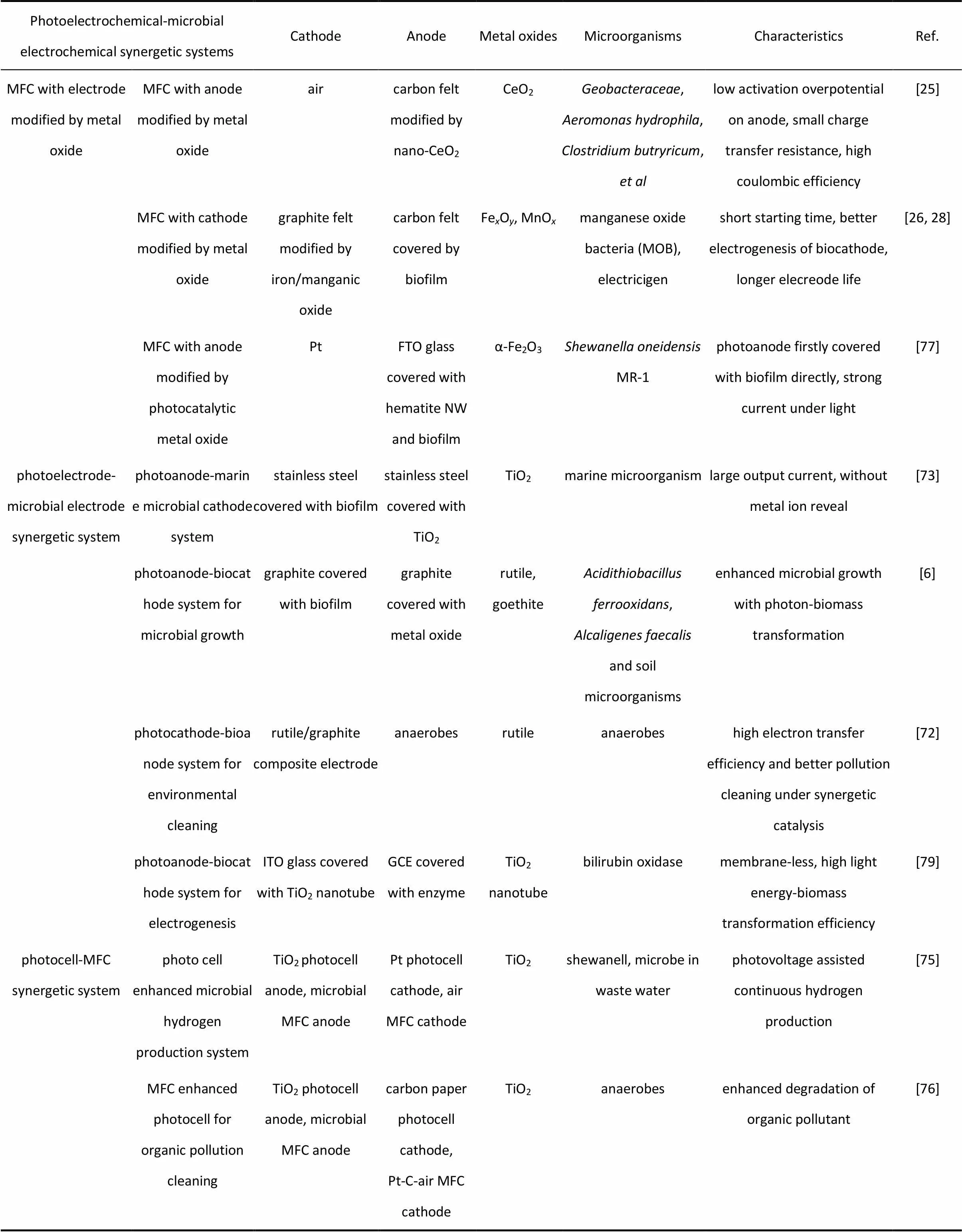
表1 光电化学-微生物电化学协同体系汇总
目前,关于太阳能-生物质能协同转化过程中的微生物和金属氧化物之间的协同作用研究还处于初期阶段。所涉及的金属氧化物主要局限于金红石、赤铁矿、针铁矿、氧化锰、闪锌矿和磁铁矿,而微生物主要是嗜酸氧化亚铁硫杆菌、大肠杆菌、地杆菌、粪产碱杆菌、异化金属还原菌等[80]。针对其他种类的微生物和其他金属氧化物间的相互作用还是空白。人们对金属氧化物与微生物交互作用影响周边环境的规律的认识也相对缺乏。微生物与金属氧化物之间的相互作用机理尚不明确,需要开展大量的深入系统的研究,包括:①参与吸附的表面基团的认定,细胞与矿物间特异识别机制的研究;②各种作用力对吸附过程的效应;③微生物与金属氧化物互作的热力学信息;④矿物与微生物互作对养分元素的有效利用性以及重金属毒性的影响等。这些研究需要利用原子力显微技术、化学力显微镜、激光共聚焦扫描显微镜(LSCM)、X射线光电子能谱(XPS)、高精度微量热技术(microcalorimetry)和同步加速辐射技术(XAFS)从分子或原子水平上获得表面原子间配位数、配位距离及元素价态、吸附作用的热力学信息等,从而揭示微生物与金属氧化物表面相互作用机理[8]。
在探究微生物与金属氧化物相互作用机理的同时,开发其相互作用的利用技术也是今后重要的研究方向。利用金属氧化物光催化作用在细菌方面的应用研究较多,主要集中于光催化剂的制备和修饰方面,如改变光催化剂表面形貌[81]、表面敏化[82]和表面贵金属沉积[83-84],以促进电子-空穴的分离;选择合适的载体材料、尺寸和表面形貌,从而使催化剂易失活、易凝聚、难回收和光能利用率低等问题得到解决[85-87];对催化剂进行适量的离子掺杂,使其晶格中引入缺陷或改变结晶度,形成光生载流子的捕获陷阱,延长电子和空穴的复合时间,同时将半导体的激发波长延伸到可见光区,强化光催化杀菌能力,主要的掺杂离子有金属如Sn[88]、Pt和Au[89]、Fe[90]、Zn[91]、Co[92]等,非金属如N[93]、C、S[94]、P[95]、F[96]等,以及半导体如Ag2O/TiO2[97]、TiN/TiO2[98]、CdS/TiO2[99]、Ag/SiO2/TiO2等。
微生物风化金属氧化物能够滤出提纯低品质的金属氧化物矿,具有低污染、低成本等特点,但是该技术相关的控制因素,包括土壤成分及温度、湿度等环境因素对滤出效率的影响,以及不同菌种对金属氧化物的选择程度等还需要深入研究。光电化学-微生物电化学协同还原重金属离子系统中,还原出的重金属及相关衍生盐的处理浓度低、成分复杂,难以处理。将微生物风化提纯技术应用到协同系统的后处理中,可以实现废水中重金属的重复回收利用,实现资源的可持续发展。
微生物矿化金属氧化物具有成本低、环境影响小、形态大小可控等优势,可以用于制备具有优异的流动性和运输特性、催化活性、分离效率、黏附特性、存储特性的纳米材料。光电化学-微生物电化学协同系统中,光催化剂的效率主要受到结构和成分两方面的制约。微生物矿化技术能合成多种多样的形态可控的金属氧化物,将其作为协同系统的前置技术,生产出具有特定形态结构的复合光催化剂,可以有效提高系统效率。Begum等[100]受到微生物矿化作用的启发,利用带正电的简单多肽及相关聚胺作为矿化组装的定向结构和还原剂,实现一步直接矿化和组装Ag/AgCl/ZnO纳米复合材料,实现了ZnO光催化剂的红移,复合产品表现出优越的可见光催化性能。Kim等[101]利用溶菌酶的矿化作用合成了高效的钛-钨氧化物复合光催化剂。
金属氧化物促进微生物繁殖或产电菌活性具有重要的研究价值。通常,修饰MFC电极应使用不具备光催化特性的金属氧化物,但也可通过适当的离子掺杂来抑制其光催化性能。利用金属氧化物半导体材料,能够实现光电转化-微生物电化学反应的耦合,并借助于微藻或光合细菌促进微生物固定CO2同时产电或产甲烷[102]。此外,微生物燃料电池产生的电子经导线流向光催化剂表面,有助于降低光电子-空穴对复合率,提高光电池效率。可以预见光电化学-微生物电化学协同作用将成为未来研究的热点。
References
[1] Nannipieri P, Ascher J, Ceccherini M T, Landi L, Pietramellara G, Renella G. Microbial diversity and soil functions [J]., 2003, 54 (4): 655-670
[2] Busscher H J, Norde W, Sharma P K, Prashant K, van der Mei H C. Interfacial re-arrangement in initial microbial adhesion to surfaces [J]., 2010, 15 (6): 510-517
[3] Spormann A. Physiology of microbes in biofilms//Bacterial Biofilms [J]., 2008, 322: 17-36
[4] Li Sha (李莎), Li Fuchun (李富春), Cheng Liangjuan (程良娟). Recent development in bio-weathering research [J].(矿产与地质), 2006, 20 (6): 577-582
[5] Xue Zhonghui (薛中会), Wu Chao (武超), Dai Shuxi (戴树玺), Du Zuliang (杜祖亮).Advances in the study of biomineralization [J].:(河南大学学报:自然科学版), 2003, 22 (4): 21-25
[6] Lu A, Li Y, Jin S, Wang X, Wu X L, Zeng C P, Li Y, Ding H R, Hao R X, Lv M. Growth of non-phototrophic microorganisms using solar energy through mineral photocatalysis [J]., 2012, 3: 768-777
[7] Ding Hongrui (丁竑瑞), Li Yan (李艳), Lu Anhuai (鲁安怀), Quan Chao (权超), Wang Xin (王鑫), Yan Yunhua (颜云花), Zeng Cuiping (曾翠平), Wang Changqiu (王长秋). Experimental researches on photoreduction of azo dyes in the rutile-cathode bioelectrochemical system [J].(岩石矿物学杂志), 2009, 28 (6): 541-546
[8] Lu Anhuai (鲁安怀). Mineralogical photocatalysis in natural self-purification of inorganic minerals [J].(岩石矿物学杂志), 2003, 22 (4): 323-331
[9] Rong Xingmin (荣兴民), Huang Qiaoyun (黄巧云), Chen Wenli (陈雯莉), Liang Wei (梁巍). Interaction mechanisms of soil minerals with microorganisms and their environmental significance [J].(生态学报), 2008, 28 (1): 376-387
[10] Strevett K A, Chen G. Microbial surface thermodynamics and applications [J].,2003, 154 (5): 329-335
[11] Chen G, Zhu H. Bacterial adhesion to silica sand as related to Gibbs energy variations [J].:,2005, 44 (1): 41-48
[12] Liu Xiaomeng (刘晓猛). Interactions and formation mechanisms of microbial aggregates [D]. Hefei: University of Science and Technology of China, 2008
[13] van Loosdrecht M C M, Lyklema J, Norde W, Zehnder A J B. Bacterial adhesion: a physicochemical approach [J]., 1989, 17 (1): 1-15
[14] Hori K, Matsumoto S. Bacterial adhesion: from mechanism to control [J].,2010, 48 (3): 424-434
[15] Chrysikopoulos C V, Syngouna V I. Attachment of bacteriophages MS2 and ΦX174 onto kaolinite and montmorillonite: extended DLVO interactions [J].:,2012, 92: 74-83
[16] Shashikala A R, Raichur A M. Role of interfacial phenomena in determining adsorption ofonto hematite and quartz [J].:,2002, 24 (1): 11-20
[17] Farahat M, Hirajima T, Sasaki K, Doi K. Adhesion ofonto quartz, hematite and corundum: extended DLVO theory and flotation behavior [J].:,2009, 74 (1): 140-14
[18] Upritchard H G, Yang J, Bremer P J, Lamont I L, McQuillan A J. Adsorption of enterobactin to metal oxides and the role of siderophores in bacterial adhesion to metals [J].,2011, 27 (17): 10587-10596
[19] Jr F C, Das A. Adhesion of dissimilatory Fe(Ⅲ)-reducing bacteria to Fe(Ⅲ) minerals [J]..,2002, 19 (2): 161-177
[20] Ams D A, Fein J B, Dong H L, Maurice P A. Experimental measurements of the adsorption ofandonto Fe-oxyhydroxide-coated and uncoated quartz grains [J]..,2004, 21 (8): 511-519
[21] Babin D, Ding G C, Pronk G J, Heister K, Kogel-Knabner I, Smalla K. Metal oxides, clay minerals and charcoal determine the composition of microbial communities in matured artificial soils and their response to phenanthrene [J]., 2013, 86 (1): 3-14
[22] Yin Yao (殷瑶).Basic study on the electricity generation process and performance optimization of two-chamber mediatorless microbial fuel cell [D]. Shanghai: East China University of Science, 2013
[23] Rhoads A, Beyenal H, Lewandowski Z. Microbial fuel cell using anaerobic respiration as an anodic reaction and biomineralized manganese as a cathodic reactant [J].,2005, 39 (12): 4666-4671
[24] Shantaram A, Beyenal H, Raajan R, Veluchamy A, Lewandowski Z. Wireless sensors powered by microbial fuel cells [J]...., 2005, 39 (13): 5037-5042
[25] Clauwaert P, van der Ha D, Boon N, Verbeken K, Verhaege M, Rabaey K, Verstraete W. Open air biocathode enables effective electricity generation with microbial fuel cells [J]...., 2007, 41 (21): 7564-7569
[26] Ren H, Lee H S, Chae J. Miniaturizing microbial fuel cells for potential portable power sources: promises and challenges [J].,2012, 13 (3): 353-381
[27] Tang Zhiyuan (唐致远), Geng Xin (耿新). Preparation of Fe3+doped manganese dioxide for electrode material of supercapacitor [J].(应用化学), 2002, 19 (10): 936-940
[28] Gadd G M. Geomycology: biogeochemical transformations of rocks, minerals, metals and radionuclides by fungi, bioweathering and bioremediation [J].,2007, 111 (1): 43-49
[29] Rawlings D E, Johnson D B. The microbiology of biomining: development and optimization of mineral-oxidizing microbial consortia [J].,2007, 153 (2): 315-324
[30] Wei Z, Hillier S, Gadd G M. Biotransformation of manganese oxides by fungi: solubilization and production of manganese oxalate biominerals [J].,2012, 14 (7): 1744-1753
[31] Mulligan C N, Kamali M. Bioleaching of copper and other metals from low-grade oxidized mining ores by[J]., 2003, 78 (5): 497-503
[32] Marcin G, Anna J W, Bożena P P. Abortiporus biennis tolerance to insoluble metal oxides: oxalate secretion, oxalate oxidase activity, and mycelial morphology [J]., 2009, 22 (3): 401-410
[33] Fomina M, Charnock J, Hillier S, Alvarez R, Gadd G M. Fungal transformations of uranium oxides [J]., 2007, 9 (7): 1696-1710
[34] Ward M B, Kapitulcinova D, Brown A P, Heard P J, Cherns D, Cockell C S, Hallam K R, Ragnarsdottir K V. Investigating the role of microbes in mineral weathering: nanometre-scale characterisation of the cell-mineral interface using FIB and TEM [J]..,2013, 47: 10-17
[35] Wang Ben (王本), Tang Ruikang (唐睿康). Biomineralization: one promising bridge between inorganic chemistry and biomedicine [J].(化学进展), 2013, 25 (4): 633-641
[36] Banfield J F, Welch S A, Zhang H Z, Ebert T T, Penn R L. Aggregation-based crystal growth and microstructure development in natural iron oxyhydroxide biomineralization products [J]., 2000, 289 (5480): 751-754
[37] Chan C S, De Stasio G, Welch S A, Girasole M, Frazer B H, Nesterova M V, Fakra S, Banfield J F. Microbial polysaccharides template assembly of nanocrystal fibers [J].,2004, 303 (5664): 1656-1658
[38] Pan Yongxin (潘永信), Deng Chenglong (邓成龙), Liu Qingsong (刘青松), Zhu Rixiang (朱日祥). Advances in biomineralization and magnetic properties of MTB magnetosomes [J].(科学通报), 2004, 49 (24): 2505-2510
[39] Faivre D, Schüler D. Magnetotactic bacteria and magnetosomes [J].,2008, 108 (11): 4875-4898
[40] Mamet B, Préat A. Iron-bacterial mediation in phanerozoic red limestones: state of the art [J].,2006, 185 (3/4): 147-157
[41] Kirthi A V, Rahuman A A, Rajakumar G, Marimuthu S, Santhoshkumar T, Jayaseelan C, Elange G, Zahir A A, Kamaraj C, Bagavan A. Biosynthesis of titanium dioxide nanoparticles using bacterium[J].,2011, 65 (17): 2745-2747
[42] Jha A K, Prasad K, Kulkarni A. Synthesis of TiO2nanoparticles using microorganisms [J].:,2009, 71 (2): 226-229
[43] Rajakumar G, Rahuman A A, Priyamvada B, Khanna V G, Kumar D K, Sujin P J.leaf aqueous extract mediated synthesis of titanium dioxide nanoparticles [J].,2012, 68: 115-117
[44] Hansel C M, Zeiner C A, Santelli C M, Santelli C M, Webb S M. Mn(Ⅱ) oxidation by an ascomycete fungus is linked to superoxide production during asexual reproduction [J].,2012, 109 (31): 12621-12625
[45] Tang Y, Zeiner C A, Santelli C M, Hansel C M. Fungal oxidative dissolution of the Mn(Ⅱ)-bearing mineral rhodochrosite and the role of metabolites in manganese oxide formation [J]., 2013, 15 (4): 1063-1077
[46] Santelli C M, Webb S M, Dohnalkova A C, Hansel C M. Diversity of Mn oxides produced by Mn(Ⅱ)-oxidizing fungi [J].,2011, 75 (10): 2762-2776
[47] Hilton R J, Keyes J D, Watt R K. Photoreduction of Au(III) to form Au(0) nanoparticles using ferritin as a photocatalyst//Varadan V K. Proceedings of SPIE—The International Society for Optical Engineering [C]. San Diego, America: SPIE, 2010: 1-10
[48] Peng X T, Zhou H Y, Wu Z J, Jiang L, Tang S, Yao H Q, Chen G Q. Biomineralization of phototrophic microbes in silica-enriched hot springs in South China [J]...,2007, 52 (3): 367-379
[49] Carré G, Hamon E, Ennahar S, Estner M, Lett M C, Horvatovich P, Gies J P, Keller V, Keller N, Andre P. TiO2photocatalysis damages lipids and proteins in[J].,2014, 80 (8): 2573-2581
[50] Zhanqi G, Shaogui Y, Na T, Sun C. Microwave assisted rapid and complete degradation of atrazine using TiO2nanotube photocatalyst suspensions [J].,2007, 145 (3): 424-430
[51] Li Juanhong (李娟红) ,Lei Yanying (雷闫盈), Wang Xiaogang (王小刚). Study for photocatalytic sterilizing mechanism and sterilizing capability of semiconductive nanocryslalline TiO2film [J].(材料工程), 2006 (S1): 222-224, 228
[52] Huang Z B, Zheng X, Yan D H, Yin G F, Liao X M, Kang Y Q, Yao Y D, Huang D, Hao B Q. Toxicological effect of ZnO nanoparticles based on bacteria [J].,2008, 24 (8): 4140-4144
[53] Bodaghi H, Mostofi Y, Oromiehie A, Zamani Z, Ghanbarzadeh B, Costa C, Conte A, Del Nobile M A. Evaluation of the photocatalytic antimicrobial effects of a TiO2nanocomposite food packaging film byandtests [J].-.., 2013, 50 (2): 702-706
[54] Rodriguez C, Di Cara A, Renaud F N R, Freney J, Horvais N, Borel R, Puzenat E, Guillard C. Antibacterial effects of photocatalytic textiles for footwear application [J]., 2014, 230: 41-46
[55] Zeng Zhixiong (曾志雄), Xu Yudang (徐玉党). Nanophotocatalytic degradation of purifying air in using nano-TiO2[J].(制冷与空调), 2003 (4): 36-39
[56] Xiong Qin (熊勤). Research of the application of nano-photocatalyst on environment protection [D]. Wuhan: Huazhong Normal University, 2005
[57] Ma Zhengxian (马正先), Han Yuexin (韩跃新), Ma Yundong (马云东), Wang Zehong (王泽红), Yuan Zhitao (袁致涛), Yin Wanzhong (印万忠). Bactericidal potency of nano-ZnO [J].(矿冶), 2005, 13 (4): 57-59
[58] Xu Lixian (胥利先), Sun Jihong (孙继红), Ma Chongfang (马重芳), Meng Sheng (孟声). Research progress of nano modification coating [J].(化工进展), 2005, 24 (4): 341-349
[59] Baek Y W, An Y J. Microbial toxicity of metal oxide nanoparticles (CuO, NiO, ZnO, and Sb2O3) to,, and[J].,2011, 409 (8): 1603-1608
[60] Zhao Yanning (赵艳凝), Teng Honghui (滕洪辉), Chang Limin (常立民), Wen Fuji (文福姬). Studies on the bactericidal performance of indium doped nano-zinc oxide [J].:..(华中师范大学学报:自然科学版), 2008, 42 (3): 400-403
[61] Suresh A K, Pelletier D A, Doktycz M J. Relating nanomaterial properties and microbial toxicity [J].,2013, 5 (2): 463-474
[62] Jiang Lina (姜丽娜). The influences of structures and photocatalytical activity of titanium dioxide by organic and metallic ion doping [D]. Jinan: Shandong Polytechnic University, 2010
[63] Zhang Ping (张萍). Research on synthesis of nano-TiO2photosemiductiorsol as plant antibacterial material and its biological effects [D]. Beijing:Chinese Academy of Agricultural Sciences, 2007
[64] Simon-Deckers A, Loo S, Mayne-Lhermite M, Herlin-Boime N, Herlin-Boime N, Reynaud C, Gouget B, Carriere M. Size-, composition-and shape-dependent toxicological impact of metal oxide nanoparticles and carbon nanotubes toward bacteria [J]., 2009, 43 (21): 8423-8429
[65] Tong T Z, Shereef A, Wu J S, Binh C T T, Kelly J J, Gaillard J F, Gray K A. Effects of material morphology on the phototoxicity of nano-TiO2to bacteria [J]., 2013, 47 (21): 12486-12495
[66] Jr R F H, Wu N, Porter D, Buford M, Wolfarth M, Holian A. Particle length-dependent titanium dioxide nanomaterials toxicity and bioactivity [J]., 2009, 6: 35-45
[67] Adams L K, Lyon D Y, Alvarez P J J. Comparative eco-toxicity of nanoscale TiO2, SiO2, and ZnO water suspensions [J].,2006, 40 (19): 3527-3532
[68] Wang Xin (王鑫), Li Yan (李艳), Lu Anhuai (鲁安怀), Yan Yunhua (颜云花), Zeng Cuiping (曾翠平), Ding Hongrui (丁竑瑞), Wang Changqiu (王长秋). Experimental researches on the pathway of the chemoautotroph microbes utilizing solar energy [J].(岩石矿物学杂志), 2009, 28 (6): 527-534
[69] Zeng Cuiping (曾翠平), Lu Anhuai (鲁安怀), Li Yan (李艳), Wu Jing (吴婧), Wang Xin (王鑫), Ding Hongrui (丁竑瑞), Yan Yunhua (颜云花). Response of microbial community to sunilght catalysis of semiconductor minerals in red soil [J].(高校地质学报), 2011, 17 (1): 101-106
[70] Lu Anhuai (鲁安怀), Li Yan (李艳), Wang Xin (王鑫), Ding Hongrui (丁竑瑞), Zeng Cuiping (曾翠平), Hao Ruixia (郝瑞霞), Wang Changqiu (王长秋). The utilization of solar energy by non-phototrophic microorganisms through semiconducting minerals [J].(微生物学通报), 2013, 40 (1): 190-202
[71] Rodrı́guez M, Abderrazik N B, Contreras S, Chamarro E, Gimenez J, Esplugas S. Iron(Ⅲ) photooxidation of organic compounds in aqueous solutions [J].:, 2002, 37 (2): 131-137
[72] Ding Hongrui (丁竑瑞), Li Yan (李艳), Lu Anhuai (鲁安怀), Wang Changqiu (王长秋). Primary study of pollutant reduction with microbe- rutile synergetic catalytic system [J].(矿物学报), 2010 (S1): 200-201
[73] Motoda S, Strom M, Dexter S C. Power density profile of marine biofilm battery using a TiO2anode [J].,2010, 25 (35): 3-10
[74] Motoda S, Uematsu S, Shinohara T. Influence of impurities in TiO2coatings on electrode potential of photocatalytic anode assembling to marine microbial fuel cell [J]., 2012, 41 (31): 129-136
[75] Wang H F, Qian F, Wang G M, Jiao Y Q, He Z, Li Y. Self-biased solar-microbial device for sustainable hydrogen generation [J].,2013, 7 (10): 8728-8735
[76] Yuan S J, Sheng G P, Li W W, Lin Z Q, Zeng R J, Tong Z H, Yu H Q. Degradation of organic pollutants in a photoelectrocatalytic system enhanced by a microbial fuel cell [J].,2010, 44 (14): 5575-5580
[77] Qian F, Wang H Y, Ling Y C, Wang G M, Thelen M P, Li Y. Photoenhanced electrochemical interaction between shewanella and a hematite nanowire photoanode [J].,2014, 14 (6): 3688-3693
[78] Cheng S A, Jang J H, Dempsey B A, Logan B E. Efficient recovery of nano-sized iron oxide particles from synthetic acid-mine drainage (AMD) water using fuel cell technologies [J].,2011, 45 (1): 303-307
[79] Han L, Bai L, Zhu C Z, Wang Y Z, Dong S J. Improving the performance of a membraneless and mediatorless glucose-air biofuel cell with a TiO2nanotube photoanode [J].,2012, 48 (49): 6103-6105
[80] Lu Anhuai (鲁安怀). Synergetic reaction of mine and microorganism [J].(矿物学报), 2012 (S1): 6-7
[81] Yan Lili (闫丽丽), Wang Yan (王艳), Xiong Liangbin (熊良斌),. Preparation and photocatalytic sterilization property of Cu2O nanostructure with copper anode oxidation method [J].(无机化学学报), 2009, 25 (11): 1960-1964
[82] Anta J A, Guillén E, Tena-Zaera Rn. ZnO-based dye-sensitized solar cells [J]., 2012, 116 (21): 11413-11425
[83] Chen Y L, Chen Y S, Chan H, Tseng Y H, Yang S R, Tsai H Y, Liu H Y, Sun D S, Chang H H. The use of nanoscale visible light-responsive photocatalyst TiO2-Pt for the elimination of soil-borne pathogens [J].,2012, 7 (2): 31212-31223
[84] Chen S F, Li J P, Qian K, Xu W P, Lu Y, Huang W X, Yu S H. Large scale photochemical synthesis of M@ TiO2nanocomposites (MAg, Pd, Au, Pt) and their optical properties, CO oxidation performance, and antibacterial effect [J]., 2010, 3 (4): 244-255
[85] Wang Yan (王彦), Su Huidong (苏会东), Xu Xuepeng (胥学鹏). Study on photocatalytic disinfection by TiO2immobilized on active carbon [J].(环境保护科学), 2007, 33 (4): 40-42
[86] Li Yafeng (李亚峰), Zhao Yanhong (赵艳红), Chen Ping (陈平), Zhao Jie (赵洁), Liu Juan (刘娟), Lin Qiang (林强). Preparation of the immobilized TiO2activator and the experimental study on its photo activity [J].:(沈阳建筑大学学报:自然科学版), 2008, 24 (1): 123-128
[87] Tang Bin (汤斌), Zhang Qingqing (张庆庆), Xue Zhenglian (薛正莲), Tao Yugui (陶玉贵), Huang Xiaodong (黄晓东). The preparation of Ag/TiO2polypropylene membrane and its photocatalytic and antibacterial property [J].(感光科学与光化学), 2005, 23 (5): 382-388
[88] Karunakaran C, SakthiRaadha S, Gomathisankar P. Hot-injection synthesis of bactericidal Sn-doped TiO2nanospheres for visible-light photocatalysis [J]., 2012, 2 (4): 319-326
[89] Suri R P, Thornton H M, Muruganandham M. Disinfection of water using Pt- and Ag-doped TiO2photocatalysts [J].,2012, 33 (14): 1651-1659
[90] Sikong L, Kongreong B, Kantachote D, Sutthisripok W. Photocatalytic activity and antibacterial behavior of Fe3+-doped TiO2/SnO2nanoparticles [J].,2010, 1 (2): 120-125
[91] Yeo M K, Kang M. The effect of nano-scale Zn-doped TiO2and pure TiO2particles on hydramagnipapillata [J].,2010, 6 (1): 9-17
[92] Nair M G, Nirmala M, Rekha K, Anukaliani A. Structural, optical, photocatalytic and antibacterial activity of ZnO- and Co- doped ZnO nanoparticles [J].,2011, 65 (12): 1797-1800
[93] Wu P, Xie R, Imlay K, Shang J K. Visible-light-induced bactericidal activity of titanium dioxide codoped with nitrogen and silver [J].,2010, 44 (18): 6992-6997
[94] Hamal D B, Haggstrom J A, Marchin G L, Ikenberry M A, Hohn K, Klabunde K J. A multifunctional biocide/sporocide and photocatalyst based on titanium dioxide (TiO2) codoped with silver, carbon, and sulfur [J]., 2009, 26 (4): 2805-2810
[95] Chen Qiang (陈强). Preparation and characterization of phosphor-doped titanium dioxide photocatalyst [D].Qingdao: Qingdao University of Science and Technology, 2007
[96] Khalaphallah R. Greywater treatment for reuse by slow sand filtration: study of pathogenic microorganisms and phage survival [D]. Nantes: Ecole des Mines de Nantes, 2012
[97] Zhou W, Liu H, Wang J, Liu D, Du G J, Cui J J. Ag2O/TiO2nanobelts heterostructure with enhanced ultraviolet and visible photocatalytic activity [J].,2010, 2 (8): 2385-2392
[98] Rtimi S, Baghriche O, Pulgarin C, Sanjines R, Kiwi J. Design, testing and characterization of innovative TiN-TiO2surfaces inactivating bacteria under low intensity visible light [J].,2012, 2 (23): 8591-8595
[99] Gao P, Liu J, Zhang T, Sun D D, Ng W. Hierarchical TiO2/CdS “spindle-like” composite with high photodegradation and antibacterial capability under visible light irradiation [J]., 2012, 229: 209-216
[100] Begum G, Manna J, Rana R K. Controlled orientation in a bio-inspired assembly of Ag/AgCl/ZnO nanostructures enables enhancement in visible-light-induced photocatalytic performance [J]....,2012, 18 (22): 6847-6853
[101] Kim J K, Jang J R, Choi N, Hong D, Nam C H, Yoo P J, Park J H, Choe W S. Lysozyme-mediated biomineralization of titanium-tungsten oxide hybrid nanoparticles with high photocatalytic activity [J]. C,2014, 50 (82): 12392-12395
[102] Venkata Subhash G, Chandra R, Venkata Mohan S. Microalgae mediated bio-electrocatalytic fuel cell facilitates bioelectricity generation through oxygenic photomixotrophic mechanism [J].,2013, 136: 644-653
Interaction between metal oxide and microorganism and application in energy and environment
LI Chaochao, FANG Xingliang, CHEN Jie, YANG Jiawei, CHENG Shao’an
State Key Laboratory of Clean Energy UtilizationZhejiang UniversityHangzhouZhejiangChina
Sincesolar power was introduced into the microbial fuel cell (MFC) field, there is great interest in microbial electrochemical-photoelectrochemical synergetic systems used for electrogenesis, fuel production or environmental cleaning. Metal oxide is a common medium in solar power conversion. Research on interaction between microorganism and metal oxide is necessary to understand synergy mechanism or enhance efficiency. In this paper, various interactions between microorganism and metal oxide are summarized according to physical absorption, microbial weathering, microbial mining, photocatalytic sterilization and microbe-metal oxide synergistic effects, providing a reference for the construction of efficient microbial electrochemical-photoelectrochemical synergetic systems.
metal oxide; microorganism; catalysis; metal-oxide-microbe interaction; biofuel; nanomaterials
2014-10-08.
Prof.CHENG Shao’an, shaoancheng@zju.edu.cn
10.11949/j.issn.0438-1157.20141509
TK 01; TM 911.45
A
0438—1157(2015)03—0861—11
国家自然科学基金项目(51278448);国家高技术研究发展计划项目(2012AA051502);高等学校博士学科点专项科研基金项目(20110101110018)。
2014-10-08收到初稿,2014-12-07收到修改稿。
联系人:成少安。第一作者:李超超(1992—),男,博士研究生。
supported by the National Natural Science Foundation of China (51278448), the National High Technology Research and Development Program of China (2012AA051502) and the Research Fund for the Doctoral Program of Higher Education (20110101110018).
