菌丝球形态的黑曲霉发酵液浸出铜尾砂
2015-10-15李广悦刁宁宁王永东杜康张振远
李广悦,刁宁宁,王永东,杜康,张振远
菌丝球形态的黑曲霉发酵液浸出铜尾砂
李广悦1,2,刁宁宁1,2,王永东1,2,杜康1,2,张振远1,2
(1南华大学铀矿冶生物技术国防重点学科实验室,湖南衡阳 421001;2南华大学核资源工程学院,湖南衡阳 421001)
尾砂中含有大量的金属,是一种潜在的可利用资源。旨在研发一种从铜尾砂中回收铜的生物浸出方法。利用正交设计,通过摇瓶试验,研究培养温度、发酵时间、接种量及培养基成分对黑曲霉菌丝球形态的影响,进而研究不同菌丝球形态的黑曲霉发酵液对尾砂中铜的浸出。研究表明,铜的浸出率随着黑曲霉菌丝球直径的减小而升高。在温度30℃,接种量0.8%(OD600=0.1),马铃薯-蔗糖含量30%,发酵时间65 h的优化发酵条件下,获得大量表面光滑、直径为0.96 mm的菌丝球;利用该条件下的发酵液,在30℃,180 r·min-1条件下浸出3 d,铜的浸出率达83.25%。
黑曲霉;菌丝球;发酵;浸出;铜尾砂;优化
引 言
铜尾砂是一种潜在的二次资源。据统计,我国的铜尾砂数量巨大,总量超过2亿吨。由于受矿物成分和技术条件限制,其中有1/4的铜尾砂的品位为0.5%左右[1]。大量铜尾砂的闲置和不合理处理,不仅造成资源浪费,而且还会给生态环境带来严重压力[2]。因此,研发铜尾砂中铜的高效回收技术具有重要的现实意义。
与原矿相比,铜尾砂的矿物成分复杂、碱性物质含量高、品位低,采用常规的硫酸浸出和氨法浸出难以经济回收利用[3]。而微生物浸出具有成本低、回收率高、环境友好等特点,是一种具有应用潜力的浸出方法[4]。
目前,微生物浸矿技术使用的微生物主要为两类,一类是嗜酸性的氧化亚铁硫杆菌等化能自养菌[5-7]。但这些微生物需要在很低的pH条件下生长,而且浸出需在硫酸体系中进行,因而不适于含有大量高碱耗酸性成分的铜尾砂的浸出。另一类是真菌。真菌能产生有机酸,并可与矿物中的有价金属形成可溶的金属配合物,因而被认为可以作为一种很好的浸出剂[8-9]。与氧化亚铁硫杆菌等化能自养菌相比,由于真菌可以在高pH条件下生长,所以更适合碱性矿石的浸出。近年来,利用黑曲霉等真菌及其发酵液从矿石、尾矿中浸出铜已得到众多学者的关注,如Mehta 等[10]利用黑曲霉从印度洋锰结核中浸出铜、钴和镍等金属,其中铜的浸出达97%;Mulligan 等[11]运用黑曲霉产生的有机酸从某低品位氧化矿浸出铜,浸出率达68%;Anjum等[9]和Nouren等[12]也分别利用灵芝和青霉等真菌从页岩中浸出铜等金属。
黑曲霉在液体培养基中发酵培养时,因培养条件不同,会存在悬浮的菌丝、团块状和菌丝球3种不同形态[13]。当黑曲霉以菌丝球的形态生长时,可改善发酵液的流变特性,减小发酵液黏度,并能加快营养物质和氧的传递,减少能耗,易于发酵液的分离,尤其是利于产生有机酸[14-16],这对浸出十分有利。
然而,黑曲霉在发酵液中的形态特征对浸出的影响还未得到关注。为此,本文提出了利用菌丝球形态的黑曲霉发酵液浸出铜尾砂,即通过控制培养条件,使黑曲霉在发酵液中以菌丝球的形态生长,然后利用其发酵液浸出尾砂中的铜。
1 材料与方法
1.1 铜尾砂样品
所用的铜尾砂样品取自湖南某铜尾矿库中。对尾砂粒级进行筛分分析,结果见表1。由尾砂的粒级分布结果可知,-150mm以下的产率占85%左右,可直接采用该粒级进行浸出试验。铜尾砂的X射线衍射分析(图1)结果表明,铜尾砂的脉石矿物主要有石英、方解石和白云石。经物相分析,尾砂中铜的相态为:自由氧化铜(65.78%)、结合氧化铜(3.95%)、硅孔雀石(13.16%)、原生硫化铜(1.32%)和次生硫化铜(15.79%),说明此尾砂中的铜矿物主要为氧化铜矿物。由表2化学分析结果可知,尾砂中钙、镁含量达30%以上,属高碱性尾砂;铜品位为0.456%,品位较高。

表1 铜尾砂粒径分布Table 1 Particle size distribution of copper tailings

表2 铜尾砂中的主要化学成分Table 2 Main chemical components of copper tailings/%
1.2 菌种和培养基
所用黑曲霉菌株由南华大学铀矿冶生物技术国防重点学科实验室提供。
孢子培养基:采用马铃薯-蔗糖(PSA)培养基,组分为马铃薯200 g·L-1,蔗糖20 g·L-1,琼脂粉15 g·L-1,自然pH,121℃高压灭菌30 min。
发酵培养基:采用PSA液体培养基,马铃薯-蔗糖含量分别按设计含量,为10%(马铃薯100 g·L-1,蔗糖10 g·L-1),20%(马铃薯200 g·L-1,蔗糖20 g·L-1),30%(马铃薯300 g·L-1,蔗糖30 g·L-1),自然pH,121℃高压灭菌30 min。
1.3 孢子悬液的制备
将保藏的黑曲霉接种到孢子培养基上,置于30℃的恒温培养箱内培养4 d得到成熟孢子,用灭菌的去离子水制备成孢子悬液,根据前期所开展的黑曲霉浸矿试验,将其OD600值(600 nm波长处的菌液吸光值)调至0.1用于接种(约1×107孢子·ml-1)。所有操作均在无菌操作台内进行。
1.4 发酵正交试验
为保证黑曲霉在所选取的发酵条件下均能形成菌丝球,在预试验的基础上,选取温度(A)、接种量(B)、马铃薯-蔗糖含量(C)和发酵时间(D)4个因素,各取3个水平,设计四因素三水平正交试验,以确定最佳发酵条件,正交表采用L9(34)[17],设计见表3。

表3 正交试验因素水平表Table 3 Factors and levels in orthogonal array design
按正交表设计的条件,取100 ml灭菌后的发酵培养基于250 ml锥形瓶内,接种孢子悬液,置于转速为180 r·min-1的恒温培养振荡器内培养。每组试验设置3组平行样。
发酵结束后,将发酵液过滤,用PHS-3C精密pH计测定其pH。随机选取10个菌丝球,用滤纸吸去菌丝球外表面水分,然后将其置于平板上,排成一条直线,用游标卡尺测量10个菌丝球的长度,取平均值为菌丝球的平均直径。菌丝球数量采用直接计数法。有机酸采用高效液相色谱测定。
1.5 浸出试验
分别称取5 g铜尾砂至250 ml的锥形瓶内,将其与不同发酵条件的过滤后的发酵液在121℃高压灭菌30 min。然后将灭菌后的发酵液分别加入含尾砂的锥形瓶内,置于30℃、180 r·min-1恒温培养振荡器中进行浸出试验。浸出3 d后,过滤并于105℃电热鼓风干燥箱内烘干,研磨至75mm左右。取0.1 g渣样,用HCl和HNO3进行消解后,用荧光原子吸收光谱仪(PinAAcle 900F,美国PerkinElmer公司)(波长324.75 nm)测定渣样中铜含量。试验过程中所用的化学试剂均为分析纯。
2 结果与讨论
2.1 发酵条件对黑曲霉菌丝球形态的影响
在预试验基础上,利用正交试验研究了温度、接种量、马铃薯-蔗糖含量和发酵时间等发酵条件对黑曲霉菌丝球形态影响。选取菌丝球直径为指标进行极差和方差分析,结果见表4和表5。

表4 正交试验极差分析Table 4 Range analysis of orthogonal experiments
①K—Level underof average of sum of test indicators.—Range,=max{K}-min{K}.
② Results were average value of three parallel samples.
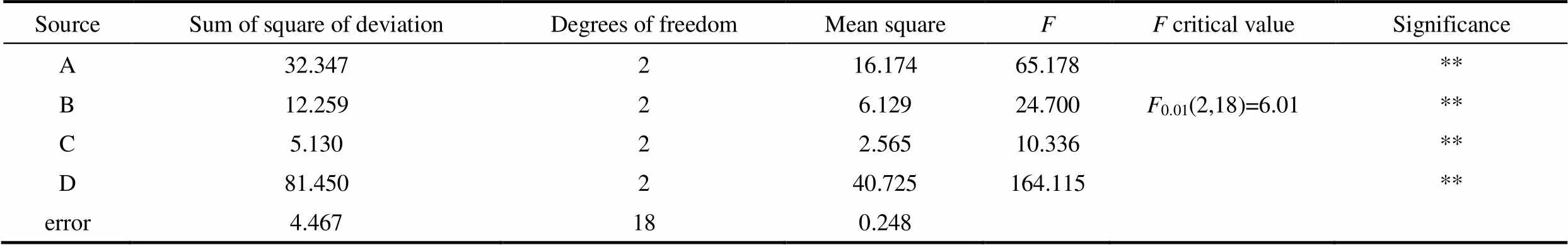
表5 正交试验方差分析Table 5 Variance analysis of orthogonal experiments
Note: If>0.01(2,18), which represents factor has a significant influence, denoted with **.
在设置的9组正交试验中黑曲霉均能以菌丝球的形态生长,说明试验条件选择合理。发酵条件不同,形成的菌丝球形态也不相同。菌丝球直径越小,其数量越多。当培养条件为温度30℃,接种量0.8%,马铃薯-蔗糖含量10%和培养65 h时,形成的菌丝球表面光滑无菌丝,球体致密[图2(a)],直径最小(1.5 mm)、数量最多。而当培养条件为温度35℃,接种量0.8%,马铃薯-蔗糖含量20%和培养50 h时,形成的菌丝球表面有菌丝,球体松散[图2(b)],直径最大(8.5 mm),数量最少。
根据极差分析结果(表4),本试验选取的4个因素的极差()分别为:发酵时间(D)为4.20,温度(A)为2.50,接种量(B)为1.43,马铃薯-蔗糖含量(C)为0.73。由此,确定4个因素对黑曲霉菌丝球直径影响的主次顺序依次为:发酵时间、温度、接种量和马铃薯-蔗糖含量。发酵条件的最佳水平组合为D2A2B3C3, 即发酵时间65 h,温度30℃,接种量0.8%,马铃薯-蔗糖含量30%。
由表5正交试验方差分析也表明,4个因素对菌丝球直径的影响程度为:发酵时间影响最为显著,其次为温度,再次为接种量,最后为马铃薯-蔗糖含量,这与极差分析结果相一致。同时4个因素对试验结果均有显著影响[>0.01(2,18)=6.01]。由方差分析中的离差平方和(sum of square of deviation)可知,4个因素的离差平方和均大于误差离差平方和,这说明试验结果的不同并非来源于试验误差而是来自于试验因素水平的改变。
发酵时间对菌丝球直径影响最大。这是因为菌丝球在发酵期间要经历成球、生长和自溶等阶段,由于发酵液的营养成分和溶解氧随着发酵时间而变化,因而菌丝球的生长也会随着变化,同时也会影响黑曲霉代谢产物的种类及含量。其次是温度,一方面温度会影响微生物活性,适宜的温度可促进黑曲霉生长和代谢;另一方面温度还影响氧的溶解和营养物质的传递,进而影响菌丝球的形成及其形态特征。Zhou等[18]研究表明,当温度<30℃时,菌丝球直径较小,而温度>30℃时菌丝球直径较大。接种量决定了黑曲霉孢子凝集形成晶核的数量以及单体细胞营养物质的供应量。接种量小时,黑曲霉孢子凝聚形成晶核数量少,营养物质及氧气供应充足,利于黑曲霉孢子的生长,形成的菌丝球个数较少,粒径较大;接种量大时,晶核数量大,真菌生长缓慢,形成的菌丝球数量多,直径小[19]。营养物质是微生物生长所必需的,黑曲霉的生长需要水分、分子氧、有机碳源、能量等。本试验使用的PSA培养中,马铃薯和蔗糖是提供黑曲霉生长的主要营养物质,因而其含量会影响菌丝球的生长和代谢。
2.2 菌丝球直径与铜浸出率的关系
不同直径的菌丝球发酵液对铜尾砂的浸出影响见图3。从菌丝球直径与铜的浸出率关系曲线可以看出,铜的浸出率随着发酵液中菌丝球直径的增加而降低。当菌丝球直径为1.5 mm时,铜的浸出率最高(79.90%);而当菌丝球直径为8.5 mm时,铜的浸出率最低(55.65%)。这是由于菌丝球的形态特征直接影响发酵液的流变学特性和发酵过程的传质效率,进而影响底物的利用和有机酸的生成[20]。菌丝球直径越小,营养物质和氧等在菌丝球表面和发酵液间的传质也越容易,营养物质利用效率越高,越利于有机酸的产生[13,18]。
图3中菌丝球直径与发酵液pH关系曲线也证实了菌丝球直径对黑曲霉产酸能力的影响。随着菌丝球直径的增大,发酵液pH也逐渐升高。当菌丝球直径从1.5 mm增大到4.2 mm时,发酵液的pH缓慢升高;而当菌丝球直径从4.2 mm增大到6.5 mm时,发酵液pH迅速升高;当菌丝球直径增大到8.5 mm时,发酵液pH达到最大(3.26)。
黑曲霉在发酵过程中会产生各种有机酸。有机酸的产生降低了发酵液的pH,进而影响铜的浸出[20]。由6号试验的发酵液中有机酸检测结果表明(表6),发酵液中含有柠檬酸、草酸、-酮戊二酸、丙酮酸、苹果酸和琥珀酸等多种有机酸。研究表明,有机酸对氧化铜矿物和硫化铜矿物均有较好的浸出能力。Shabani等[21]开展了柠檬酸浸出孔雀石(氧化铜矿物)研究,在最优条件下,铜的浸出率达91.6%。Rao等[22]用不同有机酸浸出黄铜矿(硫化铜矿物),结果表明,柠檬酸、苹果酸、草酸的浸出率分别为83.3%、80.4%和39.7%。

表6 黑曲霉发酵液中有机酸的种类和含量Table 6 Type and content of organic acids in fermentation broths of A. niger/g·L-1
黑曲霉发酵液是多种有机酸共存的体系,但不同种类的有机酸与铜离子的络合能力不同。菌丝球形态的改变会引起黑曲霉发酵液中有机酸种类及其含量的变化,因而影响铜的浸出[23]。这从图3可以看出,菌丝球直径在1.5~4.2 mm和4.2~6.5 mm的两个区间,发酵液pH的上升幅度有明显改变。而铜的浸出率的下降幅度却基本保持一致。这说明随着菌丝球直径的增大,可能导致了与铜离子有较强络合能力的有机酸含量的减少。因而,在菌丝球直径为1.5~4.2 mm的区间,尽管发酵液的pH以较小的幅度上升,但铜的浸出率仍以较快的幅度下降。
不同直径的菌丝球发酵液对铜尾砂的浸出影响结果表明,菌丝球的形态会影响黑曲霉发酵产酸性能,进而影响铜的浸出,因而通过调控黑曲霉发酵液中菌丝球的形态,可提高铜尾砂中铜的浸出率。
2.3 浸出前后铜尾砂的红外光谱分析
浸出前后的铜尾砂样品红外光谱分析结果如图4所示。浸出前后相比较,红外光谱的吸收峰变化主要集中在3700、2519、1450、1100~1000、877和470 cm-16个峰带。其中原尾砂在3700 cm-1处出现羟基吸收峰,可能是样品中含有游离水。2519 cm-1处吸收峰属OH伸缩振动,浸出后峰强度增大;1450 cm-1处吸收峰是由OH向面内弯曲所致,浸出后峰形变钝、强度减弱,这都说明羧酸增多,可能是浸出后形成了草酸钙等沉淀。1100~1000 cm-1范围内的1089、1033和1008 cm-13个相关钝峰带以及470 cm-1处吸收峰同属于Si—O的伸缩振动,浸出后峰形变钝,峰强减弱,表明Si—O结构受到了一定的破坏,这可能由发酵液中有机酸对铜尾砂的侵蚀破坏所致。
2.4 最优条件的验证试验
根据菌丝球直径与铜的浸出率关系可知,菌丝球直径越小,铜的浸出率越高。选取菌丝球直径为指标确定的发酵条件的最佳组合为D2A2B3C3,即发酵时间65 h,温度30℃,接种量0.8 %,马铃薯-蔗糖含量30%。以正交试验所得的优化条件进行验证试验,发酵液中形成的菌丝球直径为0.96 mm[图5(b)],发酵液的pH为2.20。用该发酵液在30℃,180 r·min-1条件下浸出3 d,铜的浸出率达到83.25%。而正交试验中6号试验铜的浸出率最高为79.90 %,菌丝球直径1.5 mm[图5(a)],发酵液的pH为2.28。优化条件试验中,菌丝球直径更小,而铜浸出率比正交试验中的最大浸出率高出3.35%。
3 结 论
(1)发酵液中黑曲霉的菌丝球形态与铜的浸出率密切相关。菌丝球直径越小、数量越多的发酵液,铜的浸出率越高。
(2)形成直径较小、数量较多的菌丝球时的最佳条件为:温度30℃,接种量0.8%,马铃薯-蔗糖含量30%,发酵时间65 h。在此条件下,尾砂中铜的浸出率可达到83.25%。
(3)研究表明,通过控制黑曲霉发酵液中菌丝球的形态,可提高铜尾砂中铜的浸出率。
References
[1] Wang Yanjie(王彦杰), Cao Xiangdong(曹向东). Process of recovery of copper from copper tailings [J].(武汉工程大学学报), 2007, 29(4): 42-44
[2] Chen Jiabin(陈甲斌), Wang Haijun(王海军). Study on the structure of copper tailings resources and its comprehensive utilization policy [J].(中国矿业), 2012, 21(1): 48-52
[3] Zhang Houwen(张候文), Fan Xingxiang(范兴祥), Wu Honglin(吴红林), Zou Liming(邹利明). Leaching of copper from copper slag by acid leaching with the pressure [J].(湿法冶金), 2013, 32(5): 305-308
[4] Shi Shaoyuan(石绍渊), Fang Zhaoheng(方兆珩). Bioleaching of marmatite flotation concentrate [J].(化工学报), 2004, 55(7): 1145-1149
[5] Zhang Xu(张旭), Feng Yali(冯雅丽), Li Haoran(李浩然), Wang Weida(王维大). Catalytic effect ofand Fe3+on microbial leaching process of MnO [J].(化工学报), 2014, 65(8): 3159-3163
[6] Dong Y B, Lin H, Xu X F, Zhou S S. Bioleaching of different copper sulfides byand its adsorption on minerals [J]., 2013, 140: 42-47
[7] Zhang Decheng(张德诚), Zhu Li(朱莉), Luo Xuegang(罗学刚).bioleaching of chalcopyrite at low temperature [J].(化工进展), 2008(1): 125-130
[8] Mishra A, Pradhan N, Kar R N, Sukla L B, Mishra B K. Microbial recovery of uranium using native fungal strains [J]., 2009, 95(1): 175-177
[9] Anjum F, Bhatti H N, Ghauri M A, Bhatti I A, Asgher M, Asi M R. Bioleaching of copper, cobalt and zinc from black shale by[J]., 2009, 8(19): 5038-5045
[10] Mehta K D, Das C, Pandey B D. Leaching of copper, nickel and cobalt from Indian Ocean manganese nodules by[J]., 2010, 105(1): 89-95
[11] Mulligan C N, Kamali M, Gibbs B F. Bioleaching of heavy metals from a low-grade mining ore using[J]., 2004, 110(1): 77-84
[12] Nouren S, Bhatti H N, Ilyas S. Bioleaching of copper, aluminum, magnesium and manganese from brown shale by[J]., 2013, 10(52): 10664-10673
[13] Papagianni M. Fungal morphology and metabolite production in submerged mycelial processes [J]., 2004, 22(3): 189-259
[14] Sitanggang A B, Wu H S, Wang S S, Ho Y C. Effect of pellet size and stimulating factor on the glucosamine production usingsp. BCRC 31742 [J]., 2010, 101(10): 3595-3601
[15] Villena G K, Fujikawa T, Tsuyumu S, Gutiérrez-Correa M. Structural analysis of biofilms and pellets ofby confocal laser scanning microscopy and cryo scanning electron microscopy [J]., 2010, 101(6): 1920-1926
[16] Liao W, Liu Y, Frear C, Chen S. A new approach of pellet formation of a filamentous fungus–[J]., 2007, 98(18): 3415-3423
[17] Li Yunyan(李云雁), Hu Chuanrong(胡传荣). Experimental Design and Data Processing(试验设计与数据处理)[M]. 2nd ed. Beijing: Chemical Industry Press, 2005: 208-215
[18] Zhou Z, Du G, Hua Z, Zhou J, Chen J. Optimization of fumaric acid production bybased on the morphology formation [J]., 2011, 102(20): 9345-9349
[19] Teng Y, Xu Y, Wang D. Changes in morphology ofin submerged fermentation and their effect on production of mycelium-bound lipase [J]., 2009, 32(3): 397-405
[20] Jiang Xuewei, Luo Xiaoming, Sheng Canmei, Gao Bida. Effects of culture conditions of mycelial pellet formation and L-lactic acid production by[J]., 2010(15): 216-220
[21] Shabani M A, Irannajad M, Azadmehr A R. Investigation on leaching of malachite by citric acid [J]., 2012, 19(9): 782-786
[22] Rao D V, Shivannavar C T, Gaddad S M. Bioleaching of copper from chalcopyrite ore by fungi [J]., 2002, 40(3): 319-324
[23] Magnuson J K, Lasure L L. Organic acid production by filamentous fungi//Advances in Fungal Biotechnology for Industry, Agriculture, and Medicine[M]. US: Springer, 2004: 307-340
Bioleaching of copper from tailings by fermentation broths ofin pellet form
LI Guangyue1,2, DIAO Ningning1,2, WANG Yongdong1,2, DU Kang1,2, ZHANG Zhenyuan1,2
(1Key Discipline Laboratory for National Defense of Biotechnology in Uranium Mining and Hydrometallurgy, University of South China,Hengyang 421001, Hunan, China;2School of Nuclear Resources Engineering, University of South China,Hengyang421001, Hunan, China)
Owing to the substantial amounts of metals embodied in tailings, they are potential viable sources of metals.This work aims at developing a technique to microbially recover copper present in tailings.Based on orthogonal design, the effects of different variables, such as temperature, fermentation time, inoculum size and medium components, on pellet morphology ofwere investigated in shake flasks. Leaching of copper from its tailings was conducted using fermentation broths ofwith different pellet morphology. Copper extraction gradually increased with reduction in pellet diameter of. A large amount of compactsmooth pellets with a diameter of 0.96 mm were obtained under the optimum fermentation conditions of 30℃, 0.8% inoculum size(OD600=0.1), 30% potato-sucrose contents, 65 h fermentation time. After 3 days of leaching,copper extraction reached 83.25% with the fermentation broths aforementioned at 30℃, 180 r·min-1.
; mycelium pellets; fermentation; leaching; copper mill tailings; optimization
2014-07-14.
Prof. LI Guangyue, lgy673@163.com
10. 11949/j.issn.0438-1157.20141047
TF 18
A
0438—1157(2015)02—0717—06
湖南省教育厅资助重点科研项目(13A083)。
2014-07-14收到初稿,2014-11-04收到修改稿。
联系人及第一作者:李广悦(1970—),男,博士,教授。
supported by the Key Scientific Research Fund of Hunan Provincial Education Department(13A083).
