不同基因型南荻愈伤组织诱导及分化的差异
2015-10-10彭思佳刘清波易自力蒋建雄
彭思佳,肖 亮,刘清波,易自力,蒋建雄,2
(1.湖南农业大学生物科学技术学院芒属植物研究所,湖南 长沙 410128;2.江苏大学生物质能源研究所,江苏 镇江 212013)
矿物能源短缺和环境污染是人类面临的两大危机,可再生性生物质能源的开发利用正成为世界关注的焦点,能源植物与化石能源相比更具有安全环保性,木质纤维类能源植物相对众多的能源植物开发前景更为可观[1]。芒属(M iscanthus)植物是一类多年生C4高大草本纤维类植物,广泛分布于东亚,且以我国为遗传多样性中心,主要种类有芒(M. sinensis)、五节芒(M. floridulus)、荻(M. sacchariflorus)和南荻(M. lutarioriparius)等[2],其中南荻为我国特有种[3]。南荻具有生物产量高、纤维品质好、根系发达、种植成本低和适应性强等特点,不仅可以直接燃烧产生能量和作为生物乙醇原料,也可以作为造纸原料和饲料,还可以防风固土[4],因此,南荻兼具经济价值和生态效益,大规模种植具有重要意义。
南荻高度自交不亲和,以无性繁殖为主,有性繁殖为辅,长期的无性繁殖会导致种性退化甚至严重病毒积累,杂交会导致后代变异增大,不利于品种优良品质的保存,而组织培养技术不仅可以保持种质的优良特性状,也是进行品种改良的基础。因此,开展组织培养技术对南荻开发利用至关重要。目前,不少研究者对南荻离体培养多方面进行了研究,如外植体、基本培养基、激素配比、移栽条件等,旨在建立高效的再生体系[5-7],而关于基因型对再生能力的影响尚无报道。基因型是导致再生频率差异的重要内在因素,对离体培养存在影响已在玉米[8]、苎麻[9]、奇岗[10]和芒[11]等材料上得到证明。试验以采自不同地区的南荻为试验材料,探究不同基因型南荻再生能力与茎秆成分之间的关系,旨在筛选再生频率高的材料作为组织培养的优良供体,为进一步完善南荻遗传转化体系、多倍体诱导及转基因技术提供参考。
1 材料与方法
1.1 试验材料
以采集于全国各地的野生南荻种质资源为试验材料,现保存于湖南农业大学芒属能源植物资源圃,试材具体信息见表1。

表1 供试植物材料的基本信息
1.2 试验方法
1.2.1 培养基 以MS 培养基为基本培养基,分别配制愈伤组织诱导、继代和分化培养基,pH 值均调至5.8[12]。愈伤组织诱导培养基:MS+2 mg/L 2,4-D+0.1 mg/L 6-BA+0.2 g/L 柠檬酸+30 g/L 蔗糖+8 g/L 琼脂粉;愈伤组织继代培养基:MS+2 mg/L 2,4-D+30 g/L 蔗糖+8 g/L 琼脂粉;分化培养基:MS+2.5 mg/L 6-BA+0.5 mg/L 水解酪蛋白+30 g/L 蔗糖+8 g/L 琼脂粉。
1.2.2 离体组织培养 采取颖花原基形成时期(旗叶抽出不久)大小一致的幼穗,4℃保存24 h,取出后剥去叶鞘和外层苞叶,用75%乙醇进行表面消毒,在超净工作台上用0.1%升汞灭菌10 min 后,用无菌水冲洗4~5 次[13-15],放置于无菌滤纸上吸干外植体表面水分,剥出幼穗并剪切成1 cm 左右长段。
将幼穗段接入愈伤组织诱导培养基中,25±1℃暗培养30 d 后统计愈伤组织块数。切下胚性愈伤组织转接入继代培养基中,暗培养15 d 后统计胚性愈伤组织块数。
挑取胚性愈伤组织接入分化培养基中,置于25±1℃、14 h/d、光照强度1 500~2 500 lx 的条件下进行培养,30 d 后统计愈伤组织的植株分化率。
1.2.3 茎秆化学成分测定 各基因型随机取5个茎秆,经45℃烘干粉碎、过40 目筛,密封储存备用。采用中性洗涤剂和酸性洗涤剂法测定半纤维素含量,采用72%浓硫酸水解和灰化法测定纤维素和Klason 木质素含量,采用直接灰化法测定总灰分含量,105℃直接干燥法测定含水量[16]。
1.2.4 数据统计与分析 对不同基因型南荻的再生过程进行观察和统计。按公式(1)、(2)、(3)计算愈伤组织诱导率、胚性愈伤组织诱导率和胚性愈伤组织分化率。重复10 次。

采用Excel 2007 和DPS 7.05 进行数据统计、多重比较和回归分析。
2 结果与分析
2.1 不同基因型的愈伤组织诱导和植株分化能力比较
在幼穗在接入诱导培养基后,B9 幼穗于第7 d两端产生愈伤组织;C2、A6 和A2 幼穗两端在第9 d产生愈伤组织,A4 和C4 的在第10 d 产生愈伤组织;A9 和A1 在第12 d 产生愈伤组织。愈伤组织颜色主要是淡黄色、紫色、黄色、褐色,分为胚性愈伤组织和非胚性愈组织伤两种。B9 愈伤组织以黄色(图1 A)为主,在首次继代过程中愈伤组织全部褐化死亡,无继代能力(图1 B)。C4、A2 和A1 以黄色颗粒状、干燥胚性愈伤组织为主,但在继代3 次便出现严重褐化和水渍化,大量愈伤组织死亡进而丧失继代能力;C2、A4、A6 和A9 愈伤组织以淡黄色和紫色愈伤组织为主(图1 C,D),前三者愈伤组织继代能力强,胚性愈伤组织产生率高,后者愈伤组织在继代过程中严重水渍化,产生大量非胚性愈伤组织,丧失继代能力。不同基因型材料愈伤组织诱导率存在显著差异(表2)。A4、A6 愈伤组织诱导率和胚性愈伤组织诱导率均在80%以上,与其余基因型比较存在显著差异(P<0.05),B9、C4 和C2 愈伤组织诱导率居中(高于60%),A2 愈伤组织的诱导率最低(34.4 %),A9 和C2 的胚性愈伤组织诱导率在60%以上、仅低于A4 和A6。
将愈伤组织接入分化培养基中,不同基因型愈伤组织出现绿色芽点时间不同,A4 愈伤组织接入后最早出现分化现象,最早为第3 d(图1 E)。A6、C2、A1、A2、C4 愈伤组织接入分化培养基后第7 d 开始出现绿色芽点,B9 和A9 接入分化培养基后第14 d才开始分化,30 d 芽点发育成丛生芽(图1 F)。由表2 可知,不同基因型愈伤组织分化能力差异极显著。A4 和A6 的胚性愈伤组织分化率最高,分别为91.8%和83.3%,分化过程中以芽先出现为主,极少分化为根,获得丛生芽能力强,小苗健壮;其次为C2 和C4 分化率大于50%,大部分分化为芽、部分为根;B9 愈伤组织分化率最低为7%,与其他材料差异显著(P<0.05);材料分化率低的原因是在分化过程中部分愈伤组织更多分化为白色的根,只有少数分化成芽点后成苗。综合比较诱导率和分化率,A4 和A6 材料的再生能力强;C2 胚性性愈伤组织诱导和分化能力较好,可以适当改良培养条件以提高再生频率;B9 的愈伤诱导率高但分化率极低,不适合用于离体培养。
2.2 南荻茎秆成分比较

图1 南荻愈伤组织诱导及植株分化

表2 不同基因型愈伤组织诱导率和植株分化能力的比较(%)
由表3 可知,8个材料的茎秆成分中纤维素、半纤维素、木质素、灰分和水分的含量均存在显著差异。半纤维素含量均值A4 最大为40.87%,其次是A6(36.82%) 和B9(31.65%), 最 小 的 为A1(27.23%);纤维素和木质素含量均值最小的均为A4,其次是A6,纤维素中均值最大的为A1,木质素含量最低的是A4;在灰分含量方面所测材料的灰分量在2.03%~3.33%间,灰分最低的是A6,最高的为A4;而在105℃含水量和45℃总含水量两者上A6 含水量均是最低。
2.3 南荻愈伤组织诱导率和植株分化率与茎秆化学成分的回归分析
表4 结果显示,南荻愈伤组织诱导率与茎秆中半纤维素含量有正相关性,而与木质素含量和105℃含水量呈显著负相关,多元决定系数为0.977,说明半纤维素、木质素以及105℃含水量是决定南荻幼穗诱导愈伤组织的主要因子。从胚性愈伤组织诱导率回归模型可以看出,南荻胚性愈伤组织诱导率与茎秆的纤维素含量和45℃总含水量有显著的负相关性,多元决定系数是0.811,表明这两者在决定胚性愈伤组织的诱导率上有重要作用。对胚性愈伤组织的植株分化率和相关因子进行回归分析显示,它与半纤维素含量和45℃总含水量负相关,与木质素含量和105℃含水量正相关,四者共同对分化率起主要影响作用。
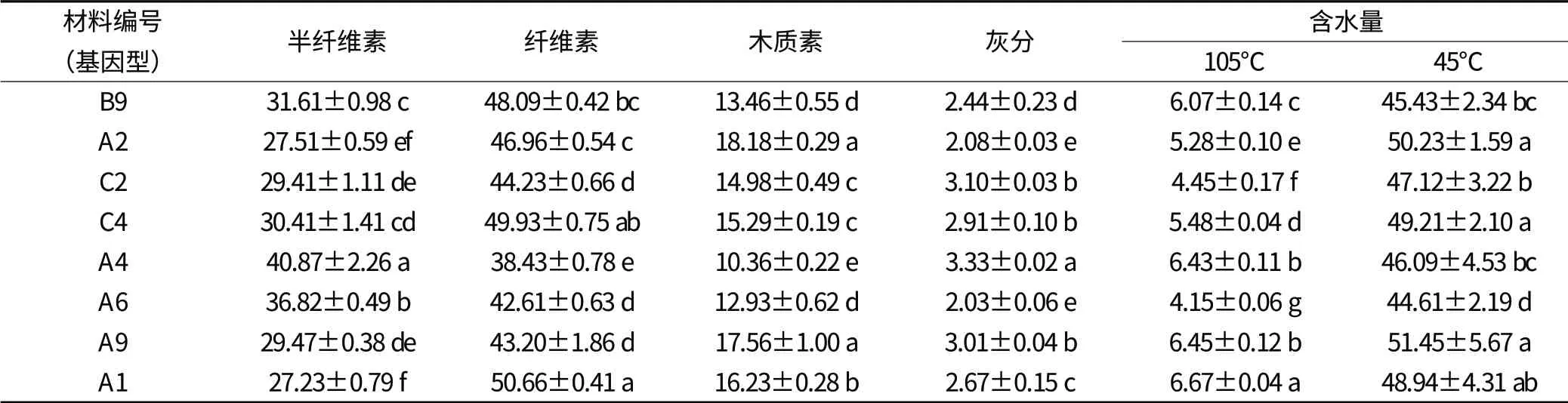
表3 南荻茎秆化学成分含量比较 (%)

表4 诱导率和分化率与茎秆化学成分逐步回归分析
3 讨论与结论
基因型是影响植物表型的内在因素,有研究表明基因型对多种植物的再生能力存在重要影响[17]。芒属植物属于较难再生的植物,基因型是影响芒再生频率的首要内在因素[18]。本研究表明不同基因型南荻再生频率存在显著差异,筛选再生频率高的材料、寻找受基因型控制且影响南荻再生频率的因素,对建立南荻高效繁殖体系具有重要作用。何立珍等[5]早在上世纪90年代就对南荻的不同外植体进行比较研究,指出幼穗是南荻的最佳外植体,并且在适宜的培养基上获得了较高的愈伤组织诱导率;易自力[6]对南荻愈伤组织诱导的基本培养基、激素配比及愈伤组织继代能力进行研究,获得适宜的培养组合;郭夏宇等[7]也探究了激素和添加物对南荻再生频率的影响;然而,研究者均未从基因型影响南荻再生频率的角度进行分析,且无相关研究报道。本研究结果显示,基因型对南荻愈伤组织诱导和分化均具有显著影响,8种基因型的愈伤组织诱导率为34.4%~97.5%,胚性愈伤组织频率为25.8%~92.9%;而植株分化率变动范围更广,为7.0%~91.8%。在8种基因型材料中,胚性愈伤组织诱导率和植株分化率均以A4 和A6 为较高。
褐化是影响植株再生的一个重要原因,很多植物离体组织的再生能力差均是因为其外植体褐化严重,不能获得质地优异或不能成功诱导愈伤组织产生,尤其以木本植物最为明显,木本植物木质化严重在组织培养过程中分泌大量的酚类物质氧化褐变,毒害外植体使植株再生能力下降,因此,木质素含量与植株再生频率有相关性。研究显示芒属植物木质素含量和植株的再生频率存在一定的相关性[11]。本研究对南荻茎秆的一些成分进行测定,分析结果表明不同基因型材料的半纤维素、纤维素、木质素、灰分和含水量均存在显著差异,对它们与植株的愈伤组织诱导率、胚性愈伤组织诱导率和胚性愈伤组织分化率进行回归分析显示,愈伤组织诱导率主要受茎秆成份中的半纤维素、木质素和105℃含水量的影响;胚性愈伤组织诱导率主要受纤维素和45℃总含水量含量影响,含水量和纤维素含量低胚性愈伤组织诱导高。将影响愈伤组织分化率的因素与愈伤组织诱导率的因素进行比较,除以上3种影响因子外,45℃总含水量也对分化率有影响。综合比较而言,纤维素含量高、木质素和含水量含量低的材料再生频率较高,该结论对于芒属植物离体组织培养过程中的基因型选择具有重要的指导意义。
[1]Lang A,Kopetz H,Parker A. Australia:biomass energy holds big promise [J]. Nature,2012,488:590-591.
[2]Lew andow ski I,Scurlock J M O,Lindvall E. M yrsini C The development and current status of Perennial rhizomatous grasses as energy crops in the US and Europe [J]. Biomass Bioenergy,2003,25(4):355-361.
[3]Chen S L,Renvoize S A. M iscanthus Andersson[M]. Wu Z Y,Raven P H. Flora of China. Beijing:Science Press,2006. 581-583.
[4]易自力. 芒属能源植物资源的开发与利用[J]. 湖南农业大学学报(自然科学版),2012,38(5):455-463.
[5]何立珍,周朴华,刘选明,等. 荻不同外植体离体培养研究[J]. 西北植物学报,1995,15(4):307-313.
[6]易自力,周朴华,储成才,等. 南荻遗传转化系统的建立及转基因植株的获得[J]. 高技术通讯,2001,(4):20-24.
[7]郭夏宇,李合松,彭克勤,等. 南荻的组织培养与快速繁殖技术[J]. 植物生理学报,2011,47(10):987-990.
[8]黄 璐,卫志明. 不同基因型玉米的再生能力和胚性与非胚性愈伤组织DNA 的差异[J]. 植物生理学报,1999,25(4):332-338.
[9]Glowacka K,Jezowski S,Kaczmarek Z. The effects of genotype,inflorescence developmental stage and induction medium on callus induction and plant regeneration in two M iscanthus species[J]. Plant Cell Tissue Organ Cult,2010,102(1):79-86.
[10]王晓玲,彭定祥. 不同基因型对苎麻愈伤组织诱导及分化的影响[J]. 长江大学学报(自科版)2005,2(8):64-67.
[11]刘 琳,俞 斌,黄鹏燕,等. 芒不同基因型愈伤组织诱导及分化的差异[J]. 植物学报,2013,48(2):192-198.
[12]夏亚男,蒋建雄,易自力,等. 三种抗褐化剂对南荻外植体褐变及愈伤诱导率的影响[J]. 北方园艺,2014,(17):93-96.
[13]徐春波,米福贵,王 勇,等. 影响冰草成熟胚组织培养再生体系频率的因素[J]. 草业学报,2009,18(1):81-85.
[14]王友生,王 瑛,李阳春. .三叶草愈伤组织诱导及分化的研究[J]. 草业学报,2009,18(2):212-215.
[15]李 晶,孙吉雄,梁慧敏.日本矮生沿阶草愈伤组织的诱导及其分化[J]. 草业科学,2009,26(4):150-153.
[16]仰 勇. 芒属植物生物质化学成分比较研究[D]. 长沙:湖南农业大学,2011.
[17]Wang X,Yamada T,Kong F J,et al. Establishment of an efficient in vitro culture and particle bombardment-mediated transformation systems in M iscanthus sinensis Anderss.,a potential bioenergy crop[J]. GlobChange Biol Bioenergy,2011,3(4):322-332.
[18]Seong E S,Yoo J H,Kil H Y,et al. Estab-lishment of a regeneration system by callus induction from explants of M iscanthus sinensis[J].J. Korean Soc. Appl. Biol. Chem,2010,53(6):661-667.
