曲霉发酵啤酒糟培养基配方的优化
2015-10-10宾冬梅李玉中李小林
宾冬梅,李玉中,李小林
(衡阳师范学院生命科学与环境学院,湖南 衡阳 421008)
啤酒糟是生产啤酒的主要原料大米、麦芽等经糊化、糖化工艺进行过滤或压滤之后残留的固体物质,主要成分包括蛋白质、纤维组分、维生素、脂肪、矿物质及淀粉等[1],含水量大,容易变质。通常,啤酒企业将啤酒糟直接作为粗饲料销售,但因其纤维含量高、适口性差,养殖户不能完全接收[2-5];另有不少企业将其作为废弃物排放,不仅浪费资源,还造成严重的环境污染。为了有效开发利用啤酒糟,试验针对其粗纤维和粗蛋白高的营养特点,优选出纤维素酶高产菌,将纤维素分解成可供利用的糖类,再经酵母菌和枯草芽孢杆菌进行二次混菌发酵,生产出高微生物蛋白啤酒糟饲料或微生态制剂,以达到立体开发啤酒糟的目的。
目前,国内外产纤维素酶的主要菌种是曲酶、木霉等[6-10],世界上纤维素酶市场中的纤维素酶20%是来自木霉属和曲霉属[11]。笔者从富含纤维素的土壤中分离和筛选纤维素高效降解曲霉菌株,以啤酒糟为主料,添加不同的C 源和N 源,并调整其比例,观察曲霉生长数目与形态,从而得出曲霉产纤维素酶活性最高的培养配方研究,以期筛选出发酵啤酒糟的优良菌株。
1 材料与方法
1.1 试验材料
1.1.1 供试啤酒糟及菌种 试验所用的啤酒糟取自衡阳市燕京啤酒厂,经过干燥、过100 目筛、储存备用。在衡阳市郊区及祁东县采集富含纤维的稻田土壤样本,从中提取活性菌种,在实验室鉴定其为曲霉,作为供试菌种。
1.1.2 试验仪器 试验主要仪器有SW-SJ-1F 单人双面洁净工作台(上海博讯实业有限公司医疗设备厂)、BXM-30R 立式压力蒸汽灭菌器(上海博讯实业有限公司医疗设备厂)、DHG-9040A 型电热恒温鼓风干燥箱(宁波江南仪器厂)、FA2004N 电子天平(河南兄弟仪器设备有限公司)、WHY-2 水域恒温振荡器(江苏省金坛市环宇科学仪器厂)、SPX-150BSH-Ⅲ 生化培养箱(上海新苗医疗器械制造有限公司)。
1.1.3 培养基 (1)活化培养基(马丁氏培养基):CMC-Na 10 g/L,蛋白胨10 g/L,酵母膏10 g/L,磷酸二氢钾2 g/L,硫酸铵1.5 g/L,琼脂15 g/L ,pH 值6.0。(2)选择培养基(以啤酒糟为主料加入C 源或N 源的培养基):磷酸二氢钾 0.5 g/L,硫酸镁0.25 g/L,琼脂14 g/L,明胶2 g/L,纤维素粉1.88 g/L(预先经1 mol/L 盐酸冷处理12 h,以水清洗,无盐酸后用来配置培养基),刚果红0.2 g/L,pH 值6.0。(3)刚果红纤维素琼脂[12]:KH2PO40.5 g/L,MgSO40.25 g/L,琼脂14 g/L,明胶2 g/L,纤维素粉1.88 g/L(纤维素粉预先经1 mol/L 盐酸冷处理12 h,以水清洗,无盐酸后用来配制培养基),刚果红0.2 g/L,pH 值7.0。
1.2 试验方法
1.2.1 曲霉的分离与鉴定 将采集的稻田土壤样本用无菌水混合,充分振荡,经灭菌纱布过滤,静置,上清液接种于富集培养基中,取富集菌接种到PDA 培养基上,28℃恒温培养,进行菌株分离,将分离纯化得到的菌株活化并配制成孢子悬浮液,分别点接到刚果红纤维素琼脂培养基中,重复3 次,恒温培养,用十字交叉法测量菌落直径和透明圈直径。根据菌落生长状态、透明圈大小、透明圈清晰程度以及菌落和透明圈的比值,筛选菌株。用显微镜观察菌丝及孢子梗形状,并用油镜观察其孢子形态,参阅《中国真菌志》[13]等进行鉴定。结果显示,筛选到的菌株为曲霉,命名曲霉6-3。
1.2.2 最适氮源和碳源的筛选 将曲霉6-3 接种于活化培养基上,于28℃培养7 d,取10 m L 无菌生理盐水洗下孢子,加1 滴吐温80 打散孢子团块,用血球计数板计数,调整孢子浓度至105~106个/m L。称取100.00 g 解冻的啤酒糟,分别取10.00 g 置于10个小烧杯中。在此基础上,分别在小烧杯中添加0.40 g N源(分别为酵母浸液、硫酸铵、胰蛋白胨、牛肉膏、尿素)或碳源(分别为乳糖、葡萄糖、淀粉、蔗糖),设置1个空白对照组(CK),对配置好的培养基编号,每个处理重复2 次。培养基灭菌后接种曲霉6-3,置于28℃恒温箱中培养7 d,观察菌种长势,筛选出促进曲霉6-3 生长的最适碳源和氮源。
1.2.3 氮源和碳源最佳添加量的确定 在筛选的最适碳源和氮源的基础上,根据初步试验结果[14],设定最优N 源的添加量分别为3%、4%、5%、6%,最优C源的添加量分别为4%、6%、8%、10%。每个处理重复2 次,根据菌株长势确定促进曲霉6-3 生长的最适碳源和氮源的添加量。
1.2.4 氮源和碳源混合的最佳配比 在确定最适碳源和氮源添加量的基础上,依据氮碳源的比值3︰5、3︰6、3︰7、4︰5、4︰6、4︰7、5︰5、5︰6、5︰7,将加入的碳氮源与啤酒糟充分混匀。每个处理重复2次,根据菌株长势确定促进曲霉6-3 生长氮碳源的最佳配比。
1.2.5 羧甲基纤维素钠酶活力的测定 采取3,5-二硝基水杨酸(DNS)显色法测定葡萄糖标准液的浓度,并绘制曲线,线性方程为y=0.441 4x+0.091 6,R2=0.993 4。啤酒糟发酵结束后,取各处理的啤酒糟加100 m L 蒸馏水,于40℃水浴振荡浸提1 h,脱脂棉过滤,滤液于3 500 r/min 下离心5 min,上清液即粗酶液。在25 m L 具塞试管中加入1.5 m L 以pH 值5.0 柠檬酸缓冲液配制的1% CMC-Na 溶液,置于50 ℃ 水浴中预热 5 min。加入0.5 mL 粗酶液酶,摇匀,50℃准确反应 40 min,之后加入DNS 试剂1.5 m L,放入沸水浴显色 5 min,取出后立即置于冰水中冷却至室温,定容至 10 m L,摇匀。在波长540 nm 条件下测定其吸光值[14-15]。酶活单位的定义为在上述反应条件下,每分钟催化纤维素水解生成 1 μg 葡萄糖的酶量为1个酶活力单位,用 U/m L 表示。

式中,S 为样品平均吸光值在标准曲线上对应的葡萄糖含量(mg);D 为定容体积;V 为参与反应的粗酶液体积(m L);T 为反应时间(min)。
2 结果与分析
2.1 碳源的筛选
2.1.1 最适碳源 由图1 可知,4种不同的碳源中最能促进曲霉6-3 生长的是乳糖,而蔗糖、淀粉、葡萄糖的促进效果差别不明显。同时,对比只加氮源和只加碳源的处理,发现曲霉6-3 在只加入氮源的培养基中有利于菌丝生长,而在只加入碳源的培养基种则有利于孢子产生。

图1 不同氮源对啤酒糟上曲霉6-3 生长的影响
2.1.2 碳源最佳添加量 试验结果显示,碳源添加量为6%的培养基中,曲霉6-3 长势最好,其次是添加量为8%的培养基中,曲霉6-3 菌株长势较好,而添加量为4%和10%的培养基中,曲霉6-3 菌株长势一般。因此,可以认为碳源的最佳添加量范围为5%~7%之间。
2.2 氮源的筛选
2.2.1 最适氮源 从图2 中可以看出,5种氮源中最能促进曲霉6-3 生长的是胰蛋白胨,其次分别是牛肉膏、酵母粉和硫酸铵,促进曲霉6-3 生长效果最不明显的是尿素。

图2 不同碳源对啤酒糟上曲霉6-3 生长的影响
2.2.2 氮源最佳添加量 试验结果显示,氮源添加量为4%时,曲霉6-3 的长势最好,其次是3%和5%的处理,二者的差异不明显,而添加量为6%的培养基中,曲霉6-3菌株的长势一般。因此,确定最适氮源——胰蛋白胨的最佳添加量为4%。
2.3 最适碳源和最适氮源的混合比例确定

图3 不同氮碳源比例对曲霉6-3 生长的影响
由图3 可知,随着氮源添加量的增加,曲霉6-3的长势越来越好,而碳源添加量的增加对曲霉的长势影响不显著;其中,碳氮比为4︰7、5︰5、5︰6的处理对曲霉6-3 的生长促进作用差异不明显,而对曲霉6-3 生长促进作用最差的碳氮比是3︰5,而促进作用最明显的碳氮比为5︰7。
2.4 发酵产物中的CMC 酶活力
从表1 中可以看出,碳氮比为 5︰7 的处理,发酵后啤酒糟的羧甲基纤维素酶活力最高,达188.49 IU,比空白对照处理的高121.2 IU,比其他碳氮比处理的高49.84~57.77 IU;各处理葡萄糖含量也以碳氮比为 5︰7 的处理最高,达0.38 g,是空白对照处理的2.71 倍,比其他碳氮比处理的高35.7%~46.2%。上述结果与从菌株长势情况判断得出的纤维素酶活性结论一致。同时,试验结果也表明在啤酒糟中加入适当的外源物质有利于曲霉产生纤维素酶。
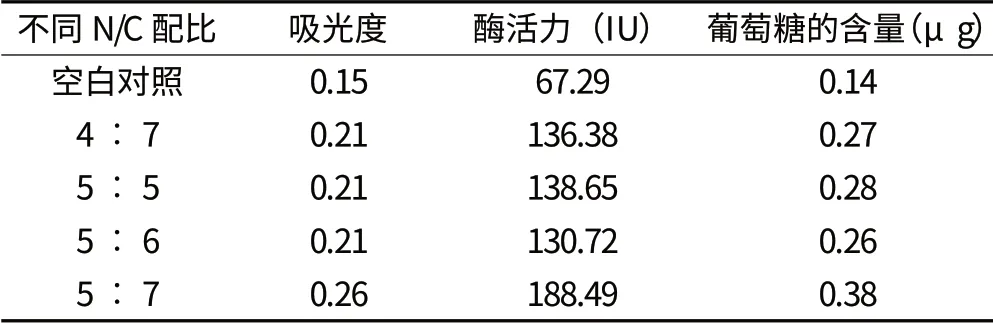
表1 不同碳氮比处理对曲霉6-3 纤维素酶活性的影响
3 结 论
综上所述,试验从富含纤维的土壤中提取到曲霉菌株曲霉6-3,初步筛选出其生长最适的碳源和氮源分别为乳糖和胰蛋白胨,其最佳添加量分别为6%和4%;促进曲霉6-3 生长的最优碳氮比为5︰7,发酵后维素酶活力达188.49 IU,葡萄糖含量为0.38 g。这表明啤酒糟可以作为曲霉的优良培养基,对选育优良的啤酒糟纤维素分解菌具有一定的指导意义。
[1]邓启华,傅 力,王 德. 啤酒糟成分测定及饲料开发的研究——蛋白含量及纤维组分的分析[J]. 啤酒科技,2008,(12):52-54.
[2]孙丹凤,王友炜,王 聪. 发酵啤酒糟营养价值评定及对肉鸡生长性能的影响[J]. 饲料工业,2009,(17):26-28.
[3]王 冰,方热军. 酶解发酵啤酒糟在动物生产中的应用[J]. 广东饲料,2011,(8):41-42.
[4]蔡 俊. 啤酒糟发酵生产蛋白饲料的研究[J]. 粮食与饲料工业,2001,(3):30-31.
[5]郭素环,周碧君,文 明,等. 酒糟生物饲料对肉牛育肥及免疫功能的影响[J]. 广东农业科学,2013,(14):126-129.
[6]杜先林,李 辉,王义强,等. 里氏木霉Rut-30 产纤维素酶发酵条件的优化[J]. 中南林业科技大学学报,2010,(9):112-119.
[7]刘小杰. 康氏木霉ZJ5 纤维素酶发酵培养基优化[J]. 浙江大学学报(工学版),2003,(5):127-132.
[8]王仪明. 绿色木霉固态发酵产纤维素酶活力的研究[J]. 草业科学,2009,(5):123-127.
[9]李燕红,赵辅昆. 纤维素酶的研究进展[J]. 生命科学,2005,(5):20-25.
[10]王洪媛,范丙全. 三株高效秸秆纤维素降解真菌的筛选及其降解效果[J]. 微生物学报,2010,(7):870-875.
[11]魏亚琴,李红玉. 纤维素酶高产菌选育研究进展及未来趋势[J]. 兰州大学学报(自然科学版),2008,(1):107-115.
[12]王淑军,杨从发,陈 静. 用于降解秸秆的纤维素酶产生菌的筛选研究[J]. 粮食与饲料工业,2001,(12):21-23.
[13]孔华忠. 中国真菌志[M]. 北京:科学出版社,2007. 54-56.
[14]Coward-Kelly G,Aiello-M azzari C, Kim S, et al. Suggested improvements to the standard filter paper assay used to measure cellulase activity[J]. Biotechnology and Bioengineering,2003,82(6):745-749.
[15]许玉林,郑月霞,叶冰莹,等. 一株纤维素降解真菌的筛选及鉴定[J]. 微生物学通报,2013,(2): 220-227.
