金氏真蛇尾多糖的抗氧化和抑菌活性研究
2015-09-29甄静荣丛建森曲江勇侯建海郭承华烟台大学生命科学学院山东烟台264005
甄静荣,丛建森,曲江勇,侯建海,郭承华*(烟台大学生命科学学院,山东烟台264005)
金氏真蛇尾多糖的抗氧化和抑菌活性研究
甄静荣,丛建森,曲江勇,侯建海,郭承华*
(烟台大学生命科学学院,山东烟台264005)
以黄海产金氏真蛇尾为原材料,采用碱提法,经脱脂、脱蛋白后得金氏真蛇尾多糖,通过Fenton反应和邻苯三酚自氧化法来测定多糖溶液对自由基的清除能力,采用滤纸片法测定金氏真蛇尾多糖对大肠杆菌、金黄色葡萄球菌、啤酒酵母菌和灰绿青霉的抑制作用。结果显示:金氏真蛇尾多糖对羟基自由基(·OH)和超氧阴离子(O2-·)具有较好的清除作用,并且清除率与多糖溶液呈现量效关系,多糖对羟基自由基(·OH)和超氧阴离子(O2-·)的最大清除率分别为45.68%和40.47%,表明蛇尾多糖具有一定的抗氧化活性,但是仍小于同质量浓度的VC溶液;金氏真蛇尾多糖对大肠杆菌、金黄色葡萄球菌和啤酒酵母的抑菌圈大小分别为13.46 mm、14.12 mm和14.73 mm,具有较好的抑菌作用,但对灰绿青霉则没有抑制作用。通过抗氧化和抑菌活性的研究,表明黄海产金氏真蛇尾多糖具有较好的抗氧化及抑菌活性。
金氏真蛇尾;多糖;抗氧化活性;抑菌活性
金氏真蛇尾(Ophiura kinbergi)属棘皮动物门(Echino dermata)蛇尾纲(Ophiuroidea)鳞蛇尾科(Ophiolepididae)[1-2],是分布在黄渤海海域比较常见的一种棘皮动物。金氏真蛇尾不仅营养成分含量丰富[3],而且含有多糖等多种具有生理活性的成分。多糖作为一种重要的生物活性物质,具有降血糖、降血脂、抗肿瘤、抗病毒、抗心血管疾病及免疫调节等多种生物活性[4-5],因此金氏真蛇尾的应用前景十分广阔。
在棘皮动物中,相比较而言,对海参纲和海星纲动物[6-7]研究较多,而对蛇尾纲动物研究则较少,对其研究也主要集中在生态学分布和再生机制[8-9]方面。CHEKAREVA V等[10]从Ophiocoma echinata和环棘鞭蛇尾(Ophiomastix annulosa)两种动物体内得到了神经节苷脂。通过质谱分析和13C-核磁共振光谱仪等化学方法分析其结构。从环棘鞭蛇尾体内提取分离并鉴定其结构为双唾液酸神经节苷脂。LEVINA V等[11-12]从蛇尾纲中萨氏真蛇尾(Ophiurasarsii vadicola)和Ophiura leptoctenia中分离并鉴定出硫酸化和非硫酸化的两种甾体化合物;同时又从萨氏真蛇尾乙醇浸提液中分离并鉴定出聚羟基类固醇硫酸盐。另外,林翠梧等[13]从采自于广西涠洲岛的锥疣星蔓蛇尾(Axtroclarusconiferus)分离得到4种甾类化合物,利用波谱方法确定出它们的结构,其中一种具有抗肿瘤活性;郭承华等[14]采用甲醇提取法对分布在黄海海域的金氏真蛇尾皂苷进行了提取制备及理化特性的初步研究,首次将其命名为蛇尾皂苷(ophiurasaponin)。甄静荣等[15]对金氏真蛇尾皂苷的抗氧化和抑菌活性已有研究。
本实验主要针对产自黄海的金氏真蛇尾多糖的抗氧化(对自由基清除能力的测定)和抑菌(对不同菌种的抑菌圈直径和最低抑菌浓度的测定)活性进行研究,对其在功能性食品和保健品行业的应用提供技术支持,以期为蛇尾纲动物资源的开发利用提供理论依据。
1 材料与方法
1.1材料与试剂
金氏真蛇尾(Ophiura kinbergi):2012年5月采于烟台崆峒岛,洗净晾干,粉碎备用;大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)、啤酒酵母菌(Saccharomyces cerevisiaeHansen)和青霉(Penicillium glaucum):本校微生物实验室提供。
三羟甲基氨基甲烷、三氯甲烷、正丁醇、邻菲啰啉、磷酸氢二钠、磷酸二氢钠、硫酸亚铁、抗坏血酸、焦性没食子酸、铁氰化钾、三氯乙酸、三氯化铁等(分析纯):国药集团化学试剂有限公司。
1.2仪器与设备
Buchi R-3旋转蒸发仪:瑞士BUCHI公司;20PR-520型冰冻离心机:日本Hitachi Koki有限公司;T6新世纪型紫外分光光度计:北京普析通用仪器有限公司;DZF-6020型真空干燥箱:上海博讯实业有限公司。
1.3实验方法
1.3.1蛇尾多糖的提取
称取一定量已粉碎的金氏真蛇尾干燥粉末,用等量丙酮浸泡8 h,弃掉上清液,此步骤重复3次,收集残渣后将其真空干燥;把脱脂处理后的金氏真蛇尾粉末用0.1 mol/L的NaOH溶液浸泡提取3次,料液比为1∶20(g∶mL),将3次滤液合并,并对其减压浓缩;随后用1 mol/L的HCl将浓缩液的pH调整为7.0,向其中加入适量的中性蛋白酶,于50℃水浴锅中加热搅拌2 h;将溶液进行离心,取上清液并将其浓缩。参照Sevag法[16]对上述多糖溶液进行脱蛋白处理,使用截留分子质量为3 000 u的透析袋对多糖溶液进行透析;加入体积分数为80%的乙醇溶液于多糖溶液中进行醇沉,静置后重复离心,直到无沉淀为止,所得沉淀物即为金氏真蛇尾多糖,将其干燥至恒质量备用[17]。
1.3.2蛇尾多糖的理化性质测定
采用硫酸-苯酚法,参照文献[18-19]的方法测定金氏真蛇尾多糖含量,利用浓盐酸-BaCl2沉淀法鉴定是否含有硫酸根基团,并进行Molish反应鉴定蛇尾多糖是否含有单糖及碘-碘化钾反应鉴定蛇尾多糖是否为非淀粉多糖。
1.3.3蛇尾多糖的抗氧化活性测定
(1)还原力的测定
配制质量浓度为0.02 g/mL的碱提多糖溶液,参照LEE S C等[20]的方法测定多糖溶液的还原能力,波长700 nm处测定吸光度值A,阳性对照用质量浓度为0.02 g/mL的维生素C(vitamin C,VC)溶液,空白对照用蒸馏水代替多糖溶液。所测还原力以吸光度值A700nm表示。
(2)对羟基自由基(·OH)的清除作用
取1 mL质量浓度梯度为0.5 mg/mL、1.0 mg/mL、1.5 mg/mL、2.0 mg/mL、2.5 mg/mL的多糖溶液,采用Fenton反应[21],在波长536 nm处测定多糖样品溶液吸光度值A3,空白吸光度值为A1,空白对照吸光度值为A2,样品对照吸光度值为A4,空白参比吸光度值为A0,以VC溶液作为阳性对照。各试剂的添加顺序及添加量具体参见表1。
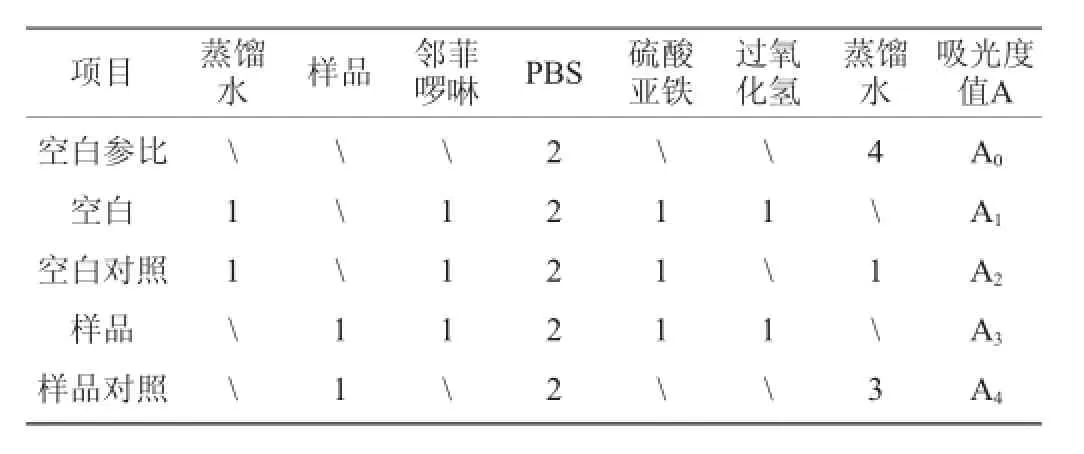
表1 蛇尾多糖对·OH清除作用反应体系Table 1 Reaction system of the scavenging of theOphiura kinbergi polysaccharide on·OHmL

(3)对超氧阴离子自由基(O2-·)的清除作用
采用邻苯三酚自氧化法[22],测定质量浓度为0.5mg/mL、1.0 mg/mL、1.5 mg/mL、2.0 mg/mL、2.5 mg/mL的多糖溶液对O2-·的清除作用,在波长325 nm处测定多糖样品溶液吸光度值A1,样品空白吸光度值为A2,模型对照吸光度值为A3,阳性对照为VC。各试剂添加顺序不能改变,具体添加顺序及添加量见表2。

表2 蛇尾多糖对O2-·清除作用反应体系Table 2 Reaction system of the scavenging of theOphiura kinbergi polysaccharide on O2-·mL

1.3.4蛇尾多糖的抑菌活性测定
(1)菌悬液的制备
配制牛肉膏蛋白胨培养基(用于培养细菌,37℃恒温培养箱中培养24 h)和酵母浸出粉胨葡萄糖培养基(用于培养真菌,30℃恒温培养箱中培养48 h,其中青霉培养72 h)。将供试菌种接种到斜面培养基上,置于恒温培养箱中培养。将活化的原菌种全部溶解到10 mL无菌生理盐水中,混匀。另取6支盛有9 mL无菌生理盐水的试管,取1 mL已溶解的原菌种溶于9 mL无菌生理盐水的试管中,充分打散,依此类推,分别配制成浓度为10-1、10-2、10-3、10-4、10-5、10-6CFU/mL的菌悬液,备用。
(2)抑菌圈大小的测定
采用滤纸片法[23],滤纸片直径d为6 mm,取0.3 mL浓度为10-6CFU/mL的菌悬液于盛有培养基的平板中,涂匀,取0.5 mL用无菌水配制的质量浓度为2.0 mg/mL的多糖溶液,用氯霉素为细菌的阳性对照试验,硝酸咪唑康为真菌的阳性对照,阴性对照均为无菌生理盐水;测定蛇尾多糖对大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)、啤酒酵母菌(Saccharomyces cerevisiae)和青霉(Penicillium glaucum)的抑制圈直径,重复3次取平均值。
(3)最低抑菌浓度的测定
采用平板划线法测定最低抑菌浓度(minimalinhibitory concentration,MIC)。分别吸取0.5 mL质量浓度为4.000 mg/mL、2.000 mg/mL、1.000 mg/mL、0.500 mg/mL、0.250 mg/mL、0.125 mg/mL的蛇尾多糖溶液加入已灭菌的培养皿中,然后倒入培养基。采用划线接种法,培养供试的细菌和真菌,置于恒温培养箱中,观察是否有菌落生长;阴性对照为无菌生理盐水。无菌落生长的培养皿为金氏真蛇尾多糖的最低抑菌浓度(MIC),重复3次取平均值。
2 结果与分析
2.1蛇尾多糖理化性质测定结果
以葡萄糖质量浓度(x)为横坐标,吸光度值(y)为纵坐标,得到葡萄糖标准曲线回归方程为:y=0.445 5x+0.004 7(相关系数R2=0.996 7),多糖含量为3.18%;硫酸基团鉴定实验结果显示多糖中含有硫酸根;Molish反应结果为阳性,表明多糖中含有单糖;碘-碘化钾反应结果为阴性,表明多糖为非淀粉多糖。
2.2蛇尾多糖抗氧化活性测定结果
2.2.1还原力的测定
抗氧化活性与总还原力之间关系密切,实验中具有强还原力的样品可以将Fe3+还原成Fe2+,Fe2+参与自由基反应生成稳定物质,由此导致体系吸光度值增加。实验中金氏真蛇尾多糖可以将铁氰化钾还原成亚铁氰化钾,亚铁氰化钾和铁离子反应生成普鲁士蓝,从而中断自氧化连锁反应,使体系吸光度值增加。实验测得空白对照的A700nm值为0.257,金氏真蛇尾多糖的A700nm值为1.145,VC的A700nm值为1.302,证明金氏真蛇尾多糖具有一定的还原力。
2.2.2对·OH的清除作用
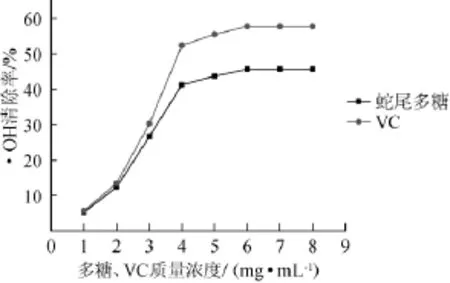
图1 蛇尾多糖和VC对·OH的清除作用Fig. 1 Scavenging effects of the Ophiura kinbergi polysaccharide and VC on·OH
由图1可知,在0~4 mg/mL质量浓度范围内,随着多糖质量浓度的增大,·OH的清除率有明显上升趋势;在多糖质量浓度为4 mg/mL,达到最大清除率为45.68%;多糖质量浓度>4 mg/mL以后,·OH的清除率趋于稳定。结果表明,多糖具有一定的·OH的清除作用,但是仍小于同质量浓度抗坏血酸溶液。
2.2.3对O2-·的清除作用
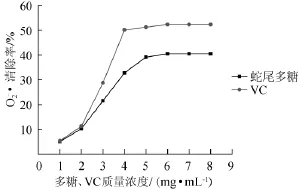
图2 蛇尾多糖和VC对O2-·的清除作用Fig.2 Scavenging effects of theOphiura kinbergipolysaccharide and VC on O2-·
由图2可知,在0~5 mg/mL质量浓度范围内,随着多糖质量浓度的增大,O2-·清除作用也逐渐增强;在多糖质量浓度为5 mg/mL,达到O2-·最大清除率为40.47%;多糖质量浓度>5 mg/mL以后,O2-·清除率趋于稳定。结果表明,多糖O2-·具有一定的清除作用,但是仍小于同质量浓度VC溶液。
2.3蛇尾多糖抑菌活性测定结果
2.3.1抑菌圈大小测定
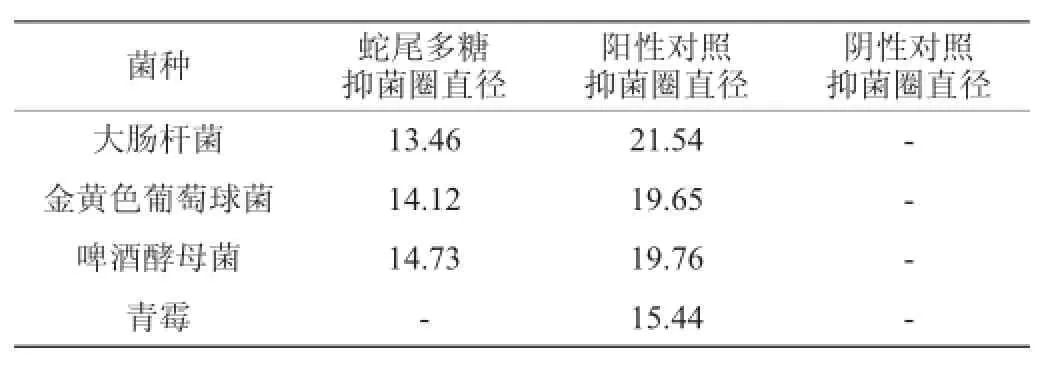
表3 蛇尾多糖的抑菌圈直径Table 3 Diameter of bacteriostatic circle of theOphiura kinbergi polysaccharidemm
由表3可知,金氏真蛇尾多糖对其中3种受试菌株具有较好的抑菌作用,其中对啤酒酵母菌和金黄色葡萄球菌的抑菌性最强,其抑菌圈直径分别是14.73 mm、14.12 mm,大肠杆菌次之为13.46 mm,而对青霉则没有抑制作用。
2.3.2最低抑菌浓度测定
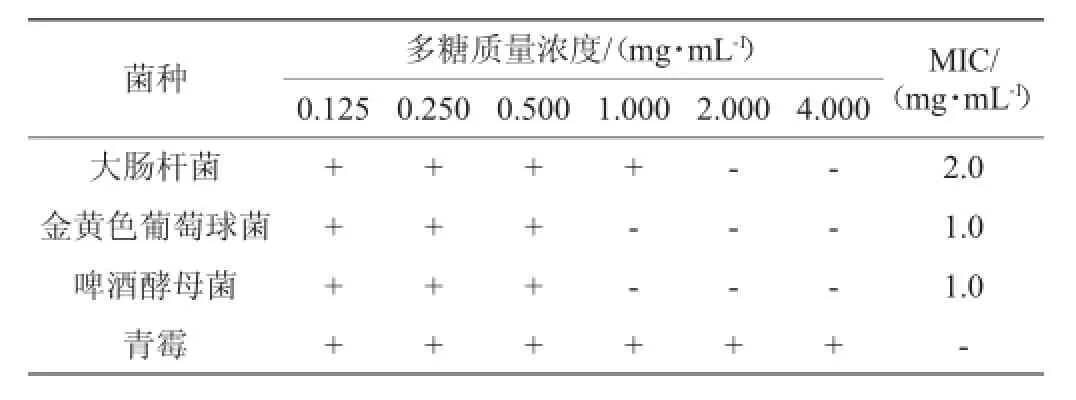
表4 蛇尾多糖最低抑菌浓度Table 4 The minimum inhibitory concentration of theOphiura kinbergi polysaccharides
由表4可知,金氏真蛇尾多糖对金黄色葡萄球菌和啤酒酵母菌的MIC值均为1.0 mg/mL,对大肠杆菌的MIC稍高为2.0 mg/mL,而对青霉无抑制作用。青霉与另外3种菌相比,适应性与生命力比较强,因此多糖对其抑制作用比较弱。
3 结论
通过对黄海产金氏真蛇尾多糖的抗氧化和抑菌活性的研究,可以看出金氏真蛇尾多糖对·OH和O2-·具有清除作用,且随着多糖质量浓度的升高而增加,在达到一定浓度以后,清除率便会趋于稳定,其最大清除率分别为45.68%和40.47%,但是仍小于同质量浓度的VC溶液,说明蛇尾多糖具有较好的抗氧化活性;同时金氏真蛇尾多糖对大肠杆菌、金黄色葡萄球菌和啤酒酵母菌的抑菌圈大小分别为13.46 mm、14.12 mm、14.73 mm,最低抑菌浓度分别为2.0 mg/mL、1.0 mg/mL、1.0 mg/mL,而对青霉则没有抑制作用。
目前,人们对蛇尾纲动物的活性成分研究尚刚起步,但蛇尾纲动物作为海洋底栖生物的重要组成部分,其在海洋生态系统、海洋功能食品、生物医药等方面具有重要及深远意义。随着研究的不断开展与深入,蛇尾纲动物资源的保护与利用亦将显示出更广阔的应用前景。
[1]廖玉麟.中国动物志无脊椎动物第四十卷棘皮动物蛇尾纲[M].北京:北京科学出版社,2004.
[2]徐勤增,李瑞香,王宗灵,等.南黄海夏季大型底栖动物分布现状[J].海洋科学进展,2009,27(3):393-399.
[3]张慧,王荣镇,郭承华.金氏真蛇尾营养成分含量测定[J].食品科学,2011,32(9):282-284.
[4]汤海峰,易杨华,张淑瑜,等.海星皂苷的研究进展[J].中国海洋药物,2004,23(6):48-57.
[5]阮伟达,苏永昌,吴成业.海参皂苷的研究现状[J].福建水产,2011,33(2):74-78.
[6]韩华,易杨华,喇明平,等.糙海参皂苷ScabrasideA、B的抗真菌和抗肿瘤活性[J].中国药理学通报,2008,24(8):1111-1112.
[7]潘广昌,郭承华,刘传琳,等.砂海星营养成分的含量测定[J].中国海洋药物,2006,25(6):46-48.
[8]MILLS V S,OHARA T D.Amphilepis neozelandicasp.nov.,the first record of the Amphilepididae in New Zealand waters(Echinodermata:Ophiuroidea)[J].Zootaxa,2010,2514:47-54.
[9]MILENA B S,TIMOTHY O'HARA.A new species in theOphiocoma erinaceuscomplex from the south-west pacificocean(Echinodermata:Ophiuroidea:Ophiocomidae)[J].Mem Mus Vic,2008,65:51-56.
[10]CHEKAREVA V,SMIRNOVA P,KOCHETKOV K.Bioorganicheskaya khimiya gangliosides from two species ofOphiura[J].Ophto Echin Ophiom Annul Clark,1991,17(3):387-397.
[11]LEVINA V,FEDOROV N,STONIK A.Teroidal compounds from brittle stars.II.sulfated steroids fromOphiura sarsiandOphiura leptoctenia[J].Khim Prir Soedin,1990(4):483-487.
[12]LEVINA E V,KALINOVSKII A I,STONIK V.A Steroidal compounds from brittle stars.I.New steroidal sulfate fromOphiura sarsi[J].Khim Prir Soedin,1988(3):375-379.
[13]林翠梧,苏镜娱,曾陇梅,等.锥疣星蔓蛇尾的化学成分[J].分析测试学报,2002,21(4):13-16.
[14]郭承华,曹建国,宁黔翼,等.罗氏海盘车、海燕、金氏真蛇尾皂甙的制备及性质鉴定比较[J].中国海洋药物,2000,19(4):28-30.
[15]甄静荣,丛建森,刘艳萍,等.金氏真蛇尾皂苷的抗氧化和抑菌活性研究[J].食品科技,2015,40(6):285-289.
[16]夏泉,刘钢,葛朝亮,等.Sevag法去除黄芪粗多糖中蛋白质成分的研究[J].安徽医药,2007,11(12):1069-1071.
[17]曲宏伟,薛晓宇,甄静荣,等.紫蛇尾多糖的抗氧化和抑菌活性研究[J].安徽农业科学,2013,41(15):6735-6736.
[18]陈杨琼,伍春莲,侯怡铃,等.松乳菇多糖含量的苯酚硫酸法检测研究[J].西华师范大学学报,2012,33(2):135-138.
[19]芦莲,戴余军,李长春.银杏叶多糖提取工艺的研究[J].中国酿造,2012,31(10):106-108.
[20]LEE S C,JEONG S M,KIM S Y.Effect of far-infrared radiation and heat treatment on the antioxidant activity of water extracts from peanut hulls[J].Food Chem,2006,94(4):489-491.
[21]叶敏.金针菇多糖的提取及清除羟自由基活性研究[J].毕节学院学报,2011,29(4):90-94.
[22]陈留勇,孟宪军,贾薇,等.黄桃水溶性多糖的抗肿瘤作用及清除自由基、提高免疫活性研究[J].食品科学,2004,25(2):167-170.
[23]李笑梅,王松.菜豆皂苷抗氧化及抑菌活性研究[J].食品科学,2011,32(7):81-84.
Research on antioxidant and antibacterial activity of polysaccharide inOphiura kinbergi
ZHEN Jingrong,CONG Jiansen,QU Jiangyong,HOU Jianhai,GUO Chenghua*
(College of Life Sciences,Yantai University,Yantai 264005,China)
WithOphiura kinbergiin Huanghai Sea as raw materials,after degreasing and deproteinization,the polysaccharide inO.kinbergi was obtained by alkali extraction method.The capacity of scavenging free radicals of polysaccharide solution was measured by Fenton reaction and pyrogallol autoxidation method.The inhibiting effect ofO.kinbergipolysaccharide onEscherichia coli,Staphylococcus aureus,Saccharomyces cerevisiae Hansen andPenicillium glaucumwas measured by filtering paper method.The results showed that theO.kinbergipolysaccharide had good scavenging effect on hydroxyl radical(·OH)and superoxide anion radical(O2·-),and the clearance rate showed dose-effect relationship with polysaccharide solution.The maximum clearance rates of·OH and O2·-of polysaccharide were 45.68%and 40.47%,respectively,which showed that theO.kinbergi polysaccharide had a certain antibacterial activity,but it was less than the antibacterial activity of VC in the same concentration.TheO.kinbergi polysaccharide had good antibacterial activity onE.coli,S.aureusandS.cerevisiaeHansen.The diameters of antibacterial circle were 13.46 mm,14.12 mm and 14.73 mm,but it had no antibacterial activity onP.glaucum.The study indicated theO.kinbergipolysaccharide had good antioxidant effect and antibacterial activity.
Ophiura kinbergi;polysaccharide;antioxidant activity;antibacterial activity
Q539.7
A
0254-5071(2015)11-0136-04
10.11882/j.issn.0254-5071.2015.11.031
