一株海洋拮抗菌的筛选与鉴定
2015-09-29李永秋陈淑琼张文森徐慧诠唐慧华邓加聪福建师范大学福清分校海洋与生化工程学院福建福清350300福建师范大学福清分校朗姆多果酒研究所福建福清350300
郑 虹,李永秋,陈淑琼,张文森,徐慧诠,唐慧华,邓加聪*(.福建师范大学福清分校海洋与生化工程学院,福建福清350300;.福建师范大学福清分校朗姆多果酒研究所,福建福清350300)
一株海洋拮抗菌的筛选与鉴定
郑虹1,李永秋1,陈淑琼1,张文森2,徐慧诠2,唐慧华2,邓加聪2*
(1.福建师范大学福清分校海洋与生化工程学院,福建福清350300;2.福建师范大学福清分校朗姆多果酒研究所,福建福清350300)
通过平板分离、摇瓶发酵,从样品中分离到1株对枯草芽孢杆菌、藤黄八叠球菌、大肠杆菌等指示菌具有较强拮抗作用的菌株HY4,通过菌落形态、镜检、生理生化试验和对菌株16S rRNA基因序列遗传分析对菌株进行鉴定,发现该菌株跟芽孢杆菌属(Bacillus)的多数菌株序列有99%的相似性,将该菌株命名为芽孢杆菌HY4。当培养时间为48 h时,菌株的生物量达到最大值,OD600nm为2.49,此时菌株对枯草芽孢杆菌和藤黄八叠球菌的抑菌活性也达到最高,透明圈直径分别为1.38 cm和1.13 cm,当培养至60 h时,菌株对大肠杆菌的抑菌活性也达到最大,透明圈直径为1.13 cm,之后随着培养时间的延长,抑菌活性反而逐渐降低。
海洋拮抗菌;筛选;鉴定;抑菌活性
海洋面积占地球面积的70%以上,而长期生活于海洋这一高压、高盐、严寒的封闭环境的海洋微生物,自身带有一套特殊的代谢途径,进而产生一些作用独特的代谢产物[1-3]。已发现的海洋微生物有沙雷氏菌属[4]、芽孢杆菌属[5-6]、不动杆菌属[7]、假单胞菌属[8-10]、酵母菌属[11]、链霉菌属[12]、微藻[13]等,占整个海洋微生物不足5%。如此巨大的海洋资源尚未得到开发利用,从海洋微生物的次级代谢产物中寻找新颖的生物活性物质,成为当前微生物学研究的一个重要方向。
本研究报道了1株对多种细菌具有拮抗作用的海洋菌株HY4的筛选、鉴定及培养时间对该菌株生长和抑菌活性的积累进行了初步研究,以期为菌株HY4后期的开发与应用提供理论依据。
1 材料与方法
1.1材料与试剂
1.1.1分离材料与试验菌株
土样和水样:取自福清市江阴镇近海海域;藤黄八叠球菌(Sarcina lutea)、枯草芽孢杆菌(Bacillus subtilis)、大肠杆菌(Escherichia coli):保存于福建师范大学福清分校生物与化学工程学院微生物实验室。
1.1.2化学试剂
牛肉膏、氯化钙、硫酸镁、酵母膏、甘淮、硼酸、磷酸氢二钾、磷酸二氢钾、蔗糖、氯化铁、磷酸二氢钠、可溶性淀粉、麦芽糖、葡萄糖、硫酸铵、蛋白胨、硝酸钾、尿素(分析纯):国药集团药业股份有限公司。
1.1.3培养基
富集培养基:牛肉膏3.0 g/L,蛋白胨10.0 g/L,NaCl 5.0 g/L,pH 7.0,121℃灭菌15 min。
分离平板培养基:可溶性淀粉20 g/L,硝酸钾1.0 g/L,氯化钠0.5 g/L,磷酸二氢钾0.5 g/L,硫酸镁0.5 g/L,硫酸亚铁0.01 g/L,琼脂20.0 g/L,pH 7.0~7.2,121℃灭菌15 min。
试管斜面培养基(或牛肉膏蛋白胨培养基):牛肉膏3.0 g/L,蛋白胨10.0 g/L,NaCl 5.0 g/L,琼脂10.0 g/L,pH 7.0,121℃灭菌15 min。
发酵培养基:可溶性淀粉20 g/L,硝酸钾1.0 g/L,氯化钠0.5 g/L,磷酸二氢钾0.5 g/L,硫酸镁0.5 g/L,硫酸亚铁0.01 g/L,pH 7.0~7.2,121℃灭菌15 min。
1.2仪器与设备
LDZX-40BI立式自动电热压力蒸气灭菌器:上海申安医疗器械有限公司;GSP-9050MBE隔水式恒温培养箱:苏州江东精密仪器有限公司;SW-CJ-IFD超净工作台:苏州安泰空气技术有限公司;THZ-C台式恒温振荡器:太仓市华美生化仪器厂;DHG-9076A电热恒温鼓风干燥箱:上海精宏实验设备有限公司;H1850R高速台式冷冻离心机:湖南湘仪离心机仪器有限公司。
1.3方法
1.3.1海洋拮抗菌的分离纯化
称取1 g土样或1 mL水样加入100 mL无菌水中,摇匀后,取1 mL稀释液接种于100 mL的富集培养基中,30℃、120 r/min振荡培养24 h;将富集液按10倍稀释法进行稀释,稀释至10-6、10-7、10-8,每个梯度取0.2 mL涂布于分离平板,30℃倒置培养24 h。
1.3.2海洋拮抗菌的初筛
将分离得到的单菌落用点接的方法接种于接种有指示菌的牛肉膏蛋白胨培养基平板和没有指示菌的牛肉膏蛋白胨培养基平板(作为对照)上,每株菌重复3个平行,1个对照,30℃倒置培养24 h,筛选出有抑菌圈的菌株接种于试管斜面,编号,4℃冰箱保存,备用。
1.3.3海洋拮抗菌的复筛
将初筛得到的菌株接种于试管斜面30℃活化24 h;从活化好的试管斜面中挑取2环菌苔,接种于装有100 mL液体发酵培养基的250 mL三角瓶中,30℃、120 r/min振荡培养72 h,测定发酵液的抑菌活性。
1.3.4海洋拮抗菌的鉴定
海洋拮抗的部分生理生化鉴定参照文献《常见细菌快速鉴定手册》[14]、《微生物学实验》[15]进行。
1.3.5菌株HY416S rRNA基因序列遗传分析
(1)菌株HY4基因组的提取
按照生工SK8255柱式细菌基因组DNA抽提试剂盒说明书提取菌株基因组DNA。
(2)16S rRNA基因的扩增与分析
采用细菌通用引物进行扩增,正向引物16s-F:5′-CA GAGTTTGATCCTGGCT-3′,反向引物16s-R:5′-AGGAG GTGATCCAGCCGCA-3′。PCR反应体系为:10×buffer 2.5 μL、dNTP 1 μL、PCR引物各0.5 μL、Taq酶0.5 μL、DNA模板0.5 μL,加灭菌双蒸水至25 μL。PCR反应条件为:94℃、4 min;94℃、45 s,55℃、45 s,72℃、1 min,循环30次;72℃延伸10 min。扩增产物用0.8%的琼脂糖凝胶电泳进行检测。
16S rRNA基因测序委托上海生工公司完成。测序序列与NCBI网站GenBank中的已知序列进行Blast。采用MAGE 4.0软件中Bootstrap Test of Phylogeny的N-J算法(bootstrap参数为1 000)构建系统进化树,进行系统发育的分析。
1.3.6培养时间对菌株HY4产拮抗物质的影响
冰箱保存的菌株HY4接种于试管斜面30℃活化24 h;从活化好的试管斜面中挑取2环菌苔,接种于装有100 mL液体发酵培养基的250 mL三角瓶中,30℃、120 r/min振荡培养,每隔12 h取样测定发酵上清液的抑菌活性。
1.3.7发酵液中抑菌活性的测定
细菌抑菌活性的测定方法采用牛津杯法[16-17]。
取50 mL发酵液5 000 r/min、4℃离心5 min,收集上清液备用;活化后的指示菌用无菌水刮下菌苔并稀释,使菌悬液浓度为107CFU/mL,备用;在平板中加入10 mL牛肉膏蛋白胨培养基,凝固后再加入混有指示菌的牛肉膏蛋白胨培养基(每100 mL牛肉膏蛋白胨培养基中加入1 mL上述指示菌菌悬液),每个平板加入6个牛津杯;在平板的每个牛津杯中加入200 μL发酵上清液,以无菌水作为对照,于37℃静置培养16 h,观察并记录结果。
2 结果与分析
2.1海洋拮抗菌的初筛
将分离纯化筛选到的单菌落点接于接种有指示菌的牛肉膏蛋白胨平板培养基,30℃倒置培养24 h。经过稀释分离和平板初筛,从土样和水样中共分离得到7株对枯草芽孢杆菌、大肠杆菌和藤黄八叠球菌都有抗性的菌株,编号为HY1、HY2、HY3、HY4、HY5、HY6、HY7。
2.2海洋拮抗菌的复筛
将初筛得到的菌株接种于发酵培养基,30℃、120r/min振荡培养72 h,采用牛津杯法测定发酵上清液的抑菌活性。结果见图1。

图1 不同菌株对指示菌的抑菌性Fig.1 Antimicrobial activity of different strains on the indicator bacteria
由图1可见,初筛得到的7株具有抑菌活性的拮抗菌,其抑菌性有一定的差别,菌株HY3、HY4、HY5及HY7对3种指示菌的透明圈直径均>1 cm,其中菌株HY4对枯草芽孢杆菌、大肠杆菌和藤黄八叠杆菌抑菌圈直径分别为1.25cm、1.30 cm和1.23 cm。因此选择菌株HY4作为本试验的研究对象。
2.3海洋拮抗菌HY4的初步鉴定
2.3.1海洋拮抗菌HY4的菌落和菌株形态观察
将菌株HY4接种于试管斜面30℃活化24 h,进行菌落和菌株形态观察。结果见图2。
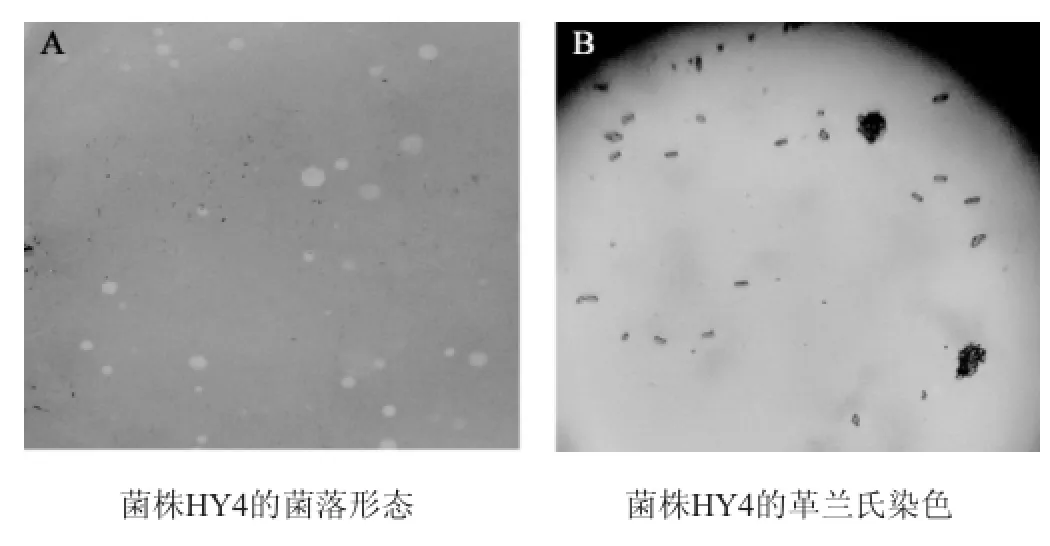
图2 菌株HY4菌落(A)和菌株形态(B)Fig.2 Colonies(A)and strain morphology(B)of the strain HY4
由图2可见,在分离平板培养基上,菌株HY4的菌落颜色为乳白色,菌落较大,湿润;显微镜下,菌株呈杆状结构,革兰氏染色为阳性。
2.3.2海洋拮抗菌HY4的生理生化鉴定
按文献《常见细菌快速鉴定手册》对菌株HY4的部分生理生化进行鉴定,结果见表1。

表1 菌株HY4的部分生理生化试验Table1 Physiological and biochemical tests of the strain HY4
由表1可知,菌株HY4可水解淀粉,明胶液化,会产生脲酶。
2.4海洋拮抗菌HY4 16S rRNA的遗传分析
2.4.1海洋拮抗菌HY4基因组的提取及扩增
将提取到的菌株HY4基因组DNA为模板进行PCR扩增,结果见图3。由图3可知,经电泳得知该扩增产物大小约为1 424 bp的16S rRNA基因。

图3 菌株HY4 16S rRNA电泳图Fig.3 The electrophoregram of 16S rRNA of the strain HY4
2.4.2菌株16S rRNA基因遗传学分析
将提取得到的16S rRNA基因序列进行全长测序后,与NCBI网站的核酸数据库进行在线比对,结果显示该菌株的序列与芽孢杆菌属(Bacillus)的多株菌具有99%以上的同源性。随机抽取若干个序列进行系统进化树的构建,结果见图4。
由图4可见,菌株HY4与芽孢杆菌属(Bacillus)聚为一类,且与登陆号EU584537.1、KJ943972.1等菌株16S rRNA序列的同源性达到99%。因此,在细菌系统发育分类学上,将该菌株鉴定为芽孢杆菌,命名为芽孢杆菌(Bacillussp.)HY4。

图4 菌株HY4的序列分析Tig.4 Sequence analysis of the strain HY4
2.5培养时间对海洋拮抗菌HY4抗拒性的影响
活化后的菌株HY4接种于发酵培养基,30℃、120r/min振荡培养,以枯草芽孢杆菌、藤黄八叠球菌、大肠杆菌为指示菌,每隔12 h测定发酵上清液的抑菌活性,结果见图5。
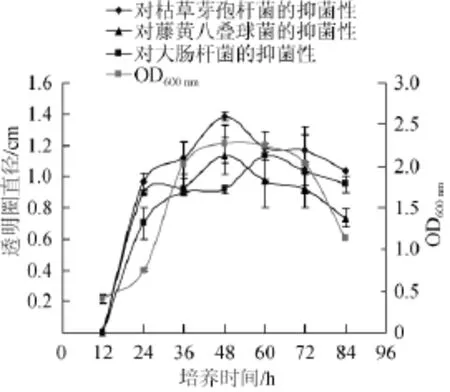
图5 培养时间对菌株HY4产抑菌活性的影响Fig.5 Effect of culture time on the antibacterial activity of the strain HY4
由图5可见,菌株HY4的生物量及对枯草芽孢杆菌、大肠杆菌和藤黄八叠球菌的抑菌性均随着培养时间的延长呈先增后降的趋势,菌株HY4的生物量完全符合细菌生长的4个时期:0~12 h为菌株HY4的适应期,12~36 h为该菌株的对数生长期,36~72 h为菌株的生长稳定期,72 h后是菌株的衰亡期,当培养时间为48 h时,菌株的生物量达到最大值,OD600nm为2.49,此时菌株对枯草芽孢杆菌和藤黄八叠球菌的抑菌活性也达到最高,透明圈直径分别为1.38 cm和1.13 cm,当培养至60 h时,菌株对大肠杆菌的抑菌活性也达到最大,透明圈直径为1.13 cm,之后随着培养时间的延长,抑菌活性反而逐渐降低。由此可见,菌株抑菌活性的产生和积累与菌株的生长不呈平行关系。
3 结论
通过平板分离、摇瓶发酵,从江阴码头附近海域中分离到1株对枯草芽孢杆菌、藤黄八叠球菌、大肠杆菌等指示菌具有较强拮抗作用的菌株HY4;通过菌落形态、镜检、生理生化试验和菌株16S rRNA基因序列遗传分析,发现该菌株跟芽孢杆菌属(Bacillus)的多数菌株的16S rRNA基因序列有99%的相似性,将该菌株鉴定为芽孢杆菌HY4(BacillusHY4)。当培养时间为48 h时,菌株的生物量达到最大值,OD600nm为2.49,此时菌株对枯草芽孢杆菌和藤黄八叠球菌的抑菌活性也达到最高,透明圈直径分别为1.38 cm和1.13 cm,当培养至60 h时,菌株对大肠杆菌的抑菌活性也达到最大,透明圈直径为1.13 cm,之后随着培养时间的延长,抑菌活性反而逐渐降低。
[1]胡江春,王楠,潘华奇,等.海洋微生物抗菌脂肽及新生物农药研发[J].微生物学杂志,2014,33(6):1-5.
[2]杨凯琳,程文胜,候峰,等.海洋微生物次级代谢产物及其抑菌活性研究进展[J].中国海洋药物,2013,32(3):71-81.
[3]王蓉.海洋微生物活性物质研究进展[J].中国科技信息,2014,490(6):25-27.
[4]刘军,张帅帅,杨娜.1株高产红色素海洋菌的初步鉴定及色素性质研究[J].江苏农业科学,2010(3):318-320.
[5]王洪强.一株海洋芽孢杆菌代谢产物的研究[D].宁波:宁波大学硕士论文,2013.
[6]钟泓波,郇惠杰,雷芬芬,等.产蛋白酶深海细菌的筛选及其蛋白酶酶学性质[J].食品与发酵工业,2013,39(8):108-112.
[7]陈世建.一株海洋过氧化氢酶高产菌YS0810的鉴定、产酶条件和酶学性质研究[D].上海:上海海洋大学硕士论文,2013.
[8]张柯,丁翠玲.一株海洋拮抗菌的分离鉴定及其培养特性研究[J].海洋湖沼通报,2011(2):79-85.
[9]崔少飞,董超,史延茂,等.产蛋白酶海洋微生物的筛选鉴定及发酵[J].中国酿造,2013,32(6):110-115.
[10]于洁,李子,周长景,等.杀线虫海洋细菌G-23的鉴定及培养条件研究[J].青岛大学学报:工程技术版,2014,29(2):94-97.
[11]刘杰凤,马超,刘郑辉,等.海洋石淮降解酵母的分离鉴定与降解特性[J].环境科学研究,2013,26(8):899-905.
[12]桂林.海洋微生物的拮抗菌筛选及一株抗酵母放线菌YT研究[D].合肥:安徽农业大学硕士论文.2007.
[13]陈峰,田维娜,孙东哲,等.微藻对微生物的抑制作用及其抑菌机理[J].中国食品学报,2014,14(4):1-9.
[14]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[15]杨民和.微生物学实验[M].北京:科学出版社,2012.
[16]杜刚,田孟华,杨海英,等.猪饲料用乳酸菌增菌培养基的优化研究[J].安徽农业科学,2011,39(9):5259-5260、5262.
[17]张辉华,曹永长,毕英佐,等.6株乳酸菌体外抑菌实验[J].中国兽医杂志,2011,37(7):8-10.
Screening and identification of a marine antagonistic bacterium
ZHENG Hong1,LI Yongqiu1,CHEN Shuqiong1,ZHANG Wensen2,XU Huiquan2,TANG Huihua2,Deng Jiacong2*
(1.College of Ocean and Biochemical Engineering,Fuqing Branch of Fujian Normal University,Fuqing 350300,China;2.Institute of Rum Wine,Fuqing Branch of Fujian Normal University,Fuqing 350300,China)
The strain HY4 which had antibacterial activity onBacillus subtilis,Sarcina lutea,Escherichia coliwas isolated from the samples through the plate separation,shake flask fermentation.The strain HY4 had 99%similarity to the most ofBacillussequence and was identified asBacillus HY4 by colony morphology,microscopy,physiological and biochemical tests and 16S rRNA gene sequence.When culture time was 48 h,the biomass of strain reached the maximum and OD600nmwas 2.49.At the moment,the antibacterial activity of the strain onB.subtilisandS.luteaalso reached the maximum,and the diameter of transparent circle were 1.38 cm and 1.13 cm,respectively.When culture time was 60 h,the antibacterial activity of the strain onE.colireached the maximum,and the diameter of transparent circle was 1.13 cm.Then with the prolongation of culture time,the antibacterial activity reduced gradually.
marine antagonistic bacterium;screening;identification;antibacterial activity
Q93
A
0254-5071(2015)11-0109-04
10.11882/j.issn.0254-5071.2015.11.025
2015-10-12
福建省大学生创新创业基金项目(20422335);福建省自然科学基金项目(2015J01132);福建省教育厅中青年教师项目(JA15569);福建省中青年教师教育科研项目(JA11285);福建省科技计划引导性项目(2015N0004)
郑虹(1981-),女,实验师,硕士,研究方向为微生物菌株筛选及发酵。
邓加聪(1981-),男,副教授,博士研究生,研究方向为微生物菌株筛选及发酵。
